樟芝固态发酵生产Antroquinonol及萃取Antroquinonl的研究
喻学淳,夏永军,张 欢,许赣荣,张薄博
(江南大学工业生物技术教育部重点实验室,江苏无锡214122)
樟芝(Antrodia Camphorata),又名牛樟芝、牛樟菇、红樟菇等,有“灵芝之王”、“森林红宝石”之称。野生樟芝只生长在台湾本土的牛樟树(Cinnamomum kanehirae)上,通常腐生于上百年的树干空洞内,野生樟芝子实体具有浓郁的樟香气味[1]。樟芝子实体作为传统药物,被台湾土著居民用作治疗疾病的良药。近年来,众多研究表明,已确定樟芝产品具有保肝、抗肿瘤、抗氧化、调节免疫、解毒、抗炎等功效[2]。樟芝子实体具有的这些功效与其含有的众多活性成分有关,其主要活性成分是多种三萜类化合物[3-6]、活性多糖、马来酸和琥珀酸衍生物、泛醌类化合物等[7-9]。Antroquinonol属于泛醌类化合物,具有显著的抗癌活性,并且,它对于肝癌细胞与正常细胞有选择性[10],目前已进入FDA二期临床实验,是具有优良前景的抗癌化合物。由于牛樟树是台湾特有的珍稀树种,野生樟芝子实体的产量极度匮乏,因此市售樟芝主要来源于人工培养,目前的人工培养方式主要有椴木培养法、固态培养法和液态培养法。椴木培养法仍然受到牛樟树稀有性的限制,液态培养法得到的樟芝产品中的产物活性成分与野生樟芝差别极大,几乎不含Antroquinonol,固态培养可模拟樟芝野生环境且不受牛樟树稀有性的限制,其代谢产物种类更接近于樟芝子实体。但目前国内外对固态发酵培养樟芝的研究比较少,对Antroquinonol的研究都集中在其药理活性上面,除了Lee等[9]首次鉴定出Antroquinonol的研究中,提到过用固态发酵法培养樟芝并用正己烷的方法萃取Antroquinonol以外,专门针对Antroquinonol的固态发酵工艺及提取方法的研究几乎没有。本文通过培养基的优化达到提高樟芝固态发酵中Antroquinonol含量的目的,并通过理论计算、模拟实验,确定了合适的樟芝固态发酵产品中Antroquinonol合适的萃取工艺条件。

表1 培养基优化实验设计Table1 The experimental design ofmedium optimization
1 材料与方法
1.1 材料与仪器
樟芝菌 上海福茂食品有限公司提供;种子液培养基 种子液培养基成分如文献[11]所示;原固态培养基(1L三角瓶) 谷物原料100g,NH4Cl 0.04g,K2HPO40.025g,MgSO40.025g,初始含水量 50% (g水/g干基),接种量 30%(m L/g干基),28℃培养;萃取原料 实验室发酵产品;乙醇 体积分数为95%,国产;乙腈 色谱级,德国Meker公司等。
DKZ-2型电热恒温振荡水槽 上海福玛实验设备有限公司;PL602-S电子天平 梅特勒—托利多仪器(上海)有限公司;SPX-250B-Z型生化培养箱 上海迅博实业有限公司医疗设备厂;SHB-IIIA循环水式多用真空泵 巩义市予华仪器有限责任公司;高效液相色谱仪 配有SPD-10AVP检测器,日本岛津公司; Sepax Amethyst C18柱(4.6mm×250mm) 美国赛分公司等。
1.2 实验方法
1.2.1 种子液培养方法 种子液培养方法如文献[11]所示。
1.2.2 分析检测方法 樟芝产品中的Antroquinonol的HPLC分析方法如文献[12]所示。
1.2.3 培养基优化方法 樟芝固态发酵中各因素的优化实验设计如表1所示。其中,初始含水量包括接种种子液含水、大米含水以及添加水。按式1计算:


1.2.4 固态发酵产物中 Antroquinonol的萃取方法 本实验室最初采用简单接触流程法,该方法各项参数为:体积分数为95%的乙醇与樟芝固态发酵产品的比例为60∶1,50℃水浴振荡萃取1.5h。然而该方法存在着三个方面的缺点:溶剂消耗量大;萃取时间长;产品中的Antroquinonol萃取不完全。因此,本次实验中考虑采用多级逆流萃取代替简单接触流程法。通过实验经验以及相关公式的计算[13-14],设计逆流萃取的萃取条件为:乙醇与萃取物料比例为10∶1(v/w),在水浴温度50℃,振荡萃取1h条件下进行三级逆流萃取。预期Antroquinonol的残留率小于1%。实验建立的三级逆流萃取过程如图1所示。根据浸提模型[14]可知,从萃取级数三中得到的第三级萃取 液中 Antroquinonol的 含量 和 残 渣 中Antroquinonol含量的相同。所以,通过标准曲线将第三级萃取液中的Antroquinonl含量换算成相应质量固态发酵产品中Antroquinonol含量,此含量即为残渣中的Antroquinonol含量,可用来计算Antroquinonol残留率。Antroquinonol残留率的计算公式如式(2)

数据430.196(mg/kg)表示样品中Antroquinonol总含量。数据来源如下:在料液比1∶60(m/v),50℃水浴振荡1.5 h的单级萃取条件下,将一份样品反复用新的萃取液萃取,直至萃取液中检测不出Antroquinonol。通 过 计 算 求 各 萃 取 液 中 的Antroquinonol含量之和,并换算成相应质量固态发酵产品中Antroquinonol含量,既得样品中Antroquinonol总含量。
2 结果与讨论
2.1 固态发酵培养基的优化实验
2.1.1 发酵基质对樟芝固态发酵产Antroquinonol的影响 固态发酵中,一方面发酵基质作为菌体生长的附着物,起着支撑发酵物的作用,影响发酵体系中的传质、传热;另一方面发酵基质作为主要营养物质,为发酵提供主要碳源及复杂的生长因子,影响着微生物的生长、代谢。因此,发酵基质的选择对樟芝固态发酵有着重要的影响。
如图2所示,以5种谷物原料为发酵基质进行樟芝固态发酵,发酵干基中Antroquinonol含量依次为:大米>糯米>小米>高粱>薏米仁。明显,高粱和薏米仁不适合作为樟芝固态发酵的基质。虽然小米适合用于樟芝固态发酵产三萜类化合物[11],但并不适合作为产Antroquinonol的固态发酵基质。糯米作为发酵基质所得到的发酵干基中Antroquinonol含量不低,但由于其粘度较大,不利于接种操作。而当大米作为发酵基质时,其发酵干基中Antroquinonol的含量最高,达到608.93mg/kg。并且大米来源广泛,价格低廉,所以大米是樟芝固态发酵产Antroquinonol的最佳发酵基质。以下实验均采用大米作为发酵基质。
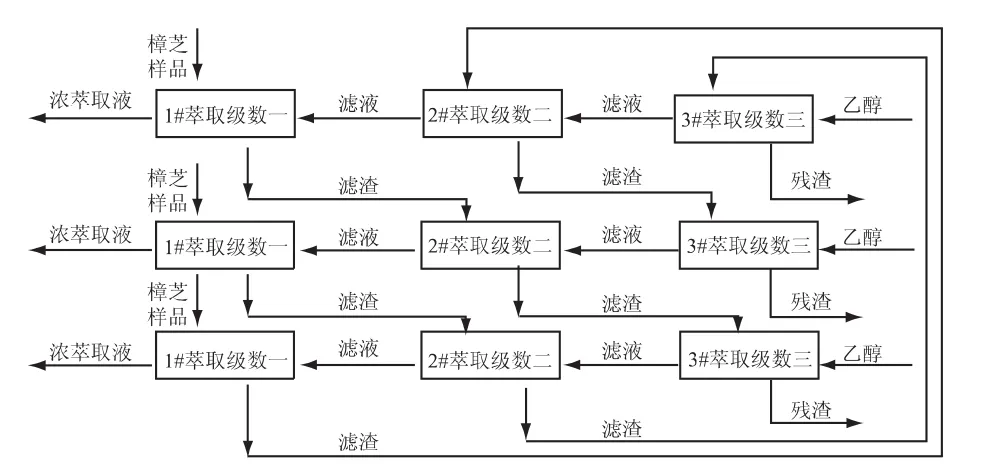
图1 樟芝固态发酵产品中Antroquinonol的三级逆流萃取过程Fig.1 The three-stage countercurren extraction process of Antroquinonol in the solid-state fermentation products of A.camphorata

图2 发酵基质种类对樟芝固态发酵产Antroquinonol的影响Fig.2 The effect of fermented grain types on Antroquinonol content by A.camphorata in solid-state fermentation
2.1.2 装料量对樟芝固态发酵产Antroquinonol的影响 樟芝固态发酵采用1L三角瓶作为发酵容器,由于发酵空间有限,发酵基质的装料量对固态发酵过程中的传质、传热有着重要的影响。如果发酵基质装料量过多,发酵培养基太厚,会导致传热困难,培养基中心温度过高,且氧的传质也会受到阻碍,这些因素都不利于菌体的生长及代谢产物的合成。
如图3所示,装料量为 110g/L时,干基中Antroquinonol的含量最高,为635.31mg/kg。当装料量增大到120g/L时,干基中Antroquinonol含量下降了 40.66%。当装料量小于 110g/L时,干基中Antroquinonol含量基本上随装料量的增加而升高。说明装料量过大或者过小都不利于Antroquinonol的合成。所以选择110g/L作为发酵基质的装料量,以下实验中装料量均采用此标准。
2.1.3 初始含水量对樟芝固态发酵产Antroquinonol的影响 固态发酵基质中的含水量对基质的物理特性有着重要的影响[15-16]。含水量过高,会使谷物基质颗粒间的孔隙率减小,从而影响基质的传热、传质;含水量过低,会导致谷物基质颗粒变硬、水活度降低,从而限制微生物的生长。

图3 发酵基质装料量对樟芝固态发酵产Antroquinonol的影响Fig.3 The effect of substrate capacity on Antroquinonol content by A.camphorata in solid-state fermentation
如图4所示,初始含水量为50%时,樟芝固态发酵产品中Antroquinonol含量最高,为544.16mg/kg。含水量高于或低于 50%时,樟芝固态发酵产品中Antroquinonol含量都会受到影响。特别是当含水量太高时,培养基粘度增大,种子液与基质搅拌不均匀,不利于微生物在基质中的生长。所以选择初始含水量为50%进行固态发酵较为合适,后面的实验均采用这一标准。在实验过程中,随着发酵的进行,樟芝菌丝体慢慢地包裹住谷物基质颗粒,利用谷物基质内部的淀粉,使得发酵基质的含水量逐渐升高。在发酵结束时,樟芝固态发酵产品的含水量可达到70%左右。
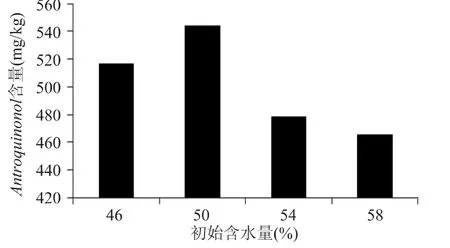
图4 初始含水量对樟芝固态发酵产Antroquinonol的影响Fig.4 The effect of initialmoisture content on Antroquinonol content by A.camphorata in solid-state fermentation
2.1.4 外加碳源(葡萄糖)对樟芝固态发酵产Antroquinonol的影响 由于固态发酵周期较长,前期很大一部分时间用于菌体的生长,而Antroquinonol是次级代谢产物,如果能缩短菌体生长时间,使发酵周期中更多的时间用于次级代谢产物的积累,就可以缩短发酵周期,提高Antroquinonol的产量。本次实验考虑添加葡萄糖作为樟芝快速生长的碳源,促进樟芝菌的快速生长,缩短发酵周期。
如图5所示,外加葡萄糖的浓度对樟芝固态发酵产品中Antroquinonol的产量有明显的影响。在葡萄糖添加量为 2.0g/L时,樟芝固态发酵产品中Antroquinonol的含量最高,达到650.46mg/kg,因此后续的实验以2.0g葡萄糖/L为外加碳源添加标准。在发酵过程中观察到,樟芝菌覆盖包裹住谷物基质颗粒的时间随葡萄糖的添加而有所提前。

图5 外加碳源(葡萄糖)对樟芝固态发酵产Antroquinonol的影响Fig.5 The effect of supplementary carbon source(glucose) on Antroquinonol content by A.camphorata in solid-state fermentation
2.1.5 氮源含量对樟芝固态发酵产Antroquinonol的影响 谷物基质中以淀粉等碳源物质为主,氮源含量很少,因此需要在谷物基质中添加一定量的氮源,以保障菌体的正常生长。樟芝固态发酵生产三萜类物质的实验中,NH4Cl是最好的氮源[11],但在樟芝固态发酵生产Antroquinonol实验中,大豆粉是最好的氮源。因此,本次实验考察大豆粉添加量对樟芝固态发酵产Antroquinonol的影响。
如图6所示,氮源添加量从0g大豆粉/L增加到0.1g大豆粉/L,樟芝产品中Antroquinonl含量随之增加。当添加量为0.3g大豆粉/L时,Antroquinnol含量达到最高,为696.83mg/kg。而继续提高氮源添加量,Antroquinonol的含量反而有所下降。所以0.3g大豆粉/L是较为合适的氮源添加量。
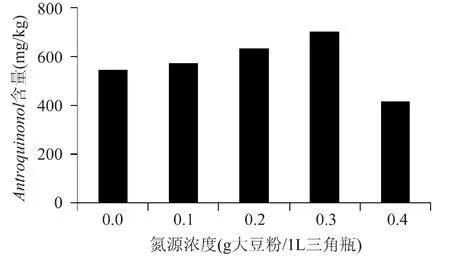
图6 氮源含量对樟芝固态发酵产Antroquinonol的影响Fig.6 The effect of nitrogen content on Antroquinonol content by A.camphorata in solid-state fermentation
2.2 固态发酵产物中Antroquinonol的萃取实验
为了从樟芝固态发酵产品中得到更多的Antroquinonol,并为其工业化生产提供理论参考,本实验考察了樟芝固态发酵产品中Antroquinonol的萃取工艺。
三级逆流萃取系统建立后,萃取系统即进入平衡过程,第一次排出滤渣时,对萃取级数一、萃取级数二、萃取级数三各取一个样,标记为取样序列1;其后的每次萃取都同时对萃取级数一、萃取级数二、萃取级数三各取一个样,取样序列依次标记。取样后微滤,用HPLC检测Antroquinonol含量并进行分析,结果如表2所示。

表2 三级逆流萃取中各级Antroquinonol含量及残留率Table2 The content and residual rate of Antroquinonol in each stage of the three-stage countercurren extraction process
在逆流萃取系统建立后的第一次取样时,在取样序列1的一级萃取液中积累了三份样品中的Antroquinonol,所以取样序列1的第一级萃取液中Antroquinonol含量最高,是取样序列2的第一级萃取液中Antroquinonol含量的2.56倍。从取样序列4开始,第一级萃取液中的 Antroquinonol含量在42~50mg/m L之间波动,这种小范围的波动是三级萃取下基本达到平衡后的标志。且从取样序列4开始,Antroquinonol的残留率小于1%,达到预期要求。并且,如表3所示,三级逆流萃取的溶剂萃取能力是单级萃取的溶剂萃取能力的6~7倍,溶剂损失变化不大,Antroquinonol残留率大大减小。因此,采用三级逆流萃取能大大提高萃取溶剂的萃取能力,极大地节约萃取溶剂的用量,这对于大规模工业应用中经济成本的降低具有重大的意义。

表3 单级萃取与三级逆流萃取参数比较Table3 The comparison of parameters between single stage extraction and three-stage countercurren extraction processes
3 结论
经实验比较,确定优化后的樟芝固态发酵产Antroquinonol的固态培养基配方是:1L三角瓶中大米装料量为110g,初始含水量为50%,外加碳源为2.0g葡萄糖,氮源添加量为 0.3g大豆粉。Antroquinonol含量从608.93mg/kg提高到696.83mg/kg,提高14.44%。
经实验发现,用体积分数为95%的乙醇作萃取剂(乙醇与萃取物料比例为10∶1,v/w),以水浴温度50℃,振荡萃取1h为萃取条件进行三级逆流浸提,残渣中的Antroquinonol残留率小于1%。该法具有溶剂使用量少,萃取效率高的优点。其溶剂萃取能力是原单级萃取的溶剂萃取能力的6~7倍,能极大地降低大规模工业应用中的经济成本。
[1]陈体强,方忠玉.珍稀药用菌樟芝研究现状[J].食用菌学报,2003,10(4):55-60.
[2]Lu M K,Cheng J J,LaiW L,et al.Adenosine as an active component of Antrodia cinnamomea that prevents rat PC12 cells from serum deprivation-induced apoptosis through the activation of adenosine A2A receptors[J].Life Sci,2006,79:252-258.
[3]Cheng I H,Chiang H C,Cheng M C,et al.Three new triterpenoids from Antrodia cinnamomea[J].JNat Prod,1995,58: 365-371.
[4]Cheng IH,Wu D P,Chiang H C.Triterpenoids from Antrodia cinnamomea[J].Phytochemistry,1996,41:263-267.
[5]Yang SW,Shen Y C,Chen C H.Steroids and triterpenoids of Antrodia cinnamomea-a fungus parasitic on Cinnamomum micranthum[J].Phytochemistry,1996,41:1389-1392.
[6]Shen C C,Kuo Y C,Huang R L,et al.New ergostane and lanostane from Antrodia camphorate[J].Chin Med,2003,14: 247-258.
[7]Cheng P C,Huang N K,Chang T T,et al.Study for anti-angiogenic activities of polysaccharides isolated from Antrodia cinnamomea in endothelial cells[J].Life Sci,2005,76: 3029-3042.
[8]Nakamura N,Hirakawa A,Gao J J.Five new maleic and succinic acid derivatives from the mycelium of Antrodia camphorata and their cytotoxic effects on LLC tumor cell Line[J].JNat Prod,2004,67:46-48.
[9]Lee TH,Lee CK,TsouW L.A new cytotoxic agent from solid state fermentedmycelium of Antrodia camphorata[J].Planta Med,2007,73:512-516.
[10]Chiang PC,Lin SC,Shiow L P,etal.Antroquinonol displays anticancer potential against human hepatocellular carcinoma cells:A crucial role of AMPK and mTOR pathways[J].Biochem Pharmacol,2010,79:162-171.
[11]张宝荣,夏永军,许赣荣.樟芝固态发酵生产三萜类化合物[J].食品工业科技,2011,32(7):174-177.
[12]夏永军,李炜疆,许赣荣.樟芝固态发酵产品活性代谢产物分析[J].食品与发酵工业,2011,37:86-90.
[13]李高阳,丁宵霖.亚麻籽双液相多级逆流萃取工艺模拟实验[J].农业工程学报,2010,26(3):380-384.
[14]高福成,许学勤,郑建仙,等.食品分离重组工程技术[M].北京:中国轻工出版社,1998:371-390.
[15]Liu B,Tzenng Y.Water contrnt and water activity for the production of cyclodepsipeptides in solid state fermentation by Metarhizium anisopliae[J].Biotechnol Lett,1999,21:657-661.
[16]Penna M L,Etcheverry M.Impact on growth and aflatoxin B1 accumulation by kluyveromyces isolates at different water acticity conditions[J].Mycopathologia,2006,162:347-353.

