白藜芦醇表观遗传学调控的研究进展
刘远锦,林亲录,罗非君
(中南林业科技大学,食品科学与工程学院,湖南长沙410000)
白藜芦醇(resveratol,Res)是一种广泛存在于葡萄科、蓼科等植物中的多酚化合物,是植物抵抗外界不利刺激如真菌、病毒感染、紫外线、机械损伤等而产生的一种植物抗毒素。已有研究表明,白藜芦醇具有抗心血管疾病、抗癌、抗动脉粥样硬化、延缓衰老、抗氧化、抗突变等多种作用[1]。白藜芦醇通过干预细胞MAPK、m TOR、JAK/STAT、PKA、PKC和细胞凋亡等相关信号转导通路调控细胞分裂、细胞生长、细胞凋亡、血管生成和肿瘤转移等,参与抗癌、抗心血管疾病、调节免疫和炎症等作用[2-5]。新近研究表明白藜芦醇还能通过表观遗传学修饰调控基因的表达,在疾病的预防与治疗中起重要作用[6-7]。本文总结了白藜芦醇参与基因甲基化、蛋白乙酰化、m iRNA异常表达等方面的研究新进展,从表观遗传学修饰的角度,综述了白藜芦醇发挥作用的新途径。
1 表观遗传学修饰方式
表观遗传学是研究基因的核苷酸序列不发生改变的情况下,基因表达了可遗传的变化的一门遗传学分支学科。表观遗传的现象很多,已知的有DNA甲基化(DNA methylation)、基因组印记(genom ic imprinting)、母体效应(maternal effects)、基因沉默(gene silencing)、RNA编辑(RNA editing)等。
DNA甲基化是指在DNA甲基化转移酶的作用下,在基因组CpG二核苷酸的胞嘧啶5’碳位共价键结合一个甲基基团,特别是基因启动子CpG岛甲基化将抑制基因的转录表达,DNA甲基化受DNA甲基转移酶催化,人类基因组包含四个转移酶基因:DNMT1、DNMT2、DNMT3A和DNMT3B[8]。DNMT表达和活性异常与多种疾病如肿瘤、心血管疾病、肥胖、2型糖尿病等密切相关。
组蛋白的去乙酰化和基因的失活相关,乙酰化转移酶(HATs)主要是在组蛋白H3、H4的N端尾上的赖氨酸加上乙酰基,去乙酰化酶(HDACs)则相反,不同位置的修饰均需要特定的酶来完成。乙酰化酶家族可作为辅激活因子调控转录,调节细胞周期,参与DNA损伤修复,还可作为DNA结合蛋白。去乙酰化酶家族则和染色体易位、转录调控、基因沉默、细胞周期、细胞分化和增殖以及细胞凋亡相关[9-10]。
功能性非编码RNA在基因表达中发挥重要的作用,按照它们的大小可分为长链非编码RNA和短链非编码RNA。常见的短链RNA为小干涉RNA(short interfering RNA,siRNA)和微小RNA(m icroRNA,miRNA),前者是RNA干扰的主要执行者,后者也参与RNA干扰但有自己独立的作用机制[11]。
2 白藜芦醇与乙酰化调控
哺乳动物Sirtuin蛋白家族包含7个成员(Sirtuin1~7),它们均含有一个由约275个氨基酸组成的保守的核心催化结构域,依赖NAD+作为辅酶,发挥去乙酰化酶或ADP-核糖基转移酶的活性,参与许多重要生命过程的调控。SIRT1可以与染色质、转录因子及转录共调控因子相互作用,通过去乙酰化作用调节基因转录、染色体稳定性和靶蛋白活性,进而参与代谢、衰老、肿瘤发生发展等一系列病理生理过程[12]。
白藜芦醇及其衍生物能直接激活去乙酰化酶SIRT1,促使转录因子FOXO3a与PGC-1α活化[13],如下图1。在小鼠动物模型中,白藜芦醇诱导SIRT1活化,激活PGC-1α与蛋白激酶AMPK,减少IGF-1表达与提高机体对胰岛素的敏感性,通过增强线粒体氧化磷酸化和有氧代谢能力,增加机体的能量消耗,延长小鼠寿命,提示白藜芦醇起着类似减少热量饮食或节食的功效[14]。
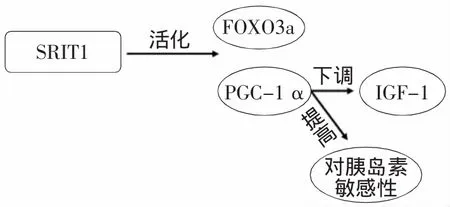
图1 SRTI1调控FOXO3a转录因子Fig.1 SRTI1 regulating transcription factor of FOXO3a
白藜芦醇导致的SIRT1活化,介导组蛋白H 3K9的去乙酰化,抑制抗凋亡蛋白Survivin的表达[15]。在前列腺癌中转移相关蛋白1(MTA1)过表达与肿瘤的侵袭性和转移相关,MTA1是核小体重塑去乙酰化(NuRD)复合物辅阻抑制子,白藜芦醇能下调MTA1蛋白表达,影响MTA1/NuRD的稳定性,乙酰化p53蛋白激活p53信号通路,上调表达促凋亡蛋白p21和Bax[16]。白藜芦醇还能通过SIRT1活化,促使形成SIRT1/p300复合物,使乙酰化酶p300失活,在乳腺癌MCF-7细胞中,白藜芦醇导致的p300失活介导HA/ CD44诱导的转录因子NFкB、TCF/LEF活化及Caspase-3活化[17]。以上证据表明,白藜芦醇主要通过Sirturins影响基因的表达,以表观遗传学修饰干预细胞信号通路,与肿瘤、衰老、肥胖等防治密切相关。
3 白藜芦醇与甲基化调控
相对于其他营养活性成分如儿茶素,白藜芦醇显示较低的DNMT抑制活性[18]。在乳腺癌MCF-7细胞中,白藜芦醇能抑制芳香烃受体(AhR)活化,阻止AhR与抑瘤基因BRCA1启动子的结合,进而促进17β-雌二醇诱导的BRCA1基因转录与蛋白表达,同时发现组蛋白H 3K9存在甲基化与组蛋白的乙酰化,白藜芦醇处理MCF-7细胞,能部分恢复其组蛋白甲基化与组蛋白的乙酰化[19]。白藜芦醇不能抑制食道癌细胞中维甲酸受体β2(RAR beta 2)和MGMT基因启动子的甲基化,并不影响RAR beta 2的表达[20-21]。白藜芦醇能抑制转录因子STAT3的乙酰化,影响DNMT1-STAT3复合物,参与雌激素受体α启动子甲基化[22]。迄今为止,尚未发现白藜芦醇能直接影响DNMTs活性,其甲基化作用主要是以间接方式进行调控。
4 白藜芦醇与m iRNA调控
m iRNA是一类非编码RNA,负调控基因的表达。白藜芦醇具有抗癌活性,基因芯片分析前列腺癌细胞白藜芦醇处理后m iRNA表达谱的变化,发现51个miRNA表达异常,下调表达的miR-17-92、miR-106a、m iR-106b等均为致癌m iRNAs,且发现m iR-106簇靶向PTEN,促使抑癌基因PTEN高表达[23]。基因芯片分析非小细胞肺癌(NSCLC)A549细胞,发现白藜芦醇处理71个m iRNAs表达异常,其潜在靶基因分别参与细胞凋亡、细胞周期、细胞增殖和分化的调控[24]。
Sheth S等[25]发现白藜芦醇能下调前列腺癌细胞m iRNA-21表达,促使其抑瘤基因PDCD4表达,在裸鼠移植瘤模型中,能抑制前列腺癌细胞的转移。在人支气管上皮细胞16HBE-T中,白藜芦醇处理导致miR-622表达上调,瞬时转染miR-622能抑制支气管上皮细胞和肺癌H 460细胞增殖,细胞周期阻滞于G(0)期及抑制裸鼠移植瘤的生长等,进一步发现miR-622靶向K-ras,抑制其蛋白表达,从而起抗癌作用[26]。Tili E等发现白藜芦醇能增加m iR-663在结直肠癌SW 480细胞中的表达,通过靶向抑瘤基因PDCD4或PTEN,抑制TGFβ信号转导通路的活化,参与其抗癌作用[27]。白藜芦醇也能上调免疫细胞如THP-1单核细胞miR-663的表达,直接靶向JunB、JunD基因的mRNA转录本,抑制其表达,而JunB、JunD为转录因子AP-1的重要组成成分,AP-1在LPS诱导的单核细胞炎症中起关键作用,白藜芦醇能过m iRNA起抗炎作用[28]。在乳腺癌细胞中,白藜芦醇通过抑制pAKT和C/ EBP-β的磷酸化,下调抑瘤基因m iR-145的表达,从而促使m iR-145靶基因如c-Myc等表达增加[29]。白藜芦醇可能调控多达百种以上m iRNAs,而每一种miRNA又可能存在多个靶基因,将形成白藜芦醇调控基因表达的信号网络。
5 展望
表观遗传学的改变已被认为是最有前途的疾病防治新战略。营养表观遗传学(nutriepigenetics)已成为一个令人兴奋的新领域,膳食中的活性成分通过表观遗传学调控基因表达,参与细胞凋亡、增殖、分化、细胞周期调控、炎症等病理生理过程。食品中活性成分的研究到目前为止,仍然主要集中于体外研究。在动物模型或人类干预方面的研究结果是有限的,但展示的表观遗传学调控机制,将成为促进健康或预防疾病功效的天然产品开发和临床药物开发提供理论依据。
令人感兴趣的是,表观遗传学调控还能通过遗传的方式,以表观基因组(epigenom ics)影响下一代。研究人员分别给两组雄性小鼠喂食不同的食物,而雌性的小鼠食物相同,之后让他们交配,结果发现吃入低蛋白类食物的雄性小鼠的后代,脂肪和胆固醇基因表达较多,这会增加心脏病的发病几率,表观遗传学分析表明,子代约20%胞嘧啶的甲基化取决于父代的饮食,其甲基化可能与关键的脂代谢调节子Ppara有关[30]。这说明饮食因素导致的表遗传学改变在某些情况下可能无法逆转,为分子营养学研究提出了新挑战。在膳食中增加食用水果、蔬菜和其他有益的营养成分,激发“好”的表观遗传修饰,将有利于疾病的防治。
但是,表观遗传学的研究尚处于其初期和不完善阶段。表观遗传学与干细胞分化、组织再生、DNA的损伤与修复、衰老、肿瘤发生的关系,表观遗传信号的建立、维持、传递,表观遗传信号与细胞信号的互相影响,表观遗传与生长发育与生活环境的关系还未明确。如,DNA甲基化和癌变的联系,表观遗传学是怎样调控胚胎干细胞的定向分化,启动子是如何参与调控mRNA的延长等。总之,对于表观遗传学的认识和研究还存在很多空白,需要更多更深入的研究。
[1]陈卫琼,杨慧龄.白藜芦醇抗肿瘤作用机制的研究进展[J].国际病理科学与临床杂志,2008,28(5):403-407.
[2]Nakata R,Takahashi S,Inoue H.Recent advances in the study on resveratrol[J].Biol Pharm Bull,2012;35(3):273-279.
[3]Li H,Xia N,Förstermann U.Cardiovascular effects and molecular targets of resveratrol[J].Nitric Oxide,2012;26(2):102-110.
[4]Juan ME,Alfaras I,Planas JM.Colorectal cancer chemoprevention by trans-resveratrol[J].Pharmacol Res,2012,65(6):584-591.
[5]Sarkar FH,LiY,Wang Z,etal.Cellular signaling perturbation by natural products[J].Cell Signal,2009,21(11):1541-1547.
[6]Farghali H,KutinováCanováN.Resveratrol and related compounds as antioxidants with an allosteric mechanism of action in epigenetic drug targets[J].Physiol Res,2013,62(1):1-13.
[7]Papoutsis AJ,Borg JL,Selmin OI,et al.BRCA-1 promoter hypermethylation and silencing induced by the aromatic hydrocarbon receptor-ligand TCDD are prevented by resveratrol in MCF-7 cells[J].JNutr Biochem,2012,23(10):1324-1332.
[8]Stresemann C,Brueckner B,Musch T,et al.Functional diversity of DNA methyltransferase inhibitors in human cancer cell lines[J].Cancer Res,2006,66(5):2794-2800.
[9]Pham TX,Lee J.Dietary regulation of histone acetylases and deacetylases for the prevention of metabolic diseases[J].Nutrients,2012,4(12):1868-1886.
[10]Tang J,Yan H,Zhuang S.Histone deacetylases as targets for treatment ofmultiple diseases[J].Clin Sci(Lond),2013,124(11):651-662.
[11]Kala R,Peek GW,Hardy TM,etal.MicroRNAs:an emerging science in cancer epigenetics[J].JClin Bioinforma,2013,3(1):6-11.
[12]Sebastián C,Satterstrom FK,Haigis MC,et al.From sirtuin biology to human diseases:an update[J].JBio Chem,2012,287(51):42444-42452.
[13]Hubbard BP,Gomes AP,Dai H,et al.Evidence for a common mechanism of SIRT1 regulation by allosteric activators [J].Science,2013,6124(339):1216-1219.
[14]Baur JA,Pearson KJ,Price NL,et al.Resveratrol improves health and survival ofmice on a high-calorie diet[J].Nature,2006;7117(444):337-342.
[15]Wang RH,Zheng Y,Kim HS,etal.Interplay among BRCA1,SIRT1,and Survivin during BRCA1-associated tumorigenesis[J].Mol Cell,2008,32(1):11-20.
[16]Kai L,Samuel SK,Levenson AS.Resveratrol enhances p53 acetylation and apoptosis in prostate cancer by inhibiting MTA1/ NuRD complex[J].Int JCancer,2010,126(7):1538-1548.
[17]Bourguignon LY,Xia W,Wong G.Hyaluronan-mediated CD44 interaction with p300 and SIRT1 regulates beta-catenin signaling and NFkappaB-specific transcription activity leading to MDR1 and Bcl-xL gene expression and chemoresistance in breast tumor cells[J].JBio Chem,2009,284(5):2657-2671.
[18]Hardy TM,Tollefsbol TO.Epigenetic diet:impact on the epigenome and cancer[J].Epigenomics,2011,3(4):503-518.
[19]Stefanska B,Rudnicka K,Bednarek A,etal.Hypomethylation and induction of retinoic acid receptor beta 2 by concurrent action of adenosine analogues and natural compounds in breast cancer cells[J].Eur JPharmacol,2010,638(1-3):47-53.
[20]Stefanska B,Rudnicka K,Bednarek A,etal.Hypomethylation and induction of retinoic acid receptorβ2 by concurrent action of adenosine analogues and natural compounds in breast cancer cells[J].Eur JPharmacol,2010,638(1-3):47-53.
[21]Paluszczak J,Krajka-Kuzniak V,Malecka Z,et al.Frequent gene hypermethylation in laryngeal cancer cell lines and the resistance to demethylation induction by plant polyphenols[J].Toxicol In Vitro,2011,25(1):213-221.
[22]Lee H,Zhang P,Herrmann A,et al.Acetylated STAT3 is crucial formethylation of tumor-suppressor gene promoters and inhibition by resveratrol results in demethylation[J].Proc Natl Acad Sci,2012,109(20):7765-7769.
[23]Dhar S,Hicks C,Levenson AS.Resveratrol and prostate cancer:promising role for microRNAs[J].Mol Nutr Food Res,2011,55(8):1219-1229.
[24]Bae S,Lee EM,Cha HJ,et al.Resveratrol altersmicroRNA expression profiles in A549 human non-small cell lung cancer cells[J].Mol Cells,2011,32(3):243-249.
[25]Sheth S,Jajoo S,Kaur T,et al.Resveratrol reduces prostate cancer growth and metastasis by inhibiting the Akt/MicroRNA-21 pathway[J].PLoSOne,2012,7(12):e51655-51663.
[26]Han Z,Yang Q,Liu B,et al.MicroRNA-622 functions as a tumor suppressor by targeting K-Ras and enhancing the anticarcinogenic effect of resveratrol[J].Carcinogenesis,2012,33(1):131-139.
[27]Tili E,Michaille JJ,Alder H,et al.Resveratrol modulates the levels of microRNAs targeting genes encoding tumorsuppressors and effectors of TGFβsignaling pathway in SW480 cells[J].Biochem Pharmacol,2010,80(12):2057-2065.
[28]Tili E,Michaille JJ,Adair B,et al.Resveratrol decreases the levels of miR-155 by upregulating miR-663,a microRNA targeting JunB and JunD[J].Carcinogenesis,2010,31(9):1561-1566.
[29]Sachdeva M,Liu Q,Cao J,et al.Negative regulation ofmiR-145 by C/EBP-βthrough the Akt pathway in cancer cells [J].Nucleic Acids Res,2012,40(14):6683-6692.
[30]Carone BR,Fauquier L,Habib N,et al.Paternally induced transgenerational environmental reprogramming of metabolic gene expression inmammals[J].Cell,2010,143(7):1084-1096.

