外源水杨酸处理对采后杏果实抗冷性的影响
袁 洁,朱 璇,逄焕明,郭湾湾
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐830052)
杏(Prunus armeniacal)属蔷薇科,李属,是典型的呼吸跃变型果实[1]。杏是新疆特色产业之一,据2011年统计,新疆杏树的种植面积约为21.2万公顷,产量为132.3万吨,占全疆水果产量的22.28%[2]。杏果实采收后后熟衰老非常迅速,抗病能力下降,腐烂损失非常严重。因此,杏果实在采后运输和贮藏的过程中容易造成大量的经济损失。适宜的低温贮藏可以有效控制杏果实的采后腐烂,但杏属于冷敏性果实,在低温冷藏时易发生冷害,而且冷害症状往往在离开低温条件(冷藏)转移到温暖环境中后才表现出来,因而不易及时发现;同时,遭受冷害的杏果实极易受到病原菌的侵染,继而引起侵染性病害,造成杏果实大量腐烂。冷害的发生极大的限制了低温贮藏技术在杏果实采后贮运中的应用,因此,如何增强杏果实采后对低温的耐受性,控制冷害的发生,已成为杏贮运产业中亟需解决的问题。
水杨酸(Salicylic acid,SA)是一种广泛存在的植物内源小分子酚类化合物,是重要的内源信号分子,在调节植物的抗逆反应和植物的生长发育进程中起着重要的作用[3]。已有研究表明SA与植物抵抗低温能力有关[4]。近年来,用外源水杨酸增强园艺产品采后对低温的耐受性,减轻冷害的发生,这一方法越来越受到关注。研究结果表明,水杨酸具有提高黄瓜[5]、番茄[6]、桃[7-8]、石榴[9]、板栗[10]和枇杷[11]的抗冷性的作用。近些年,虽然已有用外源SA处理减轻果蔬抗冷性的研究,但目前关于SA处理对杏果实抗冷性影响的研究还未见相关报道。为此,本文研究了SA处理对杏果实冷藏期间品质及抗冷性的影响,以期为杏果实贮藏期间冷害的防控提供新思路,为探明SA增强采后杏果实低温耐受性的理论依据提供参考。
1 材料与方法
1.1 材料与仪器
供试杏果实 品种为赛买提,于2012年6月采自新疆库车县乌恰乡杏果园,果实采收后12h内运回新疆农业大学农产品贮运实验室,剔除伤、病果,选择大小、果色均匀、成熟度相近的杏果实进行处理;水杨酸(SA)、三氯乙酸(TCA) 分析纯,天津永晟精细化工有限公司;硫代巴比妥酸(TBA) 分析纯,上海威方精细化工有限公司。
DDS-307A型电导率仪 上海精密科学仪器有限公司;AL204-IC型电子分析天平 梅特勒托利多仪器厂,上海有限公司;CY-B型硬度计 上海伦捷仪表有限公司;GL-20G-Ⅱ型高速冷冻离心机 上海安亭科学仪器厂;XMTD-4000型电热恒温水浴锅 北京市永光明医疗仪器厂;TU-1810型紫外分光光度计 北京普希通用仪器有限责任公司。
1.2 材料处理
在实验前期的研究基础上,得到0.01g/L的SA处理对增强杏果实抗冷性效果最好,因此,本论文选用浓度为0.01g/L的SA对杏果实进行处理。将采收后杏果实0.01g/L的SA以减压方式处理(将杏果实浸入到溶液中抽气,至压力降到0.05MPa时保持2min,然后放入空气,让果实在常压下继续浸泡8min,取出自然晾干),处理后的杏果实置于0℃、90%~95%RH的冷库贮藏,以蒸馏水处理的杏果实作为对照。贮藏期间每隔7d取样进行相关指标的测定,每处理用果10kg,重复3次。
1.3 指标测定方法
1.3.1 冷害发病率的测定 参照Dong等[12]方法并稍有改进,将杏果实冷害分为5级(见表1),每个处理观察100个杏果实,重复三次。

表1 杏果实冷害分级Table1 Chilling injury of apricot fruitgrading
以单个果实冷害程度达2级及以上计为发病果,统计发病果个数占总果数的百分率,按下式计算冷害发病率。
冷害发病率(%)=(发生冷害果实数量/果实总数)×100
1.3.2 冷害指数(CII)的测定 参照Dong等[12]方法,按下式计算冷害指数。
CII=Σ(冷害果实数×冷害级数)/总果实数×最高冷害级数
1.3.3 硬度的测定 随机取20个果实,每个果实阴阳两面各取两个点进行测定,取4个部位的平均值即为该单果的硬度值(kg/cm2),重复三次。
1.3.4 出汁率的测定 取去皮、去核的果肉,称重为W1,匀浆后于1000r/m in离心20m in,上清液为果汁,称其重量为W2。重复三次。果肉出汁率计算公式如下:
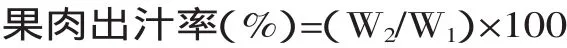
1.3.5 膜透性的测定 参照Romani等[13]方法,采用电导率法。取杏果实10个,用四号打孔器(直径为0.5cm),从每个果实纵向打孔获得果肉条,用刀片切成3mm厚的圆片100片,分别放25片在4个烧杯中,用蒸馏水反复冲洗4次,准确加入30m L蒸馏水,测电导率L1,然后在电磁炉上加热5m in后,再冷却至室温,测其电导率L2,蒸馏水电导率为L0。按下式计算膜透性。重复三次。
膜透性(%)=(L1×L0)/(L2×L0)×100
1.3.6 丙二醛含量的测定 参照Kang等[14]的方法,采用分光光度计法。
1.3.6.1 提取MDA 称取1.0g杏果实,加入5.0m L 10% TCA,置于研钵中研磨匀浆后,在4℃、10000×g条件下离心20m in,收集其上清液,于低温保存。
1.3.6.2 测定MDA的含量 取2.0m L上清液,对照中加入的是2.0m L 10%TCA溶液,再加入2.0m L 0.67% TBA,然后在沸水浴中煮沸20min,取出后冷却,再离心一次。在450、532和600nm波长下,测定上清液的吸光度值。按下式计算反应混合物中MDA含量,然后计算出每克杏果实鲜重(FW)中的MDA含量。重复三次。MDA含量用每克鲜重所含的TBARS纳摩尔数表示(nmol/g)。
MDA(nmol/g)=6.45×(OD532-OD600)-0.56×OD450
1.4 数据处理与分析
实验数据采用DPS 7.05软件进行方差分析和检验,并利用Duncan多重式比较,进行差异显著性分析,p<0.05表示差异显著,p<0.01表示差异极显著。
2 结果与分析
2.1 SA处理对杏果实冷害发病率的影响
由图1可知,SA处理可明显降低杏果实的冷害发病率。在贮藏第28d,对照组已经出现冷害症状,而SA处理组杏果实在第35d才开始出现冷害症状。随着冷藏时间的延长,对照组冷害发病率上升的速度明显高于SA处理组杏果实。当贮藏结束时,0.01g/L SA处理组发病率仅为32.27%,对照组已高达44.63%,SA处理组比对照低27.69%(p<0.01)。可知,SA处理可减轻杏果实冷害发病率并推迟其冷害的发生。
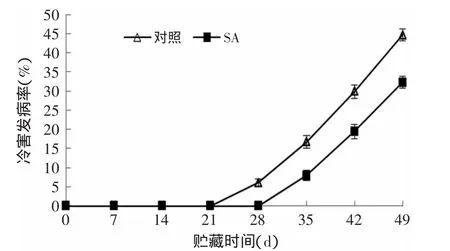
图1 SA处理对杏果实冷害发病率的影响Fig.1 Effects of SA treatment on chilling injury incidence of apricot fruits
2.2 SA处理对杏果实冷害指数的影响
由图2可知,SA处理可明显降低杏果实的冷害指数。对照组在贮藏第28d出现冷害症状,SA处理组杏果实在贮藏第35d开始出现冷害症状。随着贮藏时间的延长,对照杏果实的冷害指数上升的速度明显高于SA处理组。贮藏结束时,0.01g/L SA处理果冷害指数为0.33,对照果已高达0.48,SA处理组比对照组低31.2%(p<0.01)。说明SA处理能够增强杏果实的抗冷性,明显降低杏果实贮藏期间的冷害指数。
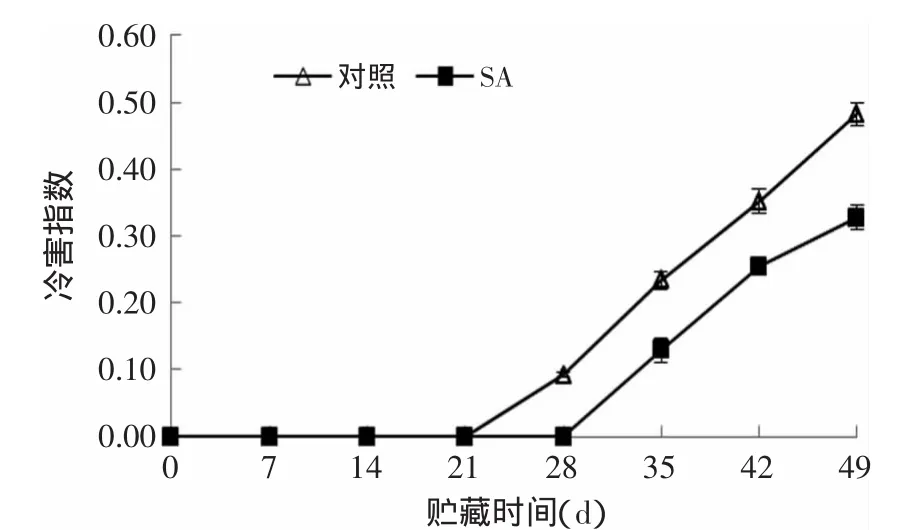
图2 SA处理对杏果实冷害指数的影响Fig.2 Effects of SA treatmenton chilling ingury index of opricot fruits
2.3 SA处理对杏果实冷藏期间硬度的影响
硬度是衡量杏果实贮藏品质的一个重要指标。由图3可知,在贮藏前期,杏果实的硬度呈逐渐下降趋势。在贮藏第28d,对照组硬度已下降到1.01kg/cm2,经0.01g/L SA处理组杏果实硬度仍保持在1.44kg/cm2,比对照组高42.57%(p<0.05)。对照组在贮藏第28d出现冷害症状后,果实硬度开始异常增大,SA处理组杏果实在贮藏35d时硬度也开始增大,而35d后SA处理组的硬度始终低于对照组。在贮藏第35d时,0.01g/L SA处理组和对照组杏果实硬度分别为1.11、1.24kg/cm2,SA处理组比对照组低10.48%(p<0.05)。杏果实硬度的异常增加可能是受到冷害的影响。说明采后0.01g/ L SA处理可有效抑制杏果实贮藏前期硬度的下降和后期硬度的上升。
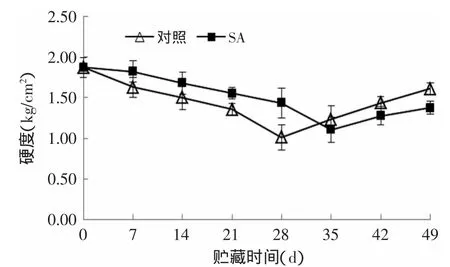
图3 SA处理对杏果实硬度的影响Fig.3 Effects of SA treatment on firmness of apricot fruits
2.4 SA处理对杏果实冷藏期间出汁率的影响
整个贮藏期内,SA处理组和对照组杏果实的出汁率随冷藏时间的延长有一个先上升后下降的变化过程,杏果实发生冷害后,出汁率会明显下降。由图4可知,对照组的出汁率在第28d开始下降,SA处理组杏果实在第35d才开始下降。SA处理不仅可以推迟杏果实出汁率下降的时间,而且在贮藏后期,可明显延缓出汁率的下降速度。在贮藏第49d,0.01g/L SA处理组和对照组杏果实出汁率分别为25.41%和21.14%,SA处理组比对照组高20.20%(p<0.05)。
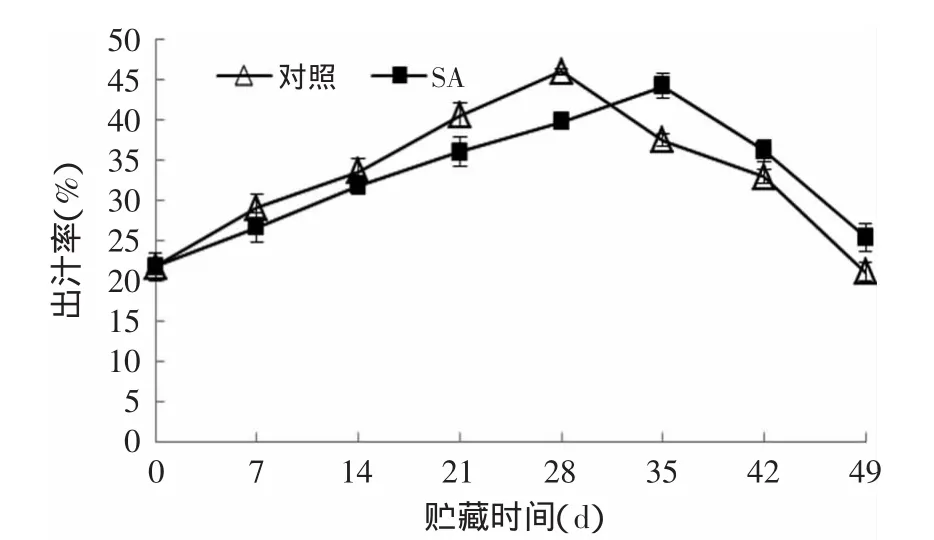
图4 SA处理对杏果实出汁率的影响Fig.4 Effects of SA treatmenton extractable juice rate of apricot fruits
2.5 SA处理对杏果实冷藏期间膜透性的影响
膜系统是植物遭受低温伤害的敏感部位,膜透性的升高是植物受到低温伤害的重要标志。由图5可知,随着贮藏时间的延长,SA处理组和对照组杏果实膜透性均持续增大,但SA处理组始终低于对照组杏果实。在贮藏第21d,0.01g/L SA处理组和对照组杏果实膜透性分别为27.72%和41.70%,SA处理组比对照组低33.5%(p<0.01)。在贮藏第49d,0.01g/L SA处理组和对照组杏果实膜透性分别为51.88%和63.37%,SA处理组比对照组低18.13%(p<0.05)。说明SA处理对可以抑制杏果实冷藏期间膜透性的增加。
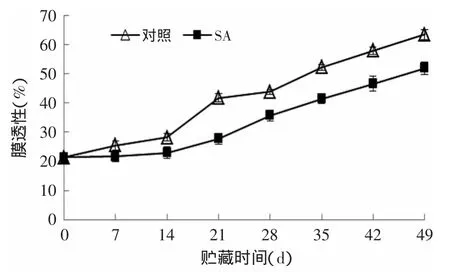
图5 SA处理对杏果实膜透性的影响Fig.5 Effects SA treatmentonmembrane permeability of apricot fruits
2.6 SA处理对杏果实冷藏期间丙二醛含量的影响
MDA是膜脂过氧化的产物,其累积量的多少反映膜脂过氧化程度的高低。由图6可知,杏果实MDA含量随着贮藏时间的增加呈不断上升的趋势,但0.01g/L SA处理组MDA含量始终低于同期对照组。贮藏结束时,0.01g/L SA处理组和对照组杏果实MDA含量分别为0.0041μmol/g FW和0.0052μmol/g FW,对照组比SA处理组MDA含量高20.94%(p<0.05)。说明,SA处理可以有效抑制贮藏过程中杏果实MDA含量的增加。
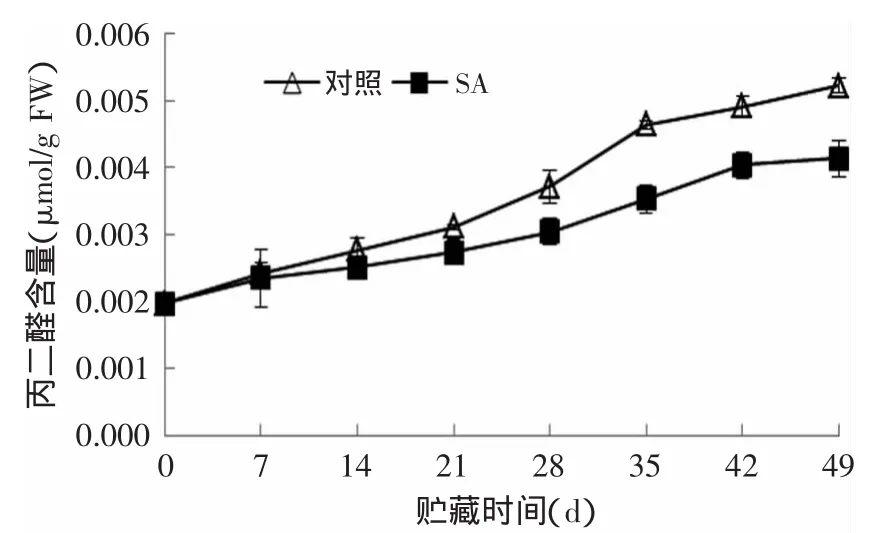
图6 SA处理对杏果实丙二醛含量的影响Fig.6 Effects of SA treatmenton MDA content of apricot fruits
3 结论与讨论
“膜脂相变冷害”假说认为,当降到一定的温度时,植物生物膜首先发生膜脂物相变化,如果持续置于冷害温度,可能使膜发生收缩,出现孔道或龟裂,因而膜的透性增大。膜内可溶性物质、电解质大量向膜外渗漏,破坏了细胞内外的离子平衡,使细胞代谢失调与紊乱,最终导致冷害发生[15]。冷害是冷敏性果实在低温贮藏过程中造成损失最严重的问题之一。因此,冷害现已成为冷敏性果实在贮运过程中亟待解决的问题。
在本研究中,在整个冷藏过程中,对照组杏果实在冷藏第28d出现冷害症状,SA处理组在第35d出现冷害果,SA处理组杏果实的冷害指数和冷害发病率显著低于对照组果实。说明SA处理能够有效增强杏果实的抗冷性,减轻冷害的发生。张红宇等[16]的研究也表明SA处理可有效控制水蜜桃冷害的发生。
本研究中,杏果实发生冷害后会表现出果实硬度异常增加,果肉出汁率下降的现象,与桃果实冷害症状表现相似[17]。0.01g/L SA处理可以有效延缓杏果实贮藏前期硬度的下降及后期硬度的上升并抑制杏果实出汁率下降。蔡琰等[18]的研究也表明,用SA处理可有效抑制桃果实出汁率的下降;江英等[19]和王军节等[20]的研究发现,SA处理可延缓梅杏及梨硬度的下降。出汁率减少可能与冷害果实贮藏后期硬度的异常变化有关[21]。
在冷害温度下,会引起膜结构损伤,降低细胞膜结构的流动性和稳定性,使膜透性增加,最终导致细胞代谢紊乱,使自由基大量累积,导致膜脂过氧化链式反应启动并加速进行,促使大量有害的膜脂过氧化产物MDA积累。杏果实冷害与MDA含量的变化密切相关,其含量可以反映果实遭受冷害伤害的程度。本研究结果表明,随着低温贮藏时间的延长,SA处理组和对照组杏果实膜透性和MDA含量均呈上升趋势,但SA处理可以显著抑制杏果实膜透性和MDA含量的增加,表明水杨酸处理可有效减轻杏果实的冷害伤害程度。本研究与赵颖颖等[22]用低温预贮对桃冷害控制,金鹏等[23]用MeJA与低温预贮对枇杷冷害控制的研究结果一致,张红宇等[16]和丁天等[24]的研究也表明SA处理可有效控制水蜜桃,豇豆的膜透性、MDA含量的上升。
综上,采后0.01g/L SA处理能够明显降低杏果实冷害发病率和冷害指数及细胞膜透性和MDA含量;有效保持杏果实的硬度、出汁率。从而提高杏果实在低温条件下贮藏的抗冷性。
[1]邢军,杨洁,郑力.新疆杏子分布及贮藏保鲜的可行性分析研究[J].新疆大学学报:自然科学版,2005(1):79-81.
[2]新疆维吾尔自治区统计局.新疆统计年鉴[M].北京:中国统计出版社,2011:335-336.
[3]MOHAMMADREZA A,MORTEZA S.Impact of salicylic acid on postharvest physiology of horticultural crops[J].Trends in Food Science and Technology,2010(21):502-509.
[4]张会.水杨酸在植物逆境生理中的作用[J].价值工程,2013(3):313-314.
[5]韩涛,李丽萍,冯双庆.外源水杨酸处理对采后番茄和黄瓜果实抗冷性的影响[J].中国农业科学,2002,35(5):571-575.
[6]AGHDAM SM,ASGHARIRM,MORADBEYGIH,etal.Effect of postharvest salicylic acid treatment on reducing chilling injury in tomato fruit[J].Romanian Biotechnological Letters,2012,17(4):7466-7473.
[7]CAO SF,HU ZC,ZHENG YH,etal.Synergistic effect of heat treatment and salicylic acid on alleviating internal browning in cold-stored peach fruit[J].Postharvest Biology and Technology,2010,58(2):93-97.
[8]WANG LJ,CHEN SJ,KONG WF,et al.Salicylic acid pretreatment alleviates chilling injury and affects the antioxidant system and heat shock proteins of peaches during cold storage[J].Postharvest Biology and Technology,2006,41(3):244-251.
[9]SAYYARIM,BABALAR M,KALANTARIS,et al.Effect of salicylic acid treatment on reducing chilling injury in stored pomegranates[J].Postharvest Biology and Technology,2009,53(3):152-154.
[10]池明,鲁周民.水杨酸处理对板栗冷藏品质及呼吸强度的影响[J].食品工业科技,2010,31(1):347-353.
[11]CAIC,LIX,CHENKS.Acetylsalicylic acid alleviates chilling injury of postharvest loquat(Eriobotrya japonica Lindl)fruit[J].European Food Research and Technology,2006,223(4):533-539.
[12]DONGL,ZHOUHW,SONEGO L,etal.Ethylene involvement in the cold storage disorderof‘Flavortop’nectarine[J].Postharvest Biology and Technology,2001,23(2):105-115.
[13]ROMANIRJ,HESSBM,LESLIECA.Salicylic acid inhibition of ethylene production by apple discs and other plant tissues[J].Journal of PlantGrowth Regulation,1989(8):63-69.
[14]Kang R Y,Yu ZF,Lu ZX.Effectof coating and intermittent warning on enzymes,soluble pectin substances and ascorbic acid of Prunus persica cv Zhonghuashoutao during refrigerated storage [J].Food Research International,2005,38(3):331-336.
[15]祝美云,党建磊,梁丽松,等.低温条件下不同品种桃果实的耐藏性差异研究[J].食品科学,2012,33(8):289-295.
[16]张红宇,尹京苑,万嗣宝.水杨酸和茉莉酸甲酯处理对水蜜桃低温贮藏冷害的影响[J].食品工业,2012,33(10):88-91.
[17]LURIES,CRISOSTO C F I.Chilling injury in peach and nectarine[J].Postharvest Biology and Technology,2005,37(3):195-208.
[18]蔡琰.低温预贮和水杨酸处理对桃果实冷害的影响及机理研究[D].南京:南京农业大学,2010.
[19]江英,刘琦,任雷厉,等.水杨酸贮藏品质对梅杏采后贮藏品质的影响[J].食品工业科技,2011,32(9):384-386.
[20]王军节,毕阳,范存婓,等.采后水杨酸处理对早酥梨果实色泽和质地的影响[J].现代食品科技,2010,26(10):1047-1051.
[21]高慧.油桃果实冷害及冷害生理机理研究[D].杨凌:西北农林科技大学,2007.
[22]赵颖颖,陈京京,金鹏,等.低温预贮对冷藏桃果实冷害及能量水平的影响[J].食品科学,2012,33(4):276-281.
[23]金鹏,吕慕雯,郑永华,等.MeJA与低温预贮对枇杷冷害和活性氧代谢的影响[J].园艺学报,2012,39(2):461-468.
[24]丁天,王清,杨娜,等.外源水杨酸处理对采后豇豆抗冷性的影响[J].湖北农业科学,2012,51(12):2505-2508.

