啤酒酵母自溶液中的物质变化及酵母自溶评价指标探索
许维娜 , 王金晶 , 陈 希 , 李 崎 *
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122)
啤酒酵母是啤酒酿造的灵魂,活性高的强壮酵母在适当条件下能够酿造出优质啤酒,酒体稳定性好,无杂异味,爽口且货架期长。如果使用衰老、活性低的酵母生产啤酒,酵母在发酵过程中容易自溶,并在自溶过程中释放出对啤酒质量有较大负面影响的物质,产生酵母味,加重苦味、涩味,使酒体泡持性及稳定性变差,严重影响啤酒质量[1-2]。Babayan和Bezrukov将自溶定义为细胞死亡,胞内生物聚合体在水解酶作用下形成低相对分子质量产物的一种水解反应,当细胞自身的胞内酶开始起作用时,自溶就开始了[3]。在正常条件下,酵母中的蛋白酶不会跟细胞内自身物质发生反应,不会发生细胞自溶;而当工艺条件和生存条件恶化时,酵母衰老受到各种物理化学作用的影响,蛋白酶开始降解胞内自身物质,导致酵母细胞壁破裂,酵母自溶随之开始[4]。自溶液中含有从细胞中释放出的多糖、氨基酸、蛋白质、核苷酸、少量盐类等物质[5]。ASBC报道,在酵母自溶过程中,游离脂肪酸辛酸和癸酸的含量与其自溶有关,但测定方法比较复杂[6];国外研究者通过实验指出,可通过测定培养液中的腺苷酸激酶(AK)含量判定酵母的自溶,因为AK是一种胞内酶,健康的细胞并不分泌或排泄该酶,但是该方法中所使用的仪器较难获得[7];Matteo Cavagna等人通过ATR-FTIR显微技术和PCA技术的结合,能够根据中红外显微红外光谱观察到起泡酒生产过程中酵母自溶的变化,但是该方法可操作性差[8];王敏等人研究发现,酵母自溶过程中△非α-氨基氮/△α-氨基氮值在2.24~7.91之间,比值越小自溶程度越高,可以通过该比值判断酵母自溶的程度[9]。作者综合了酵母自溶过程中释放的物质种类及自溶液状态变化情况,选取了α-氨基氮、甲醛氮、各种相对分子质量蛋白质、游离长链脂肪酸、酵母死亡率、以及溶液在260 nm与280 nm下分光光度值等指标对自溶液进行分析测定,探究操作性更强的酵母自溶评价方法。
1 材料与方法
1.1 材料与仪器
啤酒酵母青2(S.pastorianus)、啤酒酵母G-03(S.pastorianus)、啤酒酵母 C-03(S.pastorianus)、啤酒酵母 5-2(S.pastorianus):均为工业菌株,由作者所在实验室保藏;YEPD培养基:参照文献[10]配制;酵母提取物和胰蛋白胨:购于英国OXOID公司;十七酸为进口色谱纯标样:购于美国Sigma公司;其他试剂均为国产分析纯。
扫描电子显微镜QUANTA200F:美国FEI公司;紫外分光光度计UV-2000:美国Unico公司;凯式定氮仪Kjeltec 8200:瑞典Foss-Tecator公司;气相色谱仪GC-2010:日本岛津公司。
1.2 实验方法
1.2.1 酵母样品制备 参考王敏等[9]的方法培养和收集酵母,2 g酵母泥加到200 mL、pH 4.0的柠檬酸盐缓冲液(模拟自溶液)中,于28℃放置,定时取样测定。
1.2.2 酵母细胞扫描电镜镜检 取自溶较快的菌株青2进行扫描电镜镜检。分别取在YEPD培养基中培养20 h和在模拟自溶液中7 d的酵母,1 500 r/min离心10 min,收集菌体,进行扫描电镜制样、镜检。
1.2.3 酵母细胞死亡率的测定 定时对自溶液取样,适当稀释后与等量0.1%美蓝染色液混匀,染色5 min后加到血球计数板上镜检,蓝色为死细胞,无色为活细胞,记录细胞总数和死细胞数。
酵母死亡率=死细胞数/细胞总数×100%
1.2.4 α-氨基氮的测定 参照文献[11]进行,计算公式为:
游离 α-氨基氮(mg/L)=2×10×(A样品/A甘氨酸)
1.2.5 甲醛氮的测定 参照文献[11]进行,计算公式为:
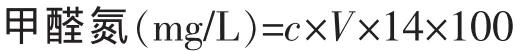
其中,c为氢氧化钠标准溶液质量浓度,V为氢氧化钠溶液用量(mL),14为每毫克当量氮的毫克数。
1.2.6 隆丁区分法测定蛋白质含量 参照文献[12]进行,各分子氮含量计算方法:

1.2.7 液液萃取—气相色谱法测定游离长链脂肪酸含量 取75 mL滤液,加入十七酸标样0.5 mL和氯化钠10 g,用盐酸调pH到3.5左右。加入20 mL 萃取剂(二氯甲烷∶甲醇=3∶1)充分振荡萃取,分层后收集有机相,上层加入10 mL萃取剂再连续萃取两次,合并后于5 000 r/min离心10 min,收集有机相于三角瓶中,加入无水硫酸钠,封口膜封口,放入-18℃冷冻过夜。
将有机相旋转蒸发至干,用萃取剂润壁至3~5 mL左右,放入氨基小柱,用3 mL正己烷冲氨基小柱,然后用移液管向柱内加萃取液,加样量在3 mL左右,自然排干,用2 mL二氯甲烷∶异丙醇=1∶1混合溶液冲洗两次,洗掉中性甘油酯,排干。移取2.5 mL 2%醋酸-甲基叔丁基醚,废弃洗脱液。小柱下端接样品瓶,再次加入2.5mL 2%醋酸-甲基叔丁基醚,收集洗脱液,充分混匀。滤液放于具塞比色管中。60℃水浴挥发至1 mL左右,冷却,加入3 mL甲醇,3滴浓硫酸,混匀后60℃水浴中酯化30 min,冷却后加入1 mL饱和氯化钠和3 mL正己烷进行萃取,分层后取有机相于进样瓶中进行气相检测[13-15]。
1.2.8 A260和A280的测定与比值计算 取一定量的缓冲液过滤,分别测滤液在260 nm和280 nm处的分光光度值,计算A260/A280比值。DNA纯品的A260/A28为1.8,若比值高则说明含有RNA,比值低说明有残余蛋白质的存在[17]。
2 结果与分析
2.1 酵母扫描电镜结果
典型啤酒酵母青2在正常培养和自溶状态下的扫描电镜镜检结果分别见图1和图2。正常培养下的啤酒酵母呈椭圆球形,表面饱满圆润,有明显的出芽现象和芽痕,而放置在模拟自溶液中经过7 d之后的酵母细胞在8 000×的放大倍数下表面无明显破损,但胞内物质流失严重,细胞干瘪失形。这说明自溶过程中细胞壁的破坏是局部的、小规模的,而非大面积破裂。

图1 青2在YEPD中培养20 h的扫描电镜Fig.1 SEM of the strain QING 2 cultured in YEPD for 20 h

图2 青2在模拟自溶液中7 d的扫描电镜Fig.2 SEM of the strain QING 2 placed in citrate buffer for 7 d
2.2 酵母细胞死亡率的测定
酵母细胞在模拟自溶液中死亡率见表1。菌株5-2的死亡速率明显比其他三株菌慢。
2.3 Δ非α-氨基氮/Δα-氨基氮与自溶时间的关系曲线的构建
2.3.1 α-氨基氮的测定 对4株菌的模拟自溶液进行α-氨基氮的测定,结果见图3。4株菌自溶液中的α-氨基氮质量浓度在0~36 h内增加缓慢,36 h之后增加速度明显变快。其中菌株5-2的α-氨基氮质量浓度明显低于其他三株菌。

表1 不同酵母菌株在模拟自溶液中的死亡速度Table 1 Mortality rate of different strains in citrate buffer
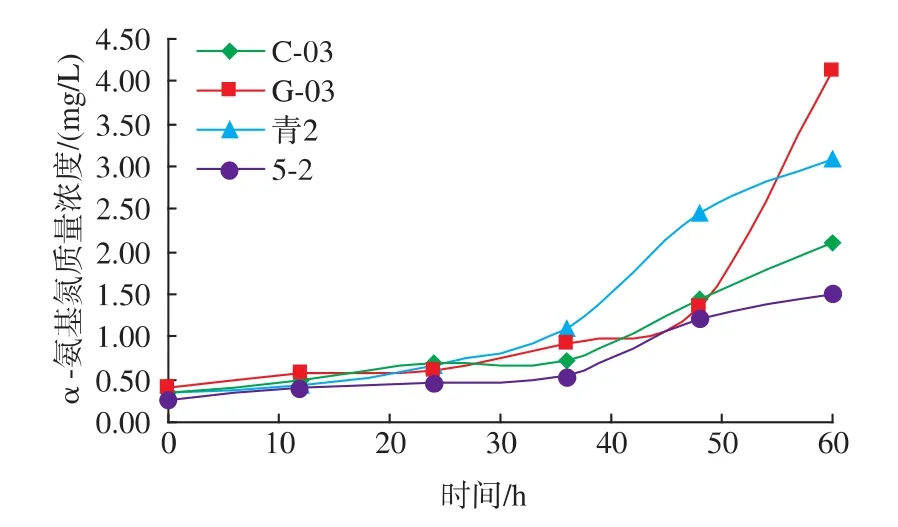
图3 不同菌株模拟自溶液中α-氨基氮质量浓度变化Fig.3 Change of α-amino nitrogen of different strains in citrate buffer
2.3.2 甲醛氮的测定 对4株菌的模拟自溶液进行甲醛氮的测定,结果见图4。0 h即刚放入时,模拟自溶液中的5-2、C-03和青2三株菌甲醛氮质量浓度相差不大,而G-03的甲醛氮质量浓度比其他三个菌株都高;四株菌甲醛氮质量浓度均缓慢增加,其中以5-2增长速度最慢,总量最少。

图4 不同菌株模拟自溶液中甲醛氮随时间的变化Fig.4 Change of formaldehyde nitrogen of different strains in citrate buffer
2.3.3 酵母自溶过程中△非α-氨基氮/△α-氨基氮的变化规律 对测得的α-氨基氮、甲醛氮的含量进行分析处理,得到△非α-氨基氮/△α-氨基氮变化见图5。结果表明,△非α-氨基氮/△α-氨基氮显示出无规律变化的趋势,无法获得文献[9]中所述的酵母自溶的判定指标,造成该结果的主要原因是:该实验方法灵敏度较低,且步骤繁琐,可重复性不强。
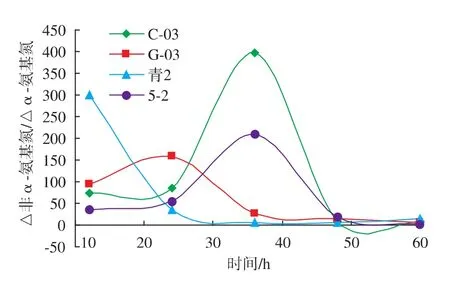
图5 不同菌株模拟自溶液中Δ非α-氨基氮/Δα-氨基氮随时间的变化Fig.5 Change of Δ non-α -amino nitrogen/Δα -amino nitrogen of different strains in citrate buffer
2.4 酵母自溶对不同相对分子质量蛋白质质量浓度的影响
用隆丁区分法对4株酵母菌株的模拟自溶液进行跟踪测定,对模拟自溶液中大、中、小分子蛋白质质量浓度的变化以及各相对分子质量蛋白质在总蛋白中所占的比例进行了分析,结果见表2。其中菌株5-2的自溶液中蛋白质质量浓度过低,无法用该法检出。正常情况下,胞内物质进入外界环境需要经过细胞膜和细胞壁的过滤(其中主要是细胞膜的作用),所以胞内的大分子物质无法释放到胞外。从表2可以看出,随着自溶时间的延长,3株菌株模拟自溶液中大、中、小分子蛋白质质量浓度都在逐渐增多,且大、中分子蛋白质在总蛋白质的比例中呈现逐渐上升趋势,而小分子蛋白质占总蛋白质质量浓度的比例则出现逐渐下降趋势。如青2中高、中分子蛋白质所占比例分别从2.81%、8.79%逐渐增加至7.22%、18.89%,而小分子蛋白质从88.40%逐渐减少至73.89%。可见,在酵母细胞自溶过程中,随着细胞膜与细胞壁上孔洞的增大,越来越多的大分子胞内物质释放到环境中,使得外界环境中的大、中、小相对分子质量蛋白质的比例发生改变。隆丁区分可以在一定程度上检测酵母自溶过程中蛋白质类物质的变化,但操作繁琐,检测限高,不适用于判断酵母的自溶情况。
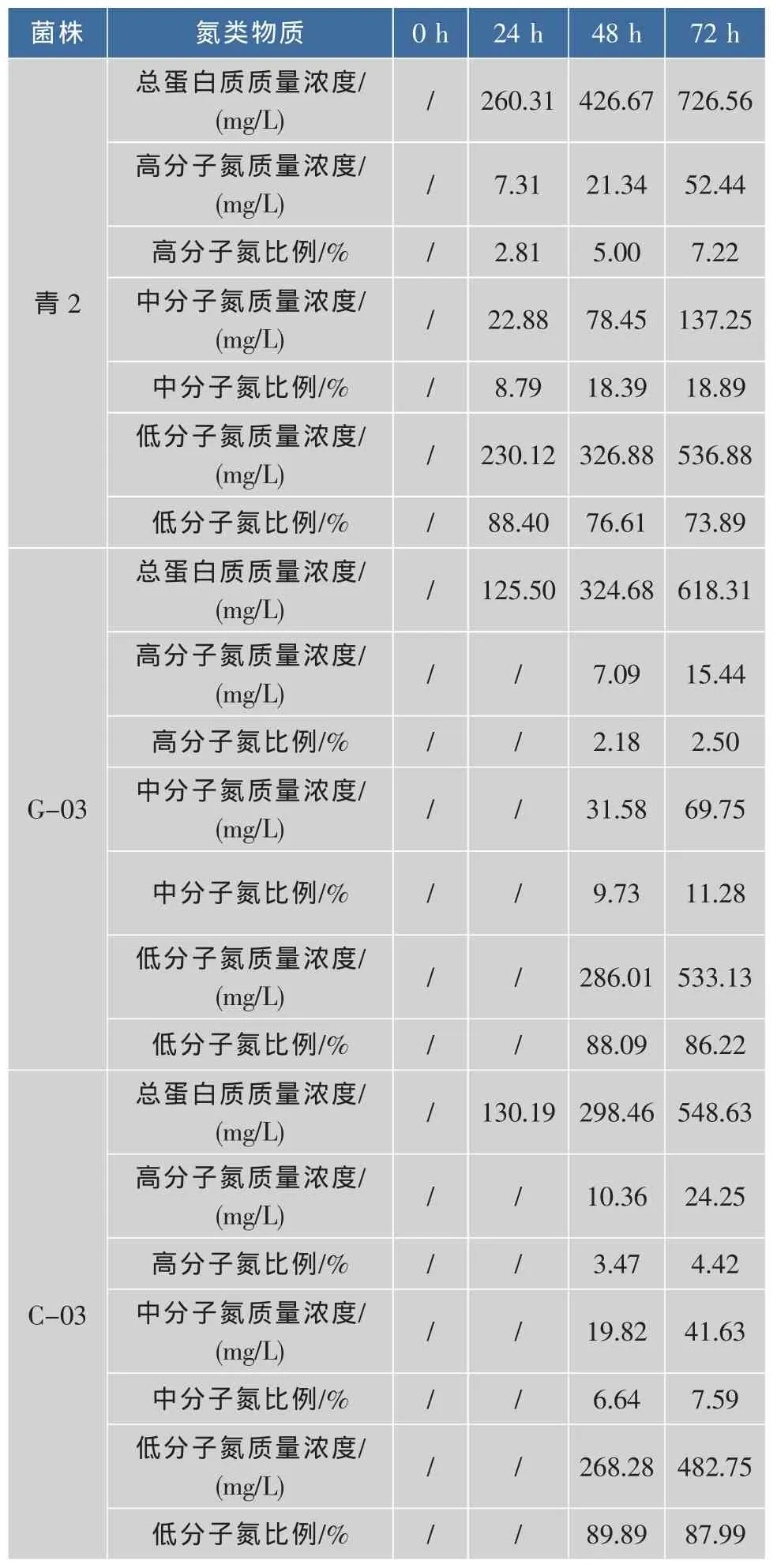
表2 不同菌株模拟自溶液中各种蛋白质质量浓度及比例变化Table 2 Change of content and proportion of proteins in citrate buffer
2.5 液液萃取-气相色谱法测定游离长链脂肪酸质量分数
啤酒中含量极低、极不稳定的游离脂肪酸是影响啤酒风味重要因素之一。作者采用溶剂萃取和气相色谱联用技术对青2和C-03进行14个碳原子以上的长链游离脂肪酸质量分数的检测,检测结果见表3。两株酵母缓冲液中各游离脂肪酸以及所有游离脂肪酸的总和在0~5 d的时间内变化均不明显,且这些微小变化并不呈现确定的规律,可见,长链脂肪酸质量分数无法作为判定酵母自溶的指标。
2.6 紫外吸收法测定核酸物质的含量及纯度
对模拟自溶液进行过滤之后测A260和A280的值,并计算其比值,结果见表4。A260/A280的比值与DNA纯度有关,纯DNA其比值为1.8,高于此值说明有RNA存在,低于此值有蛋白质存在,该部分的计算结果均高于1.8,同时之前的实验证明自溶液中蛋白质的存在,因此说明了自溶液中RNA也存在。自溶开始时,酵母释放出的蛋白类物质比例较大,A260/A280的值较小;随着自溶程度的增大,自溶液中的核酸类物质所占的比例越来越大,A260/A280的值逐渐增大,向2.0靠近。
酵母的自溶程度与酵母的死亡率有一定关系,但酵母死亡并不等同于自溶。该实验中,对A260/A280与酵母死亡率进行拟合与分析,发现(A260/A280)/死亡率随自溶程度的不同而呈现明显且一致的变化趋势,见图 6。(A260/A280)/死亡率起始值较大(理论上 0 h时细胞死亡率为0,该值为+∞),之后逐渐减小,且酵母菌株自溶程度越高,该比值越小。当细胞死亡率趋近于 100%时,A260/A280逐渐趋近于 2.0,(A260/A280)/死亡率的值也趋近于2。虽然具体数据因菌种不同存在个体差异,但趋势是完全相同的。该方法还可用于比较不同菌株的自溶性能,从结果可以看出,实验所用4株菌自溶性能最好的是5-2,其次为C-03和G-03,青2最差,这与实际情况相符合。因此,该方法能够较准确反映酵母自溶情况,因而能够作为酵母自溶的判定指标。
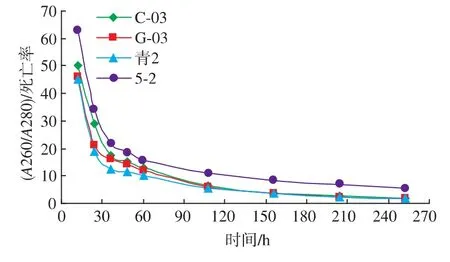
图6 不同菌株模拟自溶液中(A260/A280)/死亡率随时间的变化Fig.6 Change of (A260/A280)/yeast mortality of different strains in citratce buffer

表3 青2、C-03模拟自溶液中游离脂肪酸随时间的变化Table 3 Change of free long-chain fatty acid of QING 2 and C-03 in citrate buffer
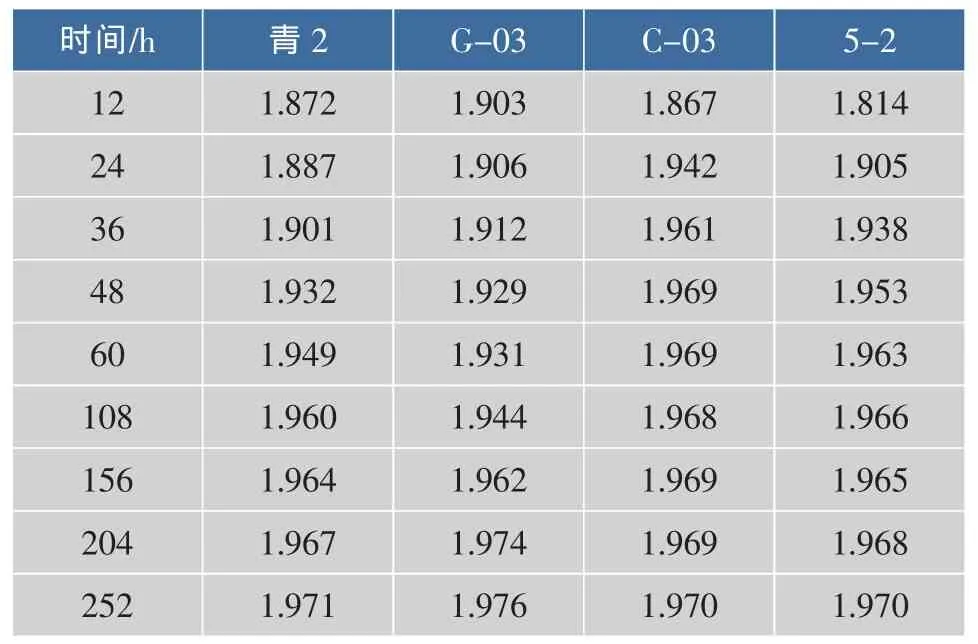
表4 不同菌株模拟自溶液中A260/A260值随时间的变化Table 4 Change of A260/A260of different strains in citrate buffer
3 结语
在啤酒酿造中,影响啤酒质量的因素有很多,如:生产原料、水质、啤酒酵母、酒花、环境温度等,其中酵母菌种是影响啤酒质量最主要的因素,如果有5%的酵母发生自溶,将对啤酒质量造成难以挽回的影响[2,18]。为了提高啤酒质量,国内外学者对酵母自溶进行了诸多研究,国内学者的研究多从实际生产出发,方法简单快捷,但通常不是十分有效[5,19];国外学者采用的方法因设备或技术限制,在国内推广的空间不大[6-8]。因此需要探索简单、快捷、灵敏的方法用于检测啤酒酵母的自溶情况。
作者选取了多个指标进行自溶评价的探索。因为酵母在发酵液中的自溶是一个缓慢而漫长的过程,并且发酵液中的很多物质对测定结果有干扰[20],所以本研究中的酵母自溶在人为创造的、营养匮乏的柠檬酸盐缓冲液中进行。研究发现,随着酵母自溶程度的增大,α-氨基氮、甲醛氮,溶液中大、中、小蛋白质分子含量都有所增加,其中,大、中分子蛋白质在总蛋白质中的比例呈现逐渐增大趋势,而小分子蛋白质虽然含量增多,但所占比例呈现逐渐减小趋势;而气相色谱法测定游离脂肪酸的结果则表明,长链脂肪酸在酵母自溶过程中变化不明显,且变化趋势无规律可循。虽然上述部分实验结果呈现一定的变化趋势,但是个体差异明显,且单一物质的变化不适合用于判定酵母自溶情况,所以无法将这几个因素直接作为判定酵母自溶情况的指标。A260/A280常用来反映核酸类物质的纯度,是一个综合反映蛋白质与核酸类物质含量关系的物理量。而且酵母死亡率与自溶程度密切相关。本研究对A260/A280与酵母死亡率进行拟合,发现(A260/A280)/死亡率随自溶程度的不同而呈现规律且一致的变化趋势,即酵母菌株自溶程度越高,该比值越小。将实际自溶产物的 (A260/A280)/死亡率值与现有数据相比较,就可以得出酵母自溶的情况。该方法不仅可以用于判定同株酵母的自溶程度,还可用于比较不同菌株的自溶性能。因此,(A260/A280)/死亡率这一指标可用于选育自溶性能良好的啤酒酵母菌种用于工业生产,有助于预防酵母自溶给酒液带来不良影响,并可以通过该标准对发酵后酵母泥中的酵母进行活性判定,以便于回收活性高的酵母用于下一批发酵。
[1]王敏,李崎,顾国贤.啤酒酵母自溶与细胞壁关系[J].生命的化学,2008,28(4):504-506.WANG Min,LI Qi,GU Guo-xian.Relationship between autolysis of Saccharomyces cerevisiae and cell wall[J].Chemistry of Life,2008,28(4):504-506.(in Chinese)
[2]高建民.浅析啤酒酵母自溶[J].啤酒科技,2009,2:56-57.GAO Jian-min.Analysis of yeast autolysis[J].Beer Science and Technology,2009,2:56-57.(in Chinese)
[3]Babayan,Bezrukov.Autolysis in yeast[J].Acta Biotechnol,1985,5:129-136.
[4]牛建兴,王嘉林.啤酒酵母自溶的危害及其影响因素[J].酿酒科技,2011,12:73-75,78.NIU Jian-xin,WANG Jia-lin.The hazards and influencing factors of beer barm autolysis[J].Liquor-Making Science &Technology,2011,12:73-75,78.(in Chinese)
[5]华玉苍,曲辉,张波,等.试论酵母自溶的判定指标[J].啤酒科技,2002,6:7-8.HUA Yu-cang,QU Hui,ZHANG Bo,et al.Discussion on the evaluation indexes of yeast autolysis[J].Beer Science and Technology,2002,6:7-8.(in Chinese)
[6]Ernest C H,Jamieson A M,Gheluwe G V.The release of fatty acids as a consequence of yeast autolysis[J].ASBC,1980,38(1):13.
[7]刘素萍.通过测定胞外腺苷酸活性确定酵母自溶[J].啤酒科技,2003,11:53-55.LIU Su-ping.Determination of yeast autolysis through the determination of extracellular AK activity[J].Beer Science and Technology,2003,11:53-55.(in Chinese)
[8]Cavagna M,Dell'Anna R,Monti F,et al.Use of ATR-FTIR microspectroscopy to monitor autolysis of Saccharomyces cerevisiae cells in a base wine[J].J Agr Food Chem,2010,58:39-45.
[9]王敏,郑飞云,刘春凤,等.啤酒酵母自溶分析评价指标的研究[J].食品工业科技,2009,10:73-75,79.WANG Min,ZHENG Fei-yun,LIU Chun-feng,et al.Research on evaluation index of autolytic ability in brewing yeast[J].Science and Technology of Food Industry,2009,10:73-75,79.(in Chinese)
[10]Burke D,Dawson D,Stearns T.Methods in yeast genetics:A cold spring harbor laboratory course manual[M].New York:Cold Spring Harbor Laboratory Press,2000.
[11]管敦仪.啤酒工业手册[M].北京:中国轻工业出版社,1982.
[12]范大雨.浅谈蛋白质隆丁区分[J].啤酒科技,2002,2:41-42.FAN Da-yu.Lundin fraction of proteins[J].Beer Science and Technology,2002,2:41-42.(in Chinese)
[13]刘春凤,李崎,顾国贤,等.多级溶剂萃取-气相色谱法测定啤酒中的游离脂肪酸[J].分析实验室,2008,27(2):26-29.LIU Chun-feng,LI Qi,GU Guo-xian,et al.Determination of free fatty acids in beer by multilevel solvent extraction-gas chromatography[J].Chinese Journal of Analysis Laboratory,2008,27(2):26-29.(in Chinese)
[14]Urbanek A,Szadziewski R,Stepnowski P,et al.Composition and antimicrobial activity of fatty acids detected in the hygroscopic secretion collected from the secretory setae of larvae of the biting midge Forcipomyia nigra (Diptera:Ceratopogonidae)[J].J Insect Physiol,2012,58:1265-1276.
[15]刘景.啤酒风味老化机理及控制的研究[D].无锡:江南大学,2008.
[16]WU J N,Huu D,Manuel A C.Investigation of gaseous ozone as an anti-fungal fumigant for stored wheat[J].Chem Technol Biotechnol,2006,81:1288-1293.
[17]金丽琴.生物化学[M].杭州:浙江大学出版社,2007.
[18]孙付保,任洪艳,赵长新.离子对啤酒酵母代谢产酸的影响[J].食品与生物技术学报,2006,25(3):63-66.SUN Fu-bao,REN Hong-yan,ZHAO Chang-xin.Ion influence on organic acid metabolized by beer yeast[J].Journal of Food Science and Biotechnology,2006,25(3):63-66.(in Chinese)
[19]王志坚.啤酒酵母自溶指标的判定[J].山东食品发酵,2011,4:27-29.WANG Zhi-jian.Determination of beer yeasts’ autolysis index[J].Shandong Food Fermentation,2011,4:27-29.(in Chinese)
[20]Martínez-Rodríguez A J,Polo M C,Carrascosa A V.Structural and ultrastructural changes in yeast cells during autolysis in a model wine system and in sparkling wines[J].Int J Food Micro,2001,71:45-51.

