不同类型表面活性剂的生物降解
卡哈尔
(新疆农业职业技术学院 新疆昌吉831100)
表面活性剂是一类重要的化工产品,分别具有润湿、分散、乳化、增溶、起泡、消泡、洗涤、润滑、防腐和杀菌等作用[1],在工业、农业、医药、日用化工等众多领域的应用越来越广。据统计,全球表面活性剂的用量由1999年的930万吨,增加到2005年的1250万吨[2]。表面活性剂大量使用的同时也造成了对土壤、水质的严重污染,甚至给人体带来危害,如皮肤过敏、癌症、生物雌性化等[3];另一方面,表面活性剂的污染已经成为城市污水处理的一个难题。因此,必须了解环境对这类物质的接受能力,即所谓的环境安全性。表面活性剂的生物降解是其生命周期分析(LCA)的重要内容之一,迄今为止,表面活性剂的发展历史上出现了两次转变,第一次是在全球范围内兴起从支链烷基苯磺酸盐(ABS)到直链烷基苯磺酸盐(LAS)的转变;第二次是刚刚在欧洲兴起的用酯季铵盐(EQ)取代双长链的季铵盐(DTMAC)。这两次转变均是由生物降解性产生的[4]。
为了解决日益严重的环境问题,绿色化学已成为当前化学学科研究的热点和前沿。表面活性剂的绿色化学是绿色化学的重要内容之一,目前主要体现在3个方面[5]:①揭示表面活性剂结构与性能的关系(特别是与生物降解等环境相容性的关系);②降低产品中有害物质的含量;③表面活性剂的绿色应用。表面活性剂与环境的相容性则是表面活性剂绿色化学的重点。
近年来,虽然有人对表面活性剂的降解研究进展进行了评述,但对表面活性剂的结构类型与生物降解的关系却谈得很少。本文将重点介绍不同种类表面活性剂的生物降解性,并对我国今后表面活性剂生物降解研究的方向进行讨论。
1 表面活性剂的生物降解过程与机理
1.1 表面活性剂的生物降解过程
表面活性剂的降解是指在环境因素作用下,表面活性剂的组成与结构发生变化,从对环境有害的表面活性剂分子逐步转化成对环境无害的小分子(如CO2、NH3、H2O等)的过程。
生物降解过程实质上是一个氧化过程,该过程主要是把无生命的有机物变成比较简单的组分。因此,表面活性剂的生物降解主要是研究表面活性剂由细菌活动所导致的氧化过程。完整的降解一般分为3步:①初级降解:表面活性剂的母体结构消失,特性发生变化;②次级降解:降解得到的产物不再导致环境污染,也叫做表面活性剂的环境可接受的生物降解;③最终降解:底物(表面活性剂)完全转化为CO2、NH3、H2O等无机物。
1.2 表面活性剂生物降解机理
表面活性剂的生物降解过程通常可通过3种氧化方式实现:①ω氧化;②β氧化;③芳环氧化[6]。
1.2.1 ω氧化
ω氧化是发生在碳链末端的氧化。在ω氧化中,表面活性剂末端的甲基在生物质参与下被分子氧进攻,使链的一端氧化成相应的脂肪醇和脂肪酸。该反应通常是初始氧化阶段,是亲油基团降解的第一步(图1)。
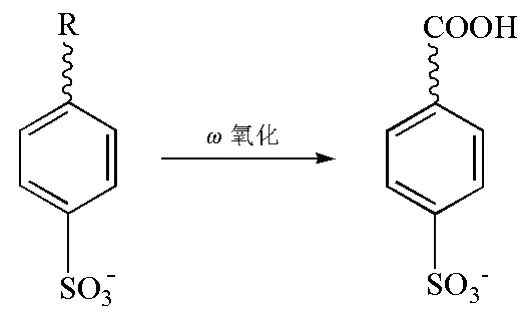
图1 ω氧化直链烷基苯磺酸盐(LAS)
1.2.2 β氧化
高碳链端形成羧基时,碳链的初始氧化即已经完成,继续进行的降解则是一个β氧化过程。该反应是由酶催化的一系列反应,起催化作用的酶叫做辅酶A(图2)。
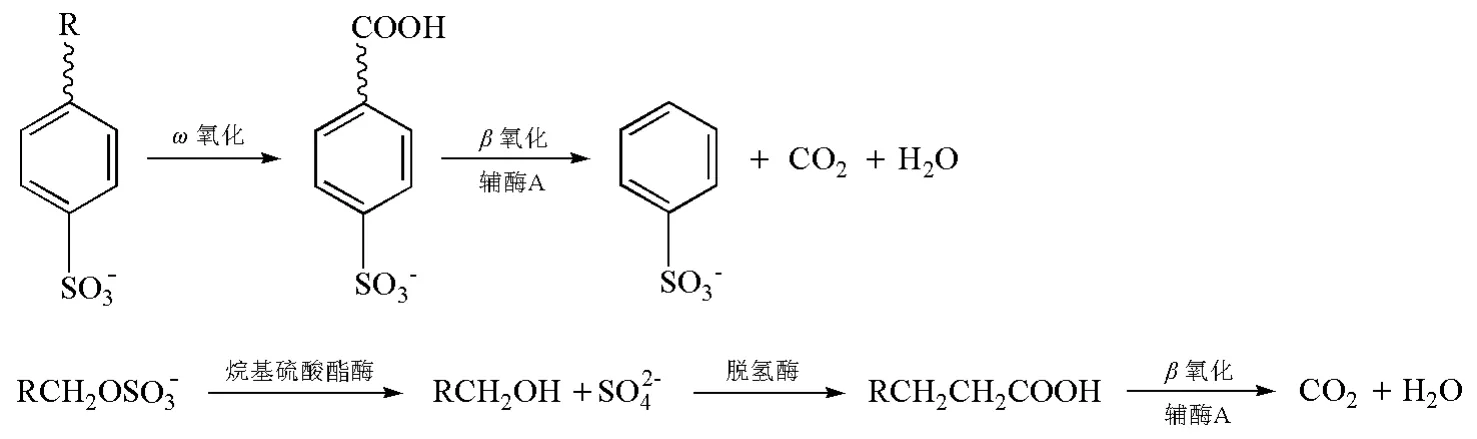
图2 β氧化烷基硫酸盐(AS)
1.2.3 芳环氧化
苯或苯的衍生物在酶催化下与氧分子作用时,往往有一个共同的中间产物,即双酚化合物。如苯由加氧酶氧化为儿茶酚,儿茶酚在加双氧酶的作用下再氧化,在邻位或间位开环(往往在邻酚位开环)。邻位开环生成己二烯二酸,再氧化为β酮己二酸,后者再氧化为三羧酸循环的中间产物琥珀酸和乙酰辅酶A;间位开环生成2-羟己二烯半醛酸,进一步代谢生成甲酸、乙醛和丙酮酸。示意图见图3。
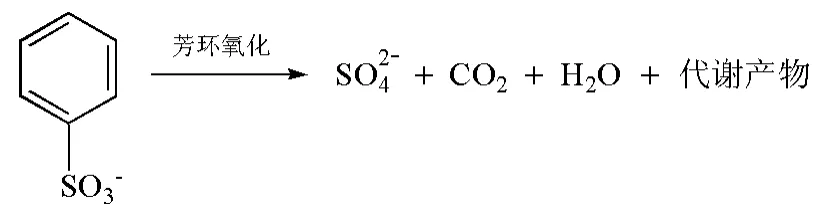
图3 芳环氧化苯磺酸盐示意图
2 不同类型表面活性剂的生物降解性
表面活性剂的生物降解性主要由疏水基团决定,但不同类型表面活性剂的生物降解能力与路径不同。
2.1 阴离子表面活性剂的生物降解性
阴离子表面活性剂在水溶液中离解时生成的表面活性离子带负电荷。阴离子表面活性剂通常可按照其亲水基分为羧酸盐型、磺酸盐型、硫酸(酯)盐型和磷酸(酯)盐型等。在阴离子表面活性剂中,使用量最大的是直链烷基苯磺酸盐(LAS)、烷基硫酸盐(AS)、直链烷基醇聚氧乙烯醚硫酸钠(AES)、α-烯基磺酸盐(AOS)等,因此,有关它们生物降解的研究也相应地多一些[7]。
在阴离子表面活性剂中,LAS能够很容易被降解,并且其降解产物比母体分子的毒性小,一般在3~5天内,LAS的初级生物降解率能够达到90%以上甚至100%,最终降解率可在21天达到80%以上。排放到环境中的LAS,先是有50%左右在下水道系统中降解;剩余LAS中的90%~95%能在污水处理厂中被降解;而其余的又能在污泥和土壤中被降解[8]。所以,LAS不会对环境造成影响[9]。
从表1可知:①对于烷基碳原子数相等但苯环对端基碳位置有变化的LAS来说,随着苯环位置离末端碳原子越远,生物降解性越低。这是由于末端碳原子与苯环位置的距离越远,结构对称性就越高,从而更加稳定,形成类似有双尾疏水基的构型。因而分子中电子总能量降低,分子的稳定性增大,也就越不易被氧化。②对于烷基碳原子数改变但苯环对端基碳原子位置不变的LAS来说,随着碳链长度增加,其生物降解性仍然增大,这是由于烷基链的增长实际上增大了苯环与中心碳原子的距离,因而降解度也增大。
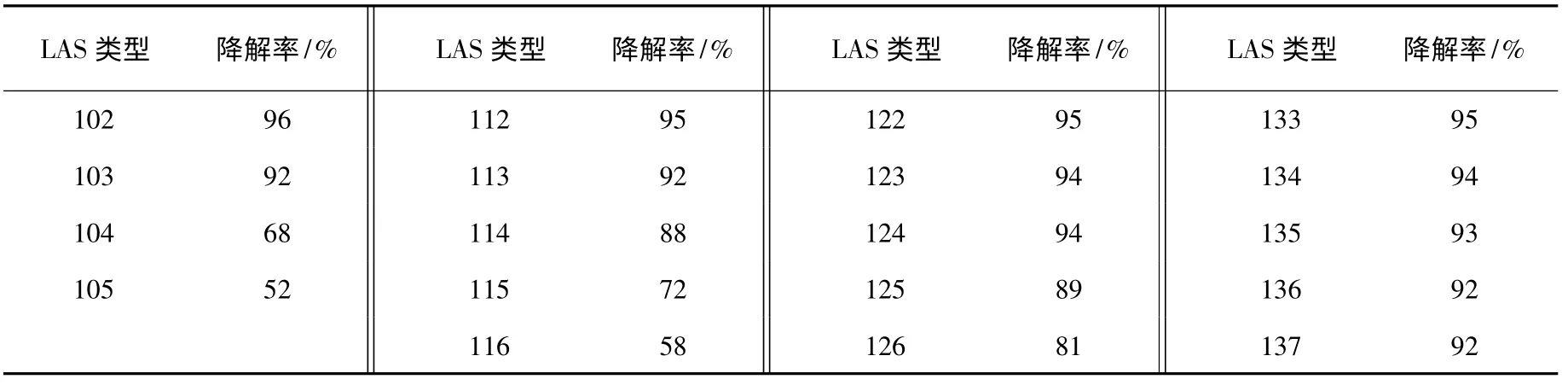
表1 不同结构的直链LAS的生物降解率
直链的伯烷基硫酸盐(LPAS,ROSO3M)是具有最快初级降解速度的表面活性剂,通常用摇瓶实验或河水消失实验测定,不到一天就可完全降解(降解率达90%以上)。直链仲烷基硫酸盐尽管降解速度比LPAS稍慢,但也是很容易降解的[8]。因为支链烷基或支链取代基的氧化比直链烷基较难,所以,烷基链的支化度越高,越难降解。
直链的烷基磺酸盐(无论是伯烷基磺酸盐还是仲烷基磺酸盐)都很容易生物降解,但一般比LPAS慢一些,而比LAS要快。烯基磺酸盐()的降解性能与其类似[10]。
从分子结构来看,在直链的伯烷基硫酸盐(LPAS)中有一个弱的醚键,它在水中易从疏水基团处断裂,生成相应的脂肪醇和硫酸根离子,然后通过β氧化过程慢慢地降解为CO2和H2O,所以LPAS比AS及LAS降解快;而对于LAS和AS,在R相同时,由于LAS上多一个苯基需要被氧化,所以LAS的降解速度比AS小。
脂肪醇聚氧乙烯醚硫酸盐(AES)和烷基硫酸盐(AS)具有相似的生物降解性,但AES比AS要稍难降解一些。当烷链为直链时,这种差别不容易被发现;但如果烷链为支链,这种差别就比较明显。例如四聚丙烯羰基合成醇的硫酸盐在3~4天降解68%,前期乙氧基化的硫酸盐为40%[10]。从分子结构来看,R相同时,AES比AS多n个乙氧烯基需要氧化,所以AS的降解速度比AES大。
对于烷基酚聚氧乙烯醚硫酸盐(APES)的衍生物,由于其疏水基结构的不同而有很大的差别。通常APES与LAS有相似的生物降解性。Steber等[11]用14C标记法研究了α-脂肪酸甲酯磺酸盐(MES)的生物降解性。在消失试验中,当初始质量浓度为0.1mg/L时,28天后,MES最终降解率为62%~67%,6个星期之后为72%~83%;当初始质量浓度为1mg/L和5mg/L时,28天的降解率分别达到62%和55%;然后有2~6天的滞后期,起始质量浓度为1mg/L的在4个星期后能达到70%,而起始质量浓度为5mg/L的在6个星期后为60%[10]。所以,浓度也影响表面活性剂的生物降解性。
总之,阴离子表面活性剂生物降解与结构的关系有如下规律[12]:①表面活性剂的生物降解性主要由疏水基团决定,并随着疏水基线性程度增加而增加,末端季碳原子会显著降低降解度;②表面活性剂的亲水基性质对生物降解性有次要的影响,例如直链伯烷基硫酸盐(LPAS)的初级生物降解速度远高于其他阴离子,短EO链的聚氧乙烯型非离子表面活性剂易于降解;③增加磺酸基和疏水基末端之间的距离,可使烷基苯磺酸盐的初级生物降解率增加(距离原则)。
2.2 非离子表面活性剂的生物降解性
非离子表面活性剂是一种在水中不离解成离子状态的两亲结构化合物。其亲水基主要是由聚乙二醇基即聚氧乙烯基(CH2CH2O)构成,分为聚氧乙烯型、多元醇型、氨基醇型,其中应用最广泛的是聚氧乙烯型。
非离子表面活性剂的生物降解性与烷基链长度,有无直链及EO、PO的单元数等有关。一般支链比直链的难降解,分子中存在酚基的比烷基的难降解[7,11]。
由图4可以看出,直链比支链及有酚环的壬基酚聚氧乙烯醚(NPE)的降解能力要高得多。在相同时间内(30天),直链结构的降解率达88%,而支链和NPE的降解率分别为44%和31%。由表2可以看出:疏水基为烷基时,不仅支链化程度影响整个分子降解,EO单元数也有重要影响。即同一系列的非离子表面活性剂的烷基链相同时,随着所连的氧乙烯基增加,降解率降低。总体上,一般支链比直链难氧化,所以降解率比直链低。同一系列的非离子表面活性剂的烷基链相同时,随着所连的氧乙烯基增加,降解率降低,这是因为随着氧乙烯基增加需要氧化的时间更长。
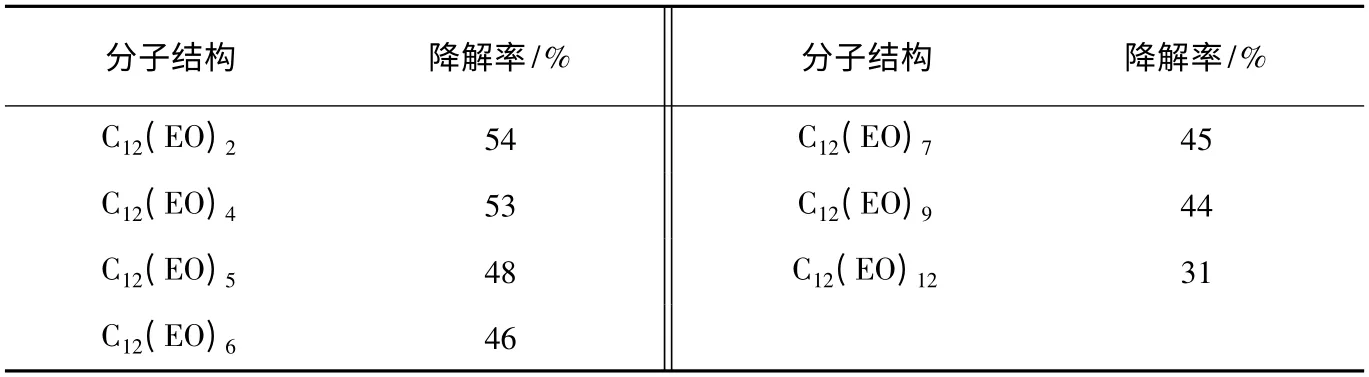
表2 十二烷基聚氧乙烯醚化合物的生物降解率
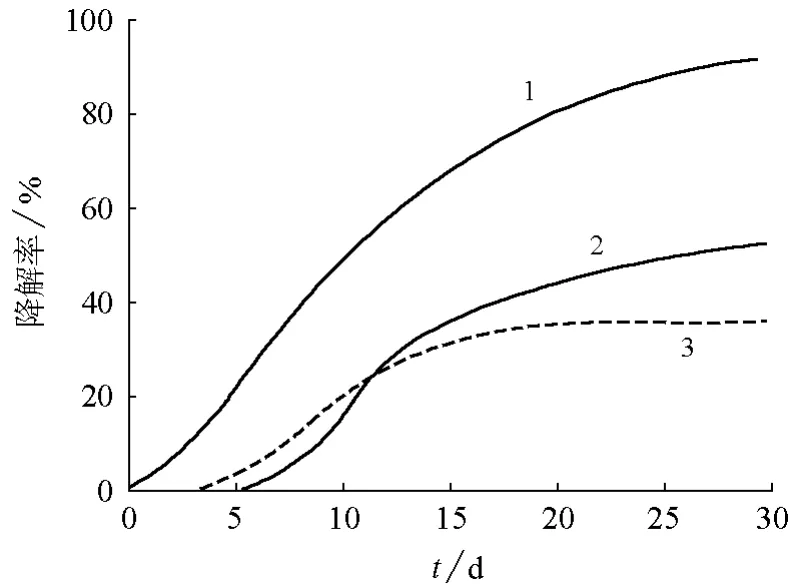
图4 非离子表面活性剂的生物降解性
一般直链脂肪醇聚氧乙烯醚(AEO)容易降解,平均降解率大于90%。对土壤中AEO降解的研究表明,两天内有50%的AEO降解为CO2和H2O[9];在两个星期内,90%的AEO降解。烷基酚聚氧乙烯醚(APEO)是另一大类非离子表面活性剂。在不同条件下,APEO的生物降解率>90%,具有较好的生物降解性。
烷基糖苷是由葡萄糖的半缩醛羟基与脂肪醇羟基在酸催化作用下脱去一分子水而得到的一种苷化合物。新型表面活性剂烷基多苷(APG)具有很高的生物降解性,一般在10天内,就能达到其他表面活性剂在28天内最终降解率大于80%的要求[8],因而被称为绿色表面活性剂。
APG有一个缩葡萄糖组成的亲水基团,亲水位置是苷基团上的羟基,它的水合作用强于环氧乙烷基团。因此APG具有优良的水溶性(图5)。
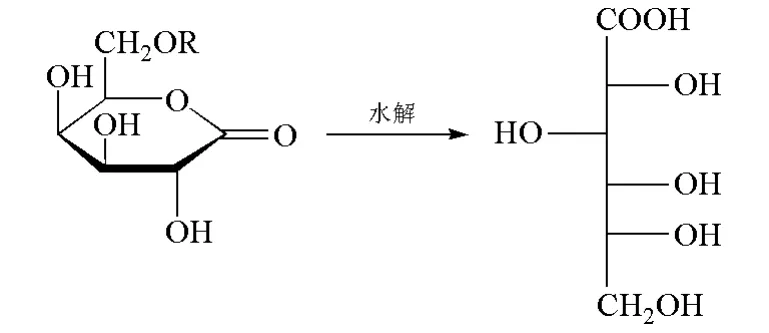
图5 APG在水溶液中的水解过程
在水溶液中,APG从苷键断裂生成相应的糖。实际上,葡萄糖先生成内酯,然后慢慢水解成酸,再连续β氧化,最后生成CO2和H2O。
烷基链长似乎对AEO的生物降解速度和降解度的影响不大。Sturm研究了一系列直链C8AEO3~C20AEO3(每次增加两个碳)的降解情况,研究结果表明:链长不影响生物降解,但链的支化度对AE的降解性能有较大影响。另有一些人的研究表明,羰基合成醇制备的高支化度的AEO只能缓慢地降解[8]。
对于非离子表面活性剂,大体上存在如下规律:①长链烷基比短链烷基难降解;②带支链的烷基比直链烷基难降解;③分子中存在酚基时较难降解;④PO及EO单元数越多越难降解;⑤相同长度的PO链比EO链难降解。
2.3 阳离子表面活性剂的生物降解性
阳离子表面活性剂在水溶液中离解时生成的表面活性离子带正电荷,其中的疏水基与阴离子表面活性剂中的相似;亲水基主要为氮原子,也有磷、硫、碘等原子。亲水基和疏水基可直接相连也可通过酯、醚和酰胺键相连。
由于阳离子表面活性剂一般具有强杀菌性和抗菌性,降解能力较弱,通常要在有氧条件下进行研究。很多阳离子表面活性剂甚至还会抑制其他有机物的降解,这决定了对阳离子表面活性剂的研究要比对阴离子和非离子表面活性剂更困难[12]。
北原文雄[13]等用耗氧测定法、溴酚蓝比色法、溶解有机碳法研究了21种直链阳离子表面活性剂在耗氧条件下的降解性。研究结果表明:烷基三甲基氯化铵和烷基苄基二甲基氯化铵基比较容易生物降解,而二烷基二甲基氯化铵及烷基吡啶氯化物的降解性则稍差。
从分子的结构来看,影响阳离子表面活性剂降解性能的基本因素是烷基链的结构,即链的数目(单,双,三)与是否具有分支。生物降解时,C—N键先断裂,然后经ω氧化、β氧化,最后生成CO2、H2O和NH3。所以烷基链的多少会影响生物降解性。
Swisher对季铵盐型阳离子表面活性剂结构与性能的关系进行了总结[14]:单直链烷基(RMe3N+)的降解速度快于双直链的(R2Me2N+),但R2Me2N+又快于三直链的R3MeN+。季氮上的一个甲基替换为苄基(如RBzMe2N+),降解速度稍降低;伯、仲、叔胺的降解性能与此类似。烷基吡啶(RPy+)的降解速度慢于季铵类,异喹啉(RQ+)化合物的降解速度更慢。结构的环化不一定降低降解速度。烷基咪唑(Rlz+)类化合物的降解速度快于季铵类。另外,阳离子表面活性剂疏水链长度增加将使降解速度减慢,已有人[15]通过计算法对此进行了证明。
阳离子表面活性剂与其他类型的表面活性剂复配后,不仅不会抑制降解的现象,反而能使两者都易降解。如十二烷基三甲基氯化铵在常温下不能降解,但当与LAS按等物质的量复配后,两者的降解能力都显著增强。一种可能的解释是由于复配后形成复合物,降低了阳离子表面活性剂的抗菌性,使降解易进行。
对于季铵盐型阳离子表面活性剂,直链烷基R的降解情况与阴离子及非离子表面活性剂的R相似,直链烷基数越多,需要的时间越多,所以降解速度为单直链烷基>双直链烷基>三直链烷基。对于杂环型阳离子表面活性剂,生物降解性主要与杂环的稳定性有关,杂环的稳定性越高,降解性越低。例如,在烷基吡啶和异喹啉中的杂环稳定性高,所以降解性比季铵类慢;在烷基咪唑类化合物中的杂环不稳定,所以比季铵类降解快。
2.4 两性离子表面活性剂的生物降解性
甜菜碱和酰胺丙基甜菜碱都易于生物降解。其他类型的两性离子表面活性剂(例如两性咪唑啉型、氨基酸型)也都有很好的生物降解性[16]。不同结构的磺酸基甜菜碱和羟基甜菜碱在各种情况下都有很高的初级生物降解度,但羟基甜菜碱的最终降解度要好于磺酸基甜菜碱。造成这种结果的原因目前尚不清楚,可能是—COO-部分和—部分的影响,也可能是两个离子中心的距离不同,也有可能是两方面的原因。
3 生物降解性预测
有些化合物的生物降解性不易由试验得出。对于较难测定的化合物,可以预测其生物降解性。2005年,Scow总结了定性预测有机化合物生物降解性的经验[17],并指出取代基的增加会阻止氧化作用,妨碍烷基链的断裂。据报道,有些官能团可以提高或降低化合物的生物降解性。无环化合物的生物降解性由其链长、支链数、碳链的饱和度及末端基团的氧化态决定;芳香族化合物的生物降解性由其取代基的种类、数量和位置决定。近年来,对有机物生物降解性的研究日益深入,有些学者采用定量结构模型来预测有机污染物的生物降解性,其中大部分模型是建立在参数上或仅限于某类化合物,并不具有普遍适用性。目前比较认可的是用基团贡献法预测有机物的生物降解性(即化合物的生物降解性与其基本结构及功能团有关),并由此证明可以由骨架结构和功能团以及受制于一定骨架结构的子结构来预测有机物生物降解性。
Loonen等用PLS法分析结构片段在生物降解中的作用,结构片段苯环不利于有机物的生物降解,非环形化合物比单环的苯易降解。Hiromatsu等用经验流程图法预测了有机化合物的生物降解性,该流程图由化合物某一特定骨架结构中的功能团数和基本结构与其生物降解性的关系得出,与日本通产省测试的177种单一苯系物及168种无环化合物数据对比,其准确率分别达到94%和88%。
4 影响表面活性剂生物降解的其他因素
影响表面活性剂降解的因素很多,除自身的结构外,还受微生物、光源、浓度、温度、氧化剂、pH等诸多因素的影响。研究表面活性剂降解的方法也较多,但主要是生物降解法和光降解法。影响表面活性剂的微生物降解的因素主要分为以下几个方面。
4.1 微生物活性
微生物活性对表面活性剂的降解至关重要。除微生物自身的种类以外,微生物活性还与表面活性剂及其他有机污染物的浓度、温度、pH等因素有关。高浓度的表面活性剂会降低微生物的活性,故在降解前需用臭氧进行预处理;一般微生物在常温、pH近中性条件下最容易存活、繁殖,因此表面活性剂在此条件下也最易分解[18-19];温度影响微生物的活动,从而也影响表面活性剂的降解,微生物的最适宜的生长和生物分解温度在30℃,并且其活性在一定范围内随温度升高而增加。例如在20℃时,LAS在水生系中的降解速度是1.5~3.5℃时的20倍[20]。
4.2 含氧量
表面活性剂的生物降解属于氧化还原反应,因此可将其分为需氧降解和厌氧降解两类。环境的含氧量对两者都具有显著的影响。一般说来,脂肪酸盐、α-烯基磺酸盐、对烷基苯基聚氧乙烯醚等在需氧、厌氧条件下都能降解,且它们的降解速度及降解度均相差不大。LAS在两种条件下的差异很大,其完全降解的时间在需氧和厌氧条件下分别为4天和57天[7,21];而阳离子表面活性剂则仅在需氧条件下降解。
4.3 地表深度
Karsa等[22]从不同地质的地表深度对生物降解LAS的影响进行了研究,发现随着地层深度增加,LAS的浓度迅速下降。在垂直深度2m内,LAS的浓度下降了近95%。原因是微生物在不同土壤中的浓度和活性随空间的分布不同。
5 对今后国内研究方向的探讨
国外早在20世纪60年代起就对表面活性剂的生物降解性进行了系统的研究,现在已经能从分子水平考察表面活性剂的降解过程;而我国对这方面的研究则还刚刚起步。从研究的趋势来看,我国现今表面活性剂研究应主要集中在以下几个方面[9]:
(1)完善各类表面活性剂快速、简便和准确的分析方法,实测在我国国内大量使用的表面活性剂的降解度数据,建立阳离子表面活性剂和两性离子表面活性剂的评价方法,实现标准化。
(2)新兴的表面活性剂不断涌现,应确定这些表面活性剂的生物降解性。
(3)研究表面活性剂结构与生物降解性的关系,从而指导表面活性剂的合成;这也是研究表面活性剂生物降解性的重点。
(4)明确一些表面活性剂的降解途径是了解结构与性能关系的关键。
(5)为了更全面了解表面活性剂在自然界中的降解情况,表面活性剂的初级生物降解与最终生物降解、厌氧生物降解等都应同时考虑。
[1]刘程.表面活性剂应用手册.北京:化学工业出版社,1992
[2]戴维.日用化学品科学,1999(6):20
[3]周文苑,王军.日用化学品科学,1998(4):20
[4]吴茂英,李宝.科技进展,2002,124(3):138
[5]王学川,张铭让,魏玉娟.中国皮革,2011,30(23):30
[6]关景渠,李济生.环境科学,1993,15(2):81
[7]王正五,李干佐,张笑一,等.日用化学工业,2001,31(5):32
[8]肖寒,张笑.日用化学工业,2003,33(40):207
[9]秦勇,张高勇,康保安.日用化学品科学,2002,25(5):20
[10]赵郁梅,秦勇,张高勇.日用化学工业,2002,32(6):60
[11]Steber J,Wierich P.Tensi Deter,1983,20(4):183
[12]曹素珍,李正,任海静,等.日用化学工业,2011,41(2):127
[13]北原文雄.表面活性剂物性应用化学生态学.北京:化学工业出版社,1999
[14]Swisher R D.J Am Oil Chem Soc,1963,40(11):648
[15]陈胜慧,金晓红,李素悦.化学学报,2003,54(2):277
[16]方云.两性表面活性剂.北京:轻工业出版社,2000
[17]Scow K M,Hicks K A.Curr Opin Biotech,2005,16:246
[18]陈熹兮,李宝,李道棠.自然杂志,2011,23(3):163
[19]李丽,张笑一,朱淮武,等.日用化学工业,2004,34(3):143
[20]Lgeorge A.Marine Envi Res,2002,53:403
[21]Larso R.日用化学工业译从,1989(6):5
[22]Karsa D R,罗毅.日用化学工业译丛,1992(2):10

