凝血Ⅹa因子直接抑制剂的研究进展与临床应用评价
张石革(北京大学第四临床医学院,北京积水潭医院药剂科,北京 100035)
凝血因子(blood coagulation factor)为一组参与凝血过程的蛋白质,总计13种,全部来自于血浆,这些因子形成酶促级联反应,即一个因子激活下一个因子,依次类推,最终导致凝血。凝血因子Ⅹ是由448个氨基酸残基所组成,激活时释放出一肽段,形成由二硫键连结的两条肽链。激活后的因子Ⅹ与Ca2+、磷脂及因子Ⅴ共同形成一复合物,后者最终使凝血酶原激活为凝血酶。Ⅹa因子位于内、外源性凝血途径的交汇点,主要催化Ⅱ因子向Ⅱa因子转化,由于凝血过程存在的生物信号放大,一个凝血Ⅹa因子抑制剂可以抑制138个凝血酶原分子的生理效果。因此,凝血Ⅹa因子直接抑制剂相比直接凝血酶抑制剂更为有效。
1 凝血Ⅹa因子直接抑制剂的进展与优势
依据统计,我国成年人心房颤动(atrial fibrillation,AF)的发生率为0.77%,主要并发症是血栓栓塞,为卒中独立和高危因素,我国每年新增200万卒中患者中15% ~20%是由AF所致。鉴于心腔内血栓的形成依赖介于血小板和纤维蛋白之间,心脏内血栓脱落后沿血循环进入大脑并阻塞血管,引起卒中,因而抗凝治疗是防治AF卒中的关键。2012年9月发布的我国首部《心房颤动抗凝治疗中国专家共识》明确指出,若无禁忌证,AF患者中风风险评估(CHADS2)评分(充血性心力衰竭、高血压病、年龄≥75岁、糖尿病、卒中或短暂性脑缺血发作病史)≥1分的AF患者,卒中风险较高,应积极进行抗凝治疗,预防动脉系统血栓形成。鉴于传统抗凝血药的诸多局限性,非为AF卒中、深静脉栓塞防治的最佳选择。因此,寻求应用简便、有效、安全的抗凝血药一直是临床所期盼的愿景。
1.1 有关凝血Ⅹa因子直接抑制剂的研究进展
凝血Ⅹa因子为一种丝氨酸蛋白酶,可以将凝血酶原转化为凝血酶,是一个极具临床价值的抗凝作用靶点,在控制凝血酶形成和活化凝血瀑布中有重要的地位。在凝血机制上,凝血Ⅹa因子是内、外源共同凝血途径的第一步,抑制因子Ⅹa可抑制凝血酶爆发式生成,当外源性凝血途径被激活,通过活化Ⅹ因子为Ⅹa因子进而激活Ⅱ因子为Ⅱa因子,此过程是一个瀑布式的反应,将有大量Ⅱa因子生成,继而Ⅱa因子把纤维蛋白原活化为纤维蛋白。如在源头将Ⅹa因子抑制,瀑布式的反应就不会发生;且此时仍然残留部分的Ⅱa因子,这些残留的Ⅱa因子可以继续满足血小板黏附、聚集形成初级血栓的需要,因此可以维持人体正常的生理性止血过程。因此,凝血Ⅹa因子直接抑制剂既能直接参与抗凝,又能有效降低出血风险。在抑制Ⅹa因子后,可以有效保留其抑制血栓形成的作用,而且停药后也没有反弹现象,即不会引起血栓再发,同时,直接、高度专一的单靶点抑制药物,无Ⅱa因子直接抑制剂具有的除抗凝外的其他不良反应。
2008年上市的第一个凝血Ⅹa因子直接抑制剂利伐沙班,其对游离或结合的Ⅹa因子均具有高度抑制作用,可中断凝血瀑布的内、外源性途径,抑制凝血酶的产生和血栓形成,在ROCKET-AF研究中证实了利伐沙班20 mg/d与华法林(INR控制在2.0~3.0)对14 172例高危AF患者预防脑卒中和血栓事件的疗效。此后,阿哌沙班、依度沙班、贝曲沙班、奥米沙班和雷扎沙班等相继问世,为抗凝治疗增添了新的选择[1]。凝血Ⅹa因子直接抑制剂的上市概况见表1(奥米沙班、雷扎沙班、卡拉非班为正待上市的凝血Ⅹa因子抑制剂)。
1.2 凝血Ⅹa因子抑制剂的作用优势
鉴于一个分子的Ⅹa因子可以产生一千个分子的Ⅱa因子,与凝血酶复杂的生理功能比较,Ⅹa因子作用较单纯,其不活化血小板,对凝血瀑布无正反馈作用,也不影响蛋白C系统,因此,凝血Ⅹa因子抑制剂具有下列优势:(1)作用直接、选择性高、竞争性地与Ⅹa因子的活性位点结合,可逆性抑制游离和结合的Ⅹa因子以及凝血酶原活性[2]。(2)既有强大的抗凝作用,又不影响已形成的凝血酶的正常生理止血功能,保留足够的凝血酶活性以激活血小板;同时回避因为抑制凝血Ⅱa因子而干扰体内多种生理过程(促凝、炎症、细胞增殖),促使抗凝作用由多靶点向单靶点迈进,从而超越直接凝血酶抑制剂。(3)在抑制凝血酶形成和活化凝血瀑布中占有重要地位,在凝血瀑布上游抑制凝血因子将产生更强的抗凝作用。(4)治疗窗宽,无需监测INR[3]。(5)在非靶标生物毒性方面具有优势,对肾脏依赖性小于直接凝血酶抑制剂达比加群酯,对肾功能不全者的出血、胃肠道的不良反应和出血率较小。(6)可直接口服,鉴于药物血浆半衰期均较长,1日仅需服用1~2次。(7)凝血Ⅹa因子抑制剂中贝曲沙班极少经肾脏清除,可用于严重肾功能不全者。(8)可联合标准抗血小板药(阿司匹林、氯吡格雷、替格雷洛)用于急性冠状动脉综合征(ACS)的防治(单药或双药),可降低ACS患者心血管事件的发生率且不增加出血概率[4]。凝血Ⅹa因子直接抑制剂的药动学参数见表2。
2 凝血Ⅹa因子直接抑制剂的临床应用评价
2.1 利伐沙班
利伐沙班用于预防髋、膝关节置换术后患者深静脉血栓和肺栓塞的形成,也可用于预防非瓣膜性AF患者脑卒中和非中枢神经系统性栓塞,降低ACS复发风险等,于2009年6月获准进入中国。
一项针对利伐沙班用于预防非瓣膜性AF患者卒中和非中枢神经系统全身栓塞的疗效与安全性研究(ROCKET AF试验)[5],入选45个国家、1 178个中心、至少有2项卒中危险因素的14 264例AF患者。约90%患者CHADS2积分≥3分,随机给予利伐沙班(20 mg/d)或华法林治疗。治疗意向性人群分析结果发现,利伐沙班组主要终点(卒中和体循环血栓)的年发生率为2.1%,不劣于华法林组2.4%(P=0.12),但治疗期间主要终点的发生率2组分别为1.7%和2.2%,利伐沙班优于华法林,相对风险降低21%(P=0.02)。研究还发现,出血性卒中利伐沙班发生率为0.3%,显著低于华法林的0.4%。大出血和临床相关的非大出血的复合终点发生率利伐沙班为14.9%,与华法林的14.5%相当,而关键部位出血、致死性出血及颅内出血则显著降低。心肌梗死的发生率2组相当(利伐沙班0.9%vs.华法林1.1%),肝脏安全性2组也相似[5]。基于上述ROCKET AF研究结果,美国食品药品管理局(FDA)于2011年11月批准其上市用于AF卒中的预防[6]。
利伐沙班(10 mg)已批准用于选择性髋关节或膝关节置换手术成人患者静脉血栓栓塞的预防;其利伐沙班(15 mg)和利伐沙班(20 mg)被批准用于1种或多种风险因素(如充血性心力衰竭、高血压、75岁及以上的年龄、糖尿病或既往卒中、短暂性脑缺血发作)引起的非瓣膜性AF成人患者卒中和系统性栓塞的预防;利伐沙班(15 mg)和利伐沙班(20 mg)还被批准用于治疗深静脉血栓形成、肺栓塞、预防深静脉血栓形成复发及成人肺栓塞。欧洲药品管理局(EMA)推荐利伐沙班用于ACS。
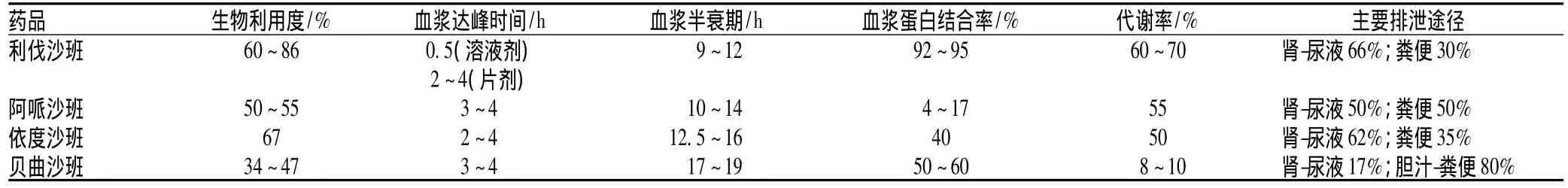
表2 凝血Ⅹa因子直接抑制剂的药动学参数Tab 2 Pharmacokinetic parameters of the direct coagulation factorⅩa inhibitors
另一项在非瓣膜性AF患者中断利伐沙班与华法林治疗的对比研究(ROCKET AF试验)分析(利伐沙班,1日1次,口服,直接Ⅹa因子抑制剂与维生素K拮抗剂华法林预防AF患者卒中和栓塞的试验)中断使用利伐沙班所造成的血栓栓塞事件发生率与华法林相当。卒中或者非中枢神经系统栓塞的发生利伐沙班组与华法林组有类似的风险,所有血栓事件在30 d内停药,研究包括卒中、非中枢性栓塞、心肌梗死、心血管死亡等,2 组间风险类似[7],HR=1.02(95%CI=0.83 ~1.26,P=0.85)。
2.2 阿哌沙班
基于AVERRORS与ARISTOTLE 2项3期临床研究结果,美国FDA于2012年12月28日批准阿哌沙班上市。AVERROES研究纳入36个国家5 599例AF伴卒中风险增高而由于各种原因不宜接受华法林治疗者。随机接受阿哌沙班1次5 mg,1日2次或阿司匹林81~324 mg/d的治疗,平均随访1.1年。结果显示,阿哌沙班比阿司匹林更能降低卒中和全身血栓栓塞风险,且并不显著增加严重出血和脑出血风险[8]。
ARISTOTLE研究在39个国家1 034个中心进行,纳入18 201例合并至少1个卒中危险因素的AF患者,比较阿哌沙班和华法林的疗效和安全性。结果证实,相对于华法林,阿哌沙班显著减少AF患者21%卒中或全身性栓塞风险、31%大出血风险、11%死亡风险[9]。
在日本进行的一项随机、双盲、安慰剂对照的2期临床研究旨在考察阿哌沙班联合标准抗血小板治疗对ACS患者预防卒中的效果。近期发作的151例ACS患者随机分为阿哌沙班2.5 mg、1日2次组(n=49)和阿哌沙班5 mg、1日2次组(n=50)或安慰剂组(n=51),连续24周。结果显示,3组出血率分别为4.1%、4.1%和5%,3组均无出血性卒中的发生。提示阿哌沙班联合标准抗血小板治疗,可有效预防卒中的发生[10]。
2.3 贝曲沙班
贝曲沙班是目前唯一经肾脏排泄最少的药物,主要以原形药物由胆汁排泄,可用于严重肾损害者。一项对508例非瓣膜性AF患者进行卒中预防研究,随机分为贝曲沙班40、60、80 mg/d组和华法林组,结果显示,AF患者对贝曲沙班3种剂量均能较好耐受,与其他组比较,贝曲沙班40 mg/d组患者出血比例最低,且80和140 mg/d剂量组对心血管毒性、肝毒性和对心电图影响较小,平均QT变化均<10 ms[11]。
一项名为EXPLORE-Ⅹa的多中心、随机、平行的2期临床研究贝曲沙班和华法林在来自35个中心的508例非瓣膜性AF或心房扑动患者(存在至少1种可诱发卒中的危险因素:高龄、既往卒中、糖尿病、高血压病史、平均年龄74岁。53.5%的受试者根据Cockcroft-Gault公式评估的肾小球滤过率在70 ml/min以上,所有受试者的CHADS2评分的平均值为2.2)的抗凝治疗中的安全性、耐受性及有效性进行比较。受试者随机平均分为4组,分别接受贝曲沙班40 mg/d(n=127)、60 mg/d(n=127)、80 mg/d(n=127)或华法林(n=127)治疗(INR为2~3)。随访时间为3~12个月(中位数为4.9个月)。记录大出血和具有临床意义的非大出血的发生情况,其中,大出血定义为血红蛋白质量浓度下降超过20 g/L、需输入全血或2个单位的浓集红细胞,或者关键部位出血(如颅内出血)。主要考察指标为至发生大出血和具有临床意义的非大出血事件的时间,次要考察指标为至发生任意1种出血事件的时间,以及至发生死亡、卒中、心肌梗死或全身性栓塞的时间。结果显示,本品40 mg/d组、60 mg/d组、80 mg/d组和华法林组中大出血或具有临床意义的非大出血的发生率分别为0.8%、3.9%、3.9%和5.5%;贝曲沙班40 mg/d组和80 mg/d组中任意1种出血事件(包括大出血、具有临床意义的非大出血或轻微出血)的发生率分别为17.3%和18.9%,均显著低于华法林组(31.5%)(P=0.011,P=0.022);而贝曲沙班60 mg/d组为25.2%,与华法林组无显著差异(P=0.309);上述4组中,贝曲沙班60 mg/d组和80 mg/d组各有1例受试者发生卒中,贝曲沙班40 mg/d组和华法林组各1例受试者死亡,未见心肌梗死或全身性栓塞的报告。上述研究结果表明,患有非瓣膜性AF或心房扑动、至少有1种卒中风险因子患者1日口服1次贝曲沙班,可显著减少大出血和非大出血的发生率,效果明显优于华法林,且耐受性良好,安全性高[12]。
2.4 依度沙班
依度沙班适用于接受全膝关节置换术(TKA)、全髋关节置换术(THA)、髋关节骨折手术(HFS)患者并发静脉血栓栓塞。在日本及台湾对接受TKA、THA、HFS患者进行依度沙班临床试验,结果显示,依度沙班各剂量组抑制静脉血栓栓塞发生的作用均显著优于安慰剂组,与依诺肝素钠组相当;大出血或临床意义上严重出血的发生率方面,各给药组间差异无统计学意义。目前正在开展ENGAGE AF-TIMI研究,计划纳入21 000例AF患者,比较依杜沙班和华法林预防卒中的作用[13]。
依度沙班在AF卒中预防领域正在进行一项3期临床研究,即ENGAGE AF-TIMI48研究(新一代Ⅹa因子抑制剂在AF患者中的抗凝作用-心肌梗死溶栓试验48)[14],该研究入组20 500例卒中中危AF患者(CHADS2积分≥2),随机分为依度沙班30、60 mg组及华法林组,比较依度沙班与华法林的疗效和安全性,研究预计2012年结束。
2.5 奥米沙班
奥米沙班由法国Sanofi-Aventis公司研发,静脉注射给药,耐受性良好,带有靶向作用,消除迅速,经过肾脏排泄少,不足给药剂量的25%。因此,肾功能不全者不需调整剂量。以非ST段抬高ACS患者为受试者的2期临床已经公布,3期临床研究正在进行中[15]。
奥米沙班SEPIA-ACS1/TIMI-42Ⅱ期临床研究有36个国家196个医疗中心参与,将ACS患者3 241例随机分配至接受奥米沙班5种剂量之一的治疗组或由于普通肝素+依替巴肽组成的标准抗凝治疗组。结果显示,中等剂量组奥米沙班使死亡、复发性心肌梗死或其他缺血性并发症的发生率相对于标准抗凝治疗组下降40%。
一项名为SEPIA-PCI,总计947例即将接受非紧急经皮冠脉介入治疗(PCI)患者参加的多中心、随机、平行、双盲、剂量递增的2期临床研究对奥米沙班和肝素的抗凝效果及安全性进行评价。受试者在行非紧急PCI前,随机分为奥米沙班A、B、C、D、E组[经体质量校正后分为5个剂量亚组,各剂量组均先静脉注射然后静脉滴注,其中A、B、C、D、E组静脉推注剂量分别为25、45、80、120 和 140μg/kg,静脉滴注速率分别为 35、65、120、160 和 200μg/(kg·h),均 3 h 滴毕;肝素组,50 ~70 U/kg,静脉推注],主要终点事件是凝血酶原片段1+2(F1+2)和抗Ⅹa因子的活性改变,次主要终点事件是PCI术后3 d或出院时心肌梗死溶栓治疗(TIMI)后出血发生率以及术后30 d心血管缺血事件的发生率。结果显示,奥米沙班最高剂量受试者的F1+2水平比给药前降低0.3 μg/L,与肝素组(降低0.2 μg/L)相比差异显著(P=0.008);TIMI后出血发生率分别是 2.0%,1.9%,3.8%,3.9%和 2.6%,肝素组为3.8%;奥米沙班A、B、C、D、E组心血管缺血事件发生率分别为 5.8%,7.1%,3.8%,2.5% 和 5.1%,肝素组为 5.6%[16]。该项研究结果表明,高剂量奥米沙班可显著降低F1+2水平,且效果优于肝素组,但奥米沙班各剂量组与肝素组出血事件发生率无显著性差异。
一项名为SEPIA-ACS1 TIMI42,共纳入3 241例即将接受早期PCI治疗的非ST段抬高型心肌ACS患者的随机、双盲、阳性药物对照的2期临床研究中,受试者接受奥米沙班[先以 80 μg/kg 静脉注射,然后以35、70、105、140 或175μg/(kg·h)的速度静脉滴注,直至PCI结束]或肝素[先以60 IU/kg静脉注射,然后以12 IU/(kg·h)的速度静脉滴注,直至PCI结束]+依替巴肽[先以180 μg/kg静脉注射,然后以1.0~2.0 μg/(kg·min)的速度静脉滴注,直至 PCI结束后 18~24 h]。该项研究的目的是为了确定奥米沙班的最佳剂量,主要疗效指标为7 d内出现死亡、再发心脏事件、冠脉并发症、出血等情况的患者比例。结果显示,奥米沙班由低到高5个剂量组中符合主要疗效指标的患者比例分别为7.2%、4.6%、3.8%、3.6%和4.3%;肝素+依替巴肽联用组为6.2%。符合主要安全性指标的患者比例分别为1.6%、1.6%、3.1%、3.4%和5.4%,肝素+依替巴肽联用组为2.7%(12/448)。该项研究结果表明,除了最低剂量组外,其他奥米沙班组的死亡、再发心脏事件、冠脉并发症的发生率均低于肝素+依替巴肽联用组。尤其是接受中等剂量奥米沙班的患者死亡率和缺血事件发生率明显降低40%,出血事件发生率在2组间无差别[17]。
3 凝血Ⅹa因子直接抑制剂的合理应用与监护
3.1 监测出血
抗凝血(抗栓)或促凝血(止血)是人体血液系统中2种对立、相互依存、和谐、保持动态平衡的机制,互为矛盾和因果,这一精准过程维持着循环、血液系统的完整性,临床在取得抗凝效果的同时必然会带来出血的风险,因此,权衡利弊,在追求最大抗凝效果同时又规避出血风险是临床最为完美的意境。利伐沙班和阿哌沙班等常见大出血、贫血(包括术后贫血和伤口出血)、血小板计数减少等不良反应。一些亚群患者的出血风险较高。治疗开始后,要对这些患者实施密切监测,观察是否有出血并发症,可以通过定期测定血红蛋白来实现。
3.2 监测肝功能
利伐沙班口服通过肝脏代谢,对肝功能有一定影响。一项安全性研究分析中,对604例患者比较给予利伐沙班和华法林后肝毒性[18]。血谷氨酸转氨酶浓度超过正常范围上限3倍的患者在利伐沙班组平均为3.1%,在华法林组为2.16%。但50%的患者在开始服用利伐沙班后的前21 d内血谷氨酸转氨酶出现升高,21 d后利伐沙班组降至1.9%,华法林组可降至0.9%。虽由于样本量较小,结果无统计学意义,但仍需注意相对华法林,利伐沙班对肝脏的影响有增加趋势。阿哌沙班与抗真菌药及蛋白酶抑制剂等联合应用时可减少阿哌沙班经肝脏代谢的比例,增加经肾脏代谢的比例,故存在肾功能不全者尤应注意与以上药物的联合应用[19]。
3.3 监测不良的药物相互作用
作用于利伐沙班2条消除途径之一肝酶CYP3A4或P糖蛋白(P-gp)的强效抑制剂(胺碘酮、地尔硫䓬、维拉帕米、西咪替丁、环丙沙星、依诺沙星、克拉霉素、多西环素、红霉素、泰利霉素、利福平、氟伏沙明、伊马替尼、伊曲康唑、氟康唑、酮康唑、咪康唑、伏立康唑、泊沙康唑、奈法唑酮、利托那韦、沙喹那韦、茚地那韦、苯妥英钠、苯巴比妥、卡马西平、肝素)将使利伐沙班的血药浓度轻度升高,故利伐沙班不宜与强效CYP3A4或P-gp抑制剂(维拉帕米、环孢素、奎尼丁、利血平、长春新碱、他莫昔芬、托瑞米芬等)联合应用。
类同利伐沙班,强效CYP3A4和P-gp的双重抑制剂增加阿哌沙班的血药浓度,应降低阿哌沙班剂量至2.5 mg或避免同时使用;强CYP3A4和P-gp诱导剂的同时使用降低阿哌沙班的血药浓度,应避免同时使用[20]。
3.4 治疗费用较华法林昂贵
利伐沙班(拜瑞妥)25 mg/d每日治疗费用为84元,阿哌沙班10 mg/d每日治疗费用达到100元,相对华法林3 mg/d治疗费用5.2元而言,相对的治疗费用要大些。
3.5 成本效率分析的前提是入选病例的卒中风险大小
另对药物成本效率方面分析,Shah等的研究提示,药物成本效率高低主要取决于患者脑卒中的风险大小。对于低脑卒中风险即CHADS2评分=0,应用阿司匹林成本效率最高;对于中危即CHADS2评分=1~2分,使用华法林成本效率最高;高危即CHADS2评分≥3分的患者,使用达比加群150 mg,1日2次的成本效率最高。另对于CHADS2评分=2分的患者,如每年主要出血率预计在6%以上或服用华法林时INR波动较大者,达比加群150 mg,1日2次的成本效率最高。而利伐沙班、阿哌沙班的相关成本效率研究提示,因以上用药可降低出血及卒中风险,故虽治疗费用较高,但实验室检查费用较低,且进一步降低由于出血后治疗费用,故相对于华法林成本效率较高[21]。
最近,Amitava等利用丹麦的非瓣膜性AF数据库,应用模型模拟分析达比加群、利伐沙班、阿哌沙班在临床实践中的临床净效益(平衡缺血性卒中和颅内出血风险)。结果发现,CHADS2评分=0分但出血风险高时,达比加群110 mg和阿哌沙班有明显净效益,CHA2DS2-VASc评分=1分时,达比加群(110和150 mg)和阿哌沙班均有明显净效益。当CHADS2评分≥1分或CHA2DS2-VASc评分≥2分时,3种口服抗凝血药净效益均明显优于华法林,且出血风险越高,临床净效益越明显[22]。
[1] Mantha S.Target-specific oral anticoagulants in atrial fibrillation:results of phase III trials and comments on sub-analyses[J].J Thromb Thrombolysis,2013,36(2):155-162.
[2] Cabral KP.Pharmacology of the new target-specific oral anticoagulants[J].J Thromb Thrombolysis,2013,36(2):133-140.
[3] Scaglione F.New oral anticoagulants:comparative pharmacology with vitamin K antagonists[J].Clin Pharmacokinet,2013,52(2):69-82.
[4] Oldgren J,Wallentin L,Alexander JH,et al.New oral anticoagulants in addition to single or dual antiplatelet therapy after an acute coronary syndrome:asystematic review and meta-analysis[J].Eur Heart J,2013,34(22):1670-1680.
[5] ROCKET AF Study Investigators.Rivaroxaban-once daily,oral,direct factorⅩa inhibition compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation:rationale and design of the ROCKET AF study[J].Am Heart J,2010,159(3):340-347.
[6] Patel MR,Mahaffey KW,Garg J,et al.Rivaroxaban versus warfarin in nonvalvular atrial fibrillation[J].N Engl J Med,2011,365(10):883-891.
[7] Patel MR,Hellkamp AS,Lokhnygina Y,et al.Outcomes of discontinuing rivaroxaban compared with warfarin in patients with nonvalvular atrial fibrillation:analysis from the ROCKET AF trial(Rivaroxaban Once-Daily,Oral,Direct FactorⅩa Inhibition Compared WithVitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation)[J].J Am Coll Cardiol,2013,61(6):651-658.
[8] Connolly SJ,Eikelboom J,Joyner C,et al.Apixaban in patients with atrial fibrillation[J].N Engl J Med,2011,364(9):806-817.
[9] Granger CB,Alexander JH,McMurray JJ,et al.Apixaban versus warfarin in patients with atrial fibrillation[J].N Engl J Med,2011,365(11):981-992.
[10] Ogawa H,Goto S,Matsuzaki M,et al.Randomized,Double-Blind Trial to Evaluate the Safety of Apixaban With Antiplatelet Therapy After AcuteCoronary Syndrome in Japanese Patients(APPRAISE-J)[J].Circ J,2013,77(9):2341-2348.
[11] Morganroth J,Gretler DD,Hollenbach SJ,et al.Absence of QTc prolongation with betrixaban:a randomized,doubleblind,placebo-and positive-controlledthorough ECG study[J].Expert Opin Pharmacother,2013,14(1):5-13.
[12] Connolly SJ,Eikelboom J,Dorian P,et al.Betrixaban compared with warfarin in patients with atrial fibrillation:results ofaphase 2, randomized, dose-ranging study(Explore-Ⅹa)[J].Eur Heart J,2013,34(20):1498-1505.
[13] Ahrens I,Bode C.Oral anticoagulation with edoxaban.Focus on current phase Ⅲ clinical development[J].Hamostaseologie,2012,32(3):212-215.
[14] Ruff CT,Giugliano RP,Antman EM,et al.Evaluation of the novel factorⅩa inhibitor edoxaban compared with warfarin in patients with atrial fibrillation:design and rationale for the Effective aNticoaGulation with factor xA next GEneration in Atrial Fibrillation-Thrombolysis In Myocardial Infarction study 48(ENGAGE AF-TIMI 48)[J].Am Heart J,2010,160(4):635-641.
[15] Sabatine MS,Antman EM,Widimsky P,et al.Otamixaban for the treatment of patients with non-ST-elevation acute coronary syndromes(SEPIA-ACS1 TIMI 42):a randomised,double-blind,active-controlled,phase 2 trial[J].Lancet,2009,374(9692):787-795.
[16] Cohen M,Bhatt DL,Alexander JH,et al.Randomized,double-blind,dose-ranging study of otamixaban,a novel,parenteral, short-acting directfactorXainhibitor, in percutaneous coronary intervention:the SEPIA-PCI trial[J].Circulation,2007,115(20):2642-2651.
[17] Sabatine MS,Antman EM,Widimsky P,et al.Otamixaban for the treatment of patients with non-ST-elevation acute coronary syndromes(SEPIA-ACS1 TIMI 42):a randomised,double-blind, active-controlled, phase 2 trial[J].Lancet,2009,374(9692):787-795.
[18] Eriksson BI,Borris LC,Dahl OE,et al.A once-daily,oral,direct Factor Ⅹa inhibitor,rivaroxaban(BAY 59-7939),for thromboprophylaxis after total hip replacement[J].Circulation,2006,114(22):2374-2381.
[19] Wang L,Zhang D,Raghavan N,et al.In vitro assessment of metabolic drug-drug interaction potential of apixaban through cytochrome P450 phenotyping,inhibition,and induction studies[J].Drug Metab Dispos,2010,38(3):448-458.
[20] Mendell J,Zahir H,Matsushima N,et al.Drug-Drug Interaction Studies of Cardiovascular Drugs Involving PGlycoprotein,an Efflux Transporter, on the Pharmacokinetics of Edoxaban,an Oral Factor Ⅹa Inhibitor[J].Am J Cardiovasc Drugs,2013.
[21] Shah SV,Gage BF.Cost-effectiveness of dabigatran for stroke prophylaxis in atrial fibrillation[J].Circulation,2011,123(22):2562-2570.
[22] Banerjee A,Lane DA,Torp-Pedersen C,et al.Net clinical benefit of new oral anticoagulants(dabigatran,rivaroxaban,apixaban)versus no treatment in a‘realworld’atrial fibrillation population:a modelling analysis based on a nationwide cohort study[J].Thromb Haemost,2012,107(3):584-589.

