补充扇贝寡肽对运动大鼠骨骼肌废用性萎缩的干预研究
郭振新
(广东罗定职业技术学院,广东罗定 527200)
运动员因某种原因如伤病、赛季外休整或退役等终止或负荷减量后,机体负荷部位的骨骼肌可出现不同程度的萎缩。这种去负荷后肌萎缩或废用性肌萎缩一直是临床医学和运动医学研究领域的热点,有许多文献报道了废用性肌萎缩发生的机制及其对运动员竞技能力的影响[1,2]。据文献,目前从营养干预的角度研究运动员停训后肌萎缩的研究报道尚为鲜见。本实验研究补充扇贝寡肽对骨骼肌废用性萎缩的影响,为探讨运动员停训后肌萎缩的机制及其干预研究提供参考。
1 研究材料与方法
1.1 实验对象与分组
40只雄性、健康Sprague-Dawley大鼠,体重160~180g,在实验室适应性喂养3天后即进行为期3周的递增负荷运动,然后随机抽取大鼠为基础对照A组(n=10),其余大鼠为B组用于制备骨骼肌萎缩模型,3周后随机分组为补充扇贝寡肽实验B1组(n=10)、补充安慰剂阴性对照B2组(n=10)、补充牛乳阳性对照B3组(n=10)。各组动物体重无显著性差异,大鼠分笼饲养。实验室温控制在(22±3)℃,相对湿度为50% ~60%,用日光灯控制昼夜节律为12h light/12h dark。
1.2 研究方法
1.2.1 动物运动模型
大鼠在实验室适应性喂养期间,每天均进行一次适应性的水平跑台运动,速度为5~10m/min,时间为5~10min。正式训练时,大鼠在跑台上进行递增负荷的跑台运动,速度递增3m/min/week、运动时间递增30min/week,即第1周速度为15m/min,运动时间为30min;第2周速度为18m/min,运动时间为60min;第3周速度为21m/min,时间为90min。大鼠每周训练6d,休息 1d,共 3 week。
1.2.2 停训综合症动物模型
递增负荷运动3周后,大鼠随机分为安静对照A组(n=10)和制动B组(n=30),B组大鼠左侧后肢用可塑性石膏由足跖管型固定至膝上1 cm处,膝关节固定于屈曲位100°,踝关节固定于跖屈60°,以便小腿的肌肉保持于松弛位,共3周。每日检查固定情况,如发现大鼠啃咬或出现固定松动,则随时进行调整或重新固定以保证制动效果。
1.2.3 动物营养干预模型
制动3周后,B组大鼠即解除制动处理,并随机分为3组即B1(n=10)、B2(n=10)、B3(n=10)。B1组大鼠灌胃15%的扇贝寡肽饮料2ml(其中含扇贝肽0.3g),1次/日;B2组灌胃等量的纯净水,B3组大鼠灌胃等量的牛乳为对照。A组大鼠在试验期间灌胃等量的纯净水。扇贝寡肽(scallop peptides,SPs)是从海洋生物栉孔扇贝中提取并经酶解后获得的一种具有高生物活性的水溶性8肽(Pro-Asn-Ser-Thr-Arg-Hyl-Cys-Gly),相对分子量为879D。
1.2.4 标本取材与指标测试
1.2.4.1 标本取材
大鼠在为期3周的营养干预后,用25%乌拉坦溶液腹腔注射麻醉,腹主动脉取血5~8 ml,常温静置1h后离心(3000rpm,常温),血清分离后-20℃保存待测;同时取双侧腓肠肌,剔除筋膜等、4℃生理盐水清洗、吸干后称湿重,计算固定侧肌肉与对侧的湿重比;固定侧腓肠肌一半肌组织于液氮中冻存待测、另一半肌组织迅速置于10%甲醛溶液中固定,制作石蜡切片。
1.2.4.2 光镜下腓肠肌肌纤维直径和截面积测定
腓肠肌石蜡切片常规HE染色,每只大鼠观察2张切片,在BX50F-3奥林巴斯系统显微镜下,每张切片中随机5个高倍视野下,用Med6.0显微图像分析系统(Med6.0A分析软件)采集图像,测量横切片中肌纤维的直径和截面积。
1.2.4.3 细胞凋亡TUNEL法测定凋亡细胞
切片常规脱蜡至水;PBS冲洗5min×3;蛋白酶K(20μg/ml溶于10Mm Tris/HCL中,PH7.4)室温孵育20min;PBS冲洗5min×3;滴加50μl TUNEL反应混合液,37℃孵育 60min;PBS冲洗 5min×3;滴加 50μl TUNEL过氧化物酶标抗体,37℃孵育30min;PBS冲洗5min×3;滴加DAB底物溶液,室温孵育5-20min,显微镜下控制显色;双蒸水洗;脱水、透明、封片、显微镜下观察细胞核有棕黄染色颗粒者为凋亡细胞。每只大鼠观察2张切片,每张切片计量5个高倍视野中凋亡细胞占总细胞得百分数,即凋亡指数(Apoptosis Index,AI)。并用图像分析系统测试凋亡细胞光密度值。
1.2.4.4 凋亡相关蛋白Bax和Bcl-2免疫组化测定
切片常规脱蜡至水自来水冲洗、3%H2O2室温孵育10 min微波修复抗原常温冷却后PBS冲洗5min×310%山羊血清室温孵育10 min滴加1抗50μl(Bax、Bcl-2,1:50)置4℃冰箱过夜常温后PBS冲洗5min×3滴加2抗,37℃孵育30min(烤片)PBS冲洗5min×3 DAB显色4-5min双蒸水洗脱水、透明、封片、显微镜下观察。光学显微镜高倍视野下,随机选取5个区域,用图像分析系统对每一区域进行光密度分析,分别测试凋亡相关蛋白Bax和Bcl-2。
1.2.4.5 腓肠肌收缩蛋白表达测定
用免疫组织化学(SABC法)检测肌球蛋白的表达。肌球蛋白的表达检测步骤:石蜡切片脱蜡至水;PBS(pH 7.4)冲洗3次,5min×3,3%H2O2室温孵育5~10min,以消除内源性过氧化物酶的活性,蒸馏水冲洗2×3min,PBS浸泡5min,微波抗原热修复,5~10%正常山羊血清封闭,室温孵育10min,倾去血清,勿洗,鼠抗骨骼肌肌球蛋白(Myosin)抗体(1:50),4℃过夜PBS冲洗,5min×3次 Biotin-Goat Anti-Mouse IgG,37℃ 20minPBS冲洗,5min×3次试剂 SABC,37℃20minPBS冲洗,5min×3次DAB显色自来水充分冲洗苏木素轻度复染封片。
1.2.4.6 腓肠肌细胞需钙蛋白水解酶(Calpain)活性测定
取约30mg肌组织以1:10(W/V)加入匀浆缓冲液 LSB(2mM EDTA,2mM EGTA,1mM DTT,1mM PMSF,20mM pH7.4Tris)匀浆匀浆液低温离心,20000rpm,12min取上清液上清液加入固体硫酸铵,成65%饱和液,用Tris碱调pH为7.4上清液低温中放置45min,不停搅动低温离心,20000rpm,12min弃上清,沉淀重新悬浮于LSB中(初始肌肉质量的0.5倍体积)装入透析袋悬于40倍体积LSB的烧杯中,透析24h,间隔2h换液,共换4次蛋白悬浮液1:1加入反应液(2mg/ml casein,5mM DTT,20mM pH7.4Tris,5mM CaCl2)37℃水浴,30min等体积冰三氯乙酸(5%)终止反应常温离心,4000rpm,10min取上清液用紫外分光光度计280nm测吸光度。
1.2.5 主要实验试剂
Bax鼠单克隆抗体IgG(BA0315)、Bcl-2鼠单克隆抗体IgG(BA0412)、TUNEL试剂盒均购自武汉博士德生物工程有限公司,鼠抗骨骼肌肌球蛋白单克隆抗体(Code No.MAB -0124,Maixin Bio Co),工作液稀释度为1:50;Biotin-Goat Anti-Mouse IgG(Code No.SP KIT-C4,Maixin Bio Co),其他试剂购自南京建成生物技术有限公司。
1.3 实验结果统计分析
实验结果用“平均数±标准差”表示,用SPSS for Windows 12统计软件对所有数据进行统计处理。运用T-test进行各组间数据的比较分析,以P<0.05表示显著差异。
2 实验结果
2.1 停训后大鼠口服扇贝肽饮料后骨骼肌形态指标的变化
本实验光镜下观测腓肠肌组织HE切片,发现停训后大鼠补充安慰剂(B2)组处置侧骨骼肌细胞直径减小,多角形状消失,细胞间隙增大,符合萎缩肌细胞的形态学特征,说明大鼠制动模拟停训即可建立骨骼肌萎缩的大鼠模型。补充牛乳(B3)组大鼠腓肠肌细胞形态多角形态尚未完全恢复,细胞间隙比A组和B1组增大,比B2组减小,虽然呈现萎缩的形态学改变,但比B2组略有减轻的趋势改变。而补充扇贝寡肽(B1)组大鼠腓肠肌细胞形态与B2、B3比较,基本恢复正常(A)组的多角形态特征,但细胞间隙恢复未见显著变化,说明补充扇贝寡肽可明显促进萎缩骨骼肌细胞形态的恢复。
如表1所示,本实验发现,与A组比较,B1、B2、B3组大鼠腓肠肌湿重比分别减低了9.9%(P>0.05)、35.2%(P<0.05)、28.9%(P<0.05);与 B2组比较,A、B1、B3组大鼠腓肠肌湿重比分别增加了54.4%(P<0.05)、39.1%(P <0.05)、9.8%(P >0.05);与 B3组比较,A、B1、B2组大鼠腓肠肌湿重比分别增加了40.7%(P<0.05)、26.7%(P<0.05)、-8.9%(P>0.05)。与A组比较,B1、B2、B3组大鼠腓肠纤维直径分别减小 13.2%(P<0.05)、39.7%(P<0.05)、30.1%(P<0.05);与 B2组比较,A、B1、B3组大鼠腓肠肌纤维直径分别增加65.9%(P<0.05)、43.9%(P<0.05)、15.9%(P <0.05);与 B3 组比较,A、B1、B2组大鼠腓肠肌纤维直径分别增加43.2%(P<0.05)、24.2%(P<0.05)、-13.7%(P>0.05)。与 A组比较,B1、B2、B3组大鼠腓肠纤维截面积分别减小17.8%(P <0.05)、46.8%(P <0.05)、44.3%(P <0.05);与B2组比较,A、B1、B3组大鼠腓肠肌纤维截面积分别增加87.9%(P<0.05)、54.6%(P<0.05)、4.7%(P>0.05);与B3组比较,A、B1、B2组大鼠腓肠肌纤维截面积分别增加79.5%(P<0.05)、47.6%(P<0.05)、-4.5%(P>0.05)。
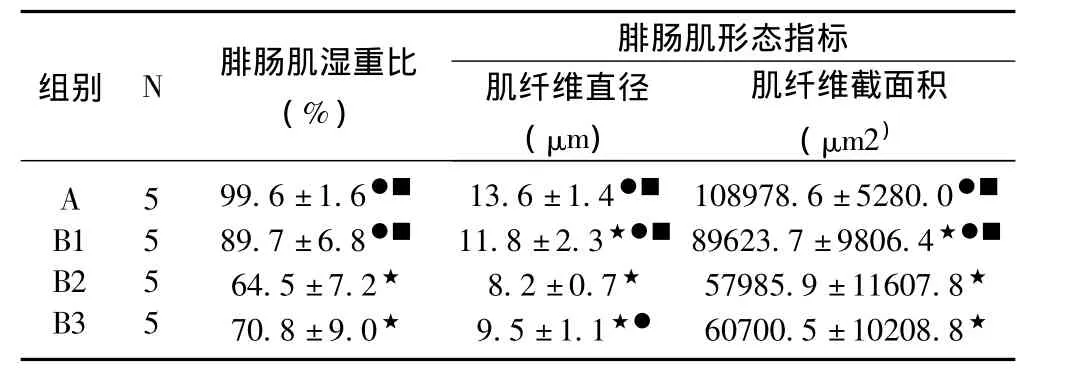
表1 各组大鼠腓肠肌湿重和形态指标的比较
以上结果表明,实验组大鼠口服扇贝寡肽3周后,大鼠腓肠肌质量的损失显著减少,萎缩肌肉的形态学变化得到改善。
2.2 补充扇贝肽对停训后大鼠骨骼肌凋亡细胞指数的影响
如表2、图1~4所示,本实验发现,A组大鼠腓肠肌组织切片凋亡细胞核TUNEL阴性,与A组比均有显著差异。与B2组比较,B1、B3组AI平均分别减低92.0%(P<0.05)和73.2%(P<0.05);与 B3组比较,B1组AI平均减低74.0%(P<0.05)、B2组AI平均则增加3.3倍(P<0.05);与B2组比较,B1、B3组凋亡细胞OD值分别减低7.5倍(P<0.05)、2.4倍(P<0.05),与B3组比较,B1组凋亡细胞OD值减低3.1倍(P<0.05)、B2组凋亡细胞OD值则增加2.4倍(P<0.05)。说明骨骼肌废用性萎缩过程中,骨骼肌细胞凋亡指数明显增加,而补充扇贝寡肽可显著减低骨骼肌细胞凋亡指数。
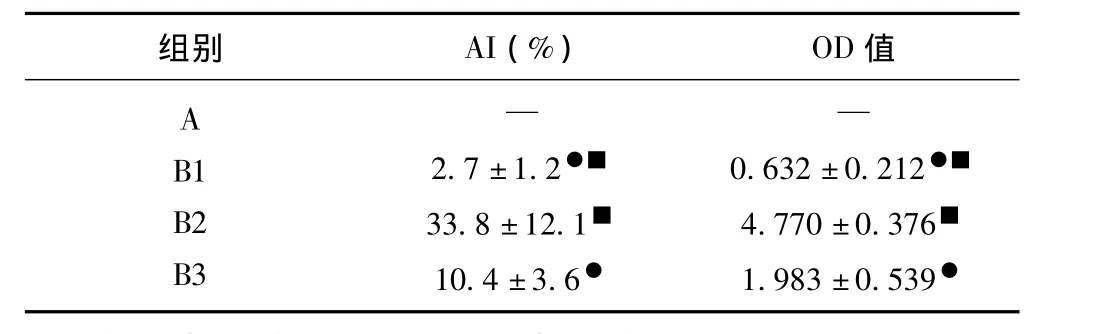
表2 各组大鼠腓肠肌凋亡细胞的比较

图1 A组腓肠肌组织TUNEL染色(横切,40×)

图2 B1组腓肠肌组织TUNEL染色(横切,40×)

图3 B2组腓肠肌组织TUNEL染色(横切,40×)
图4 B3组腓肠肌组织TUNEL染色(横切,40×)
2.3 补充扇贝肽对停训后大鼠骨骼肌凋亡蛋白Bax和Bcl-2的影响
如表3所示,本实验发现,与A组比较,B1、B2、B3组大鼠腓肠肌凋亡蛋白Bax光密度值分别增加6.3倍(P<0.05)、46.2倍(P<0.05)、19.2倍(P<0.05);而Bcl-2光密度值分别增加19.4倍(P<0.05)、1.5倍(P<0.05)、7.9倍(P<0.05);Bax/Bcl-2比值分别增加0.3倍(P>0.05)、30.6倍(P<0.05)、2.4倍(P<0.05)。与B2组比较,B1、B3组大鼠腓肠肌凋亡蛋白Bax光密度值分别分别减低7.3倍(P<0.05)、2.4倍(P<0.05);而Bcl-2光密度值分别增加12.8倍(P<0.05)、5.2倍(P<0.05);Bax/Bcl-2比值分别减低94.0倍(P<0.05)、12.5倍(P<0.05)。与B3组比较,B1、B2组大鼠腓肠肌凋亡蛋白Bax光密度值分别分别增加0.3倍(P>0.05)、2.4倍(P<0.05);而Bcl-2光密度值分别增加2.5倍(P<0.05)、0.2倍(P>0.05);Bax/Bcl-2比值分别增加0.1倍(P>0.05)、12.5倍(P<0.05)。说明骨骼肌萎缩过程中凋亡蛋白Bax表达明显增加、Bcl-2表达明显减低,Bax/Bcl-2比值显著增加;而补充扇贝寡肽后明显抑制Bax蛋白的表达,促进Bcl-2蛋白的表达。
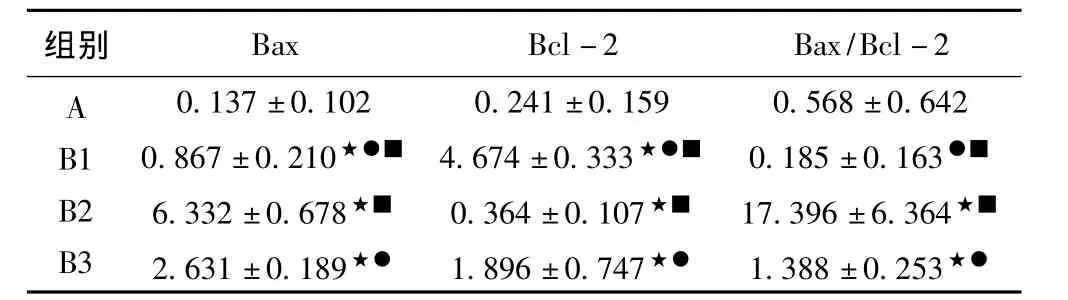
表3 各组大鼠腓肠肌凋亡蛋白Bax和Bcl-2表达的比较(OD值)
2.4 补充扇贝肽对停训后大鼠骨骼肌细胞Calpain总活性及肌球蛋白表达的影响
如表3所示,本实验发现,与A组比较,B1、B2、B3组大鼠腓肠肌肌球蛋白OD值分别减少14.29%(P<0.05)、42.86%(P <0.05)、33.93%(P <0.05),Calpain总活性分别增加12.16%(P<0.05)、155.41%(P<0.05)、112.16%(P<0.05)。与 B2 组比较,B1、B3组大鼠腓肠肌肌球蛋白OD值分别增加50.00%(P<0.05)、15.63%(P <0.05),Calpain活性分别减低56.08%(P<0.05)、16.93%(P<0.05)。与 B3组比较,B1组大鼠腓肠肌肌球蛋白OD值增加29.73%(P<0.05)、Calpain活性减低47.13%(P<0.05),B2组肌球蛋白OD值减低13.51%(P<0.05)、Calpain活性增加20.38%(P<0.05)。以上结果表明大鼠制动致腓肠肌发生萎缩后,肌细胞内钙水解蛋白酶的活性明显增加,肌球蛋白表达量显著减低,而大鼠口服扇贝寡肽饮料3周后肌细胞内钙水解蛋白酶的活性被抑制,从而肌球蛋白水解减少。

表4 各组大鼠腓肠肌Calpain总活性及肌球蛋白表达的比较
3 分析与讨论
从文献看,有关骨骼肌废用性萎缩发生的机制与调控研究目前十分活跃,但报道的研究结果尚未一致。较为一致的结论认为萎缩肌肉蛋白质分解代谢增加、合成代谢减少,而调节蛋白质代谢的细胞信号通路尚未清楚。有研究报道与氧化应激相关的细胞信号通路,导致骨骼肌蛋白质的损失[3,4]。Allen 等[5]研究发现大鼠骨骼肌萎缩过程中,肌细胞的确发生程序性死亡。因此,有关骨骼肌废用性萎缩机制研究结果的不确定影响运动员停训后肌萎缩的治疗。
关于研究废用性肌肉萎缩的实验动物模型很多,文献报道比较多见的模型有大鼠吊尾模型、制动模型、去神经肌肉模型等,其中以固定动物肢体制动为研究废用性肌萎缩的实验动物模型方法简单,操作方便,损伤较小,而且效果可靠,目前已广泛地应用于废用性肌萎缩的研究。本研究采用石膏固定大鼠左侧后肢3周造停训模型,结果发现停训后大鼠补充安慰剂组处置侧骨骼肌细胞直径减小,多角形状消失,细胞间隙增大,符合萎缩肌细胞的形态学特征,而且试验中发现大鼠萎缩腓肠肌湿重比、纤维直径和截面积均显著减低(P<0.05),说明制动3周后骨骼肌即产生废用性萎缩,本实验所造动物模型可以实现本研究目的。
Kerr等[6]研究发现,机体细胞死亡存在两种形式,一种为细胞坏死(necrosis),另一种为程序性细胞死亡(programmed cell death,PCD)。所谓程序性细胞死亡是指细胞在一定的生理或病理条件下,遵循自身的程序,自己结束其生命的生理性死亡。这种细胞死亡现在普遍称之为细胞凋亡(Apoptosis)。尽管细胞凋亡的机制目前尚未完全清楚,但是,凋亡过多或过少均可引发一些病理过程,并与许多疾病的发生、发展密切相关。
细胞凋亡的调节机制十分复杂,是受基因调控的精确过程,这些调节基因包括Caspase家族、BcL-2家族、P53基因、C -myc、NF-κB、FasL/Fas途径及TNF/TNFR途径等,其中Bcl-2蛋白家族成员在细胞凋亡中发挥重要作用。通常,Bcl-2家族分为两类,一类Bcl-2家族是发挥抗凋亡作用的蛋白质,如Bcl-2、Bcl- XL、Bcl- W、Mcl-1(myeloid cell leukemia-1)、CED9等;而另一类Bcl-2家族是促进细胞死亡的蛋白质,如 Bax、Bak、Bcl- XS、Bad、Bik、Bid 等。Bcl-2和Bax作为功能基因则在细胞凋亡过程中起关键作用,因此,有研究报道细胞凋亡的调控与Bcl-2和Bax蛋白水平高低存在相关[7]。
本研究发现骨骼肌废用性萎缩过程中,骨骼肌细胞凋亡指数明显增加,凋亡蛋白Bax表达明显增加,Bcl-2表达明显减低,Bax/Bcl-2比值显著增加。该结果表明细胞凋亡基因Bax、Bcl-2参与大鼠停训后骨骼肌废用性萎缩的调节过程。支持本实验结果的有Schmalbruch研究[8]发现肌萎缩时有NK细胞和巨噬细胞聚集,肌肉细胞凋亡现象伴随NK细胞而发生。有研究报道,后肢悬吊大鼠肌肉萎缩过程中,肌肉细胞出现程序性死亡[5]。Tews等[9]研究发现大鼠肌肉细胞的存活与肌细胞表达Bcl-2相关,同时,肌细胞表达Bcl-2可对抗bax的作用。随后Tews研究证实骨骼肌萎缩机制中细胞凋亡产生重要作用[10]。汪宝军等[11]研究发现,失神经骨骼肌萎缩与肌细胞凋亡有关,Fas基因的表达水平升高,Bcl-2的表达量减少在骨骼肌细胞凋亡的机制中发挥重要作用。王东等的研究有相同的发现[12]。
Calpains是广泛存在于机体细胞质中的Ca2+依赖性中性蛋白酶,可被去负荷、不同浓度的Ca2+激活。Calpain家族的底物众多,包括多种骨骼肌结构蛋白和参与细胞内信号转导的激酶及磷酸化酶等功能蛋白,在细胞内发挥多种作用如细胞运动、细胞周期调节、基因表达调节及细胞凋亡等。许多因素如细胞膜损伤、氧化应激、缺血、缺氧等,均可引起肌细胞内Ca2+浓度升高,活化 Calpain[13]。本实验发现,萎缩骨骼肌组织Calpain总活性显著增高,骨骼肌收缩蛋白成分之一的肌球蛋白的表达量明显减低,说明在废用性骨骼肌萎缩过程中肌组织中蛋白水解酶Calpain活性增高,而收缩蛋白正是其作用底物,因此,Calpain活化、水解骨骼肌收缩蛋白也是导致废用性骨骼肌萎缩发生的重要机制之一。此外,有研究发现Bcl-2家族中许多成员都是 calpain的底物[14]。因此,在calpain家族与caspase家族之间存在一种交互作用(crosstalk)。但是,Calpains对细胞凋亡调节基因产物的具体调节机制尚不明了,尚需进一步研究。
目前,有关废用性骨骼肌萎缩的治疗主要有运动疗法、物理治疗、药物治疗以及基因治疗。从有关药物治疗的研究文献分析,目前报道主要有使用促蛋白质合成的激素类药物(如生长激素、甲状腺素、类固醇等)[15],IGF -1 以及人参、川芍、丹参、黄茂等活血滋补类中药[11,16]及银杏叶提取物等[17]。但是,使用的促合成类激素、生长激素、IGF-1等治疗肌萎缩对运动员来说是被禁止使用的。而从营养学的角度干预运动员停训后肌萎缩的研究报道尚为鲜见。
扇贝寡肽(scallop peptides,SPs)是从海洋生物栉孔扇贝中提取并经酶解后获得的一种具有生物活性的短肽(Pro-Asn-Ser-Thr-Arg-Hyl-Cys-Gly),具有抗氧化应激损伤作用和细胞免疫调节等作用。寡肽的生物活性与构成肽片段的氨基酸有着密切关系,通常,肽片段中富含 Tye、Trp、Met、Lys、Cys 和 His等氨基酸的寡肽具有较强的抵御自由基攻击的生物活性。而一些含His的寡肽能通过鳌合过渡金属离子起到抵御自由基攻击的作用,现His上有α-氨基、梭基和活性侧链基团咪唑基,α-氨基和梭基与金属离子可形成五元环,α-氨基和咪唑基与金属离子可形成六元环,梭基和咪哇基与金属离子可形成七元环,具有供氢能力的Tyr将氢原子给自由基后,自身形成自由基中间体,借助共振求得稳定,导致自由基链反应减慢或终止。此外,除了构成肽片段的一些特定氨基酸外,寡肽的氨基酸序列、分子量、底物因素等均可影响寡肽的抗氧化活性。
本研究补充扇贝寡肽后可显著减低骨骼肌细胞凋亡指数,明显抑制Bax蛋白的表达,促进Bcl-2蛋白的表达,通过影响肌细胞凋亡过程促进萎缩肌康复。补充扇贝肽可显著减低萎缩骨骼肌细胞Calpain总活性、增加肌球蛋白的表达、显著减低肌肉质量的损失和促进萎缩骨骼肌形态学变化的恢复。分析其原因,可能是具有高生物活性的扇贝肽抑制了调节骨骼肌代谢有关酶的活性如Calpain,从而抑制肌肉蛋白质分解代谢、促进合成代谢。可能通过影响骨骼肌细胞凋亡过程干预骨骼肌废用性萎缩的发生和发展。张海祥研究[18]观察三种营养补剂(氯化胆碱、氯化胆碱+复合维生素以及胞磷胆碱)对后肢去负荷大鼠比目鱼肌形态与功能的影响,发现后肢去负荷能导致骨骼肌在肌肉形态、肌纤维类型和肌肉功能等方面发生明显的废用性萎缩,补充一定剂量的营养补剂后可以减缓这种肌萎缩的发生发展,尤其以氯化胆碱的效果较为突出。韩春山研究[19]报道补充扇贝肽可有效地保护线粒体膜,稳定线粒体膜电位,进而抑制活性氧的产生,降低胞浆游离钙浓度,上调Bcl-2蛋白表达,下调Bax蛋白的表达,拮抗60Co辐射诱导的淋巴细胞凋亡。
海洋生物蛋白质因其多肽链的一级结构与陆地生物蛋白质存在很大的差异。同时,海洋生物蛋白质的种类和数量都远远大于陆地蛋白质。因此,种类繁多的海洋生物蛋白质在其多肽链中,可能存在着许多具有生物活性的肽片段。随着对扇贝寡肽研究的不断深入,其生物活性和生理、药理功效将逐渐明确,并可能成为研究开发治疗骨骼肌废用性萎缩的海洋药物资源。
4 小结
在本实验中,固定大鼠左侧后肢3周后可导致骨骼肌废用性萎缩,废用性肌萎缩的发生、发展与Cal-pain活性升高、水解骨骼肌收缩蛋白有关,而且,骨骼肌细胞凋亡增加在废用性肌萎缩的发生发展过程中产生重要作用。而补充扇贝寡肽可显著减低骨骼肌细胞凋亡指数,明显抑制骨骼肌Bax蛋白的表达、促进Bcl-2蛋白的表达,抑制Calpain活性,减少收缩蛋白的降解,维持肌球蛋白结构的完整,从而干预肌萎缩的进程。
[1]Mujika I,Padilla S.Muscular characteristics of dertraining in humans[J].Med Sci Sports Exerc,2001,33(8):1297 -1303
[2] Garcia - Pallares J,Sanchez - Medina L,Perez CE,et al.Physiological Effects of Tapering and Detraining in World- Class Kayakers[J].Med.Sci.Sports Exerc.,2010,42(6):1209-1214
[3]Powers SK,Kavazis AN,McClung JM.Oxidative stress and disuse muscle atrophy[J].J.Appl.Physiol,2007,102(6):2389-2397
[4]Andrianjafiniony T,Dapre-Aucouturier S,Letexier D,Oxidative stress,apoptosis,and proteolysis in skeletal muscle repair after unloading Am.J.Physiol.Cell Physiol.,2010 ,299:C307-C315
[5]Allen DL,Lindenna JK,Roy RR,et al.Apoptosis:a mechanism contributing to remodeling of skeletal muscle in response to hindlimb unwight[J].Am.J.Physiol.1997,273:c579 - 587
[6]Kerr JF,Wyllie AH,Currie AR.Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics[J].Br JCancer1972 Aug;26(4):239 - 57
[7]Neuzil J,Wang XF,Dong LF,et al.Molecular mechanism of mitocan-induced apoptosis in cancer cells epitomizes the multiple roles of reactive oxygen species and Bcl-2 family proteins[J].FEBSLett,2006,580(22):5125 - 5129
[8]Schmalbrueh H.Natural killer cells and maerophages in immature denervated rat museles[J].J Neurolpatho Exp Neurol,1996,55(3):310 -317
[9]Tews DS,Goebel HH,Sehneider I,et al.DNA - fragmentation and expression of apoptosis-related Proteins in experimentally denervated and reinnervated rat facial musele[J].Neuropathol Appl Neurobiol,1997,23(2):141 -146
[10]Tews DS.Muscle-fiber apoptosis in neuromuscular diseases[J].Muscle Nerve,2005,32(4):443 -458
[11]汪宝军,王竹风,王和鸣.复方太子参颗粒对失神经支配骨骼肌萎缩细胞凋亡的影响[J].中国中医骨伤科杂志,2007,15(4):26 -29
[12]王东,余斌,朱杰,等.肝细胞生长因子对后肢固定大鼠腓肠肌细胞凋亡的影响[J].西北国防医学杂志,2006,27(4):285-289
[13]张勇,朱宇旌.钙蛋白酶系统与相关信号途径对肌肉组织降解的调控[J].安徽农业科学,2007,35(36):11853-11855
[14]Gil Parrado S,Fernandez Montalvan A,Assfalg Machleidt I,et al.Ionomycin activated calpain triggers apoptosis.A probable role for Bcl-2 family members[J].J Biol Chem,2002,277(30):27217-27226
[15]Ilina-Kakueva EI,Dynamics of soleus muscle recovery from the suspension - induced atrophy in rat[J].Aviakosm Ekolog Med,2005,39(2):38 -41
[16]Gao YF,Fan XL,He ZX,et al.Affects of ligustrazine and radix astragali on activities of myosin adenosine triphosphatase of soleus muscle and muscle atrophy in tail- suspended rat[J].Space Medicine & Medical Engineering,2005a,18(4):262 -266
[17]黄智,余斌,朱杰,等.银杏叶提取物EGb761对后肢固定大鼠腓肠肌收缩功能的影响[J].中华创伤骨科杂志,2005,7(12):1157 -1160
[18]张海祥.三种营养补剂对后肢去负荷大鼠比目鱼肌形态和功能影响的研究[D].西安:西北大学硕士学位论文,2007
[19]韩春山.扇贝多肽对60Coγ射线辐射损伤小鼠胸腺淋巴细胞的保护机制研究[D].青岛:青岛大学硕士学位论文,2004

