电针预处理对肢体缺血再灌注大鼠生存、脑损伤及认知功能的影响*
陈 烨, 周 军, 袁婉丽, 莫利群, 胡节惠
(泸州医学院附属医院 1中医科,2麻醉科,四川泸州646000)
肢体缺血再灌注(limb ischemia/reperfusion,LI/R)是临床常见的病理现象,可由断肢再植、严重的肢体挤压伤等因素引起。尽管为了挽救缺血肢体,恢复其血液循环是必须的,但研究表明肢体I/R可诱发肝、肺、肠及脑等器官损伤,从而诱发多器官衰竭(multiple organ failure,MOF),最终导致死亡[1-4],病死率极高,而且其发病机制迄今尚未完全阐明。小胶质细胞是中枢先天性免疫细胞,在正常的大脑中,小胶质细胞是静止的,起着支持、保护、营养、免疫和修复等作用。但当小胶质细胞被内毒素、脑损伤等因素刺激后,能从静止态变为激活态,成为阿米巴样小胶质细胞,释放活性氧(reactive oxygen species,ROS)等神经细胞毒性物质。随之小胶质细胞能保持一种长期活化的状态,产生反应性小胶质细胞循环,导致神经元损伤[5]。肢体I/R能诱发动物小胶质细胞激活及神经细胞凋亡,但能否导致认知功能障碍尚未见报道。此外,电针预处理对器官直接缺血再灌注损伤有防治作用[6-7],但是否对肢体I/R导致的脑损伤具有保护作用还不完全清楚,本实验旨在观察肢体I/R对大鼠生存率和认知功能的影响及电针预处理保护作用及相关机制。
材料和方法
1 材料
1.1 动物 清洁级、健康成年雄性SD大鼠132只,体重255~300 g,由泸州医学院动物中心提供,术前禁食12 h,自由饮水。
1.2 主要药品、试剂和仪器 多抗rabbit-anti-Iba1(Wako Pure Chemicals),多抗 rabbit-anti-cleaved caspase-3(CST),TUNEL 试剂盒(Roche),大鼠 ROS、超氧化物歧化酶(superoxide dismutase,SOD)、髓过氧化物酶(myeloperoxidase,MPO)及丙二醛(malondialdehyde,MDA)试剂盒均由南京建成生物工程研究所提供。UV751GD紫外可见光分光光度计(上海精密科学仪器有限公司),Sunrise酶标仪(Tecan),Morris水迷宫测试系统(上海吉量软件科技有限公司)。DP70数码相机Viewfinder 4.0图像采集系统(Olympus)。
2 方法
2.1 动物模型 参照既往文献[3]的方法制备肢体缺血再灌注模型。10%水合氯醛30 mg/kg腹腔注射麻醉大鼠,双股三角处切开皮肤,分离股动脉,用无创微动脉夹于近腹股沟韧带处夹闭股动脉3 h,再灌注48 h。
2.2 实验分组 132只大鼠随机分为3组(n=44):假手术(sham)组:给予同样的麻醉和操作,但只分离暴露股动脉而不夹闭,不造成肢体缺血;肢体缺血再灌注(LI/R)组:夹闭股动脉3 h,再灌注48 h;肢体缺血再灌注+电针预处理(LI/R+EA)组:建立模型前14 d开始,连续行电针治疗,穴位定位参照文献[8],选取百会、足三里及血海,1 d 2次。观察术后7 d内的生存情况(每组20只);每组另取8只大鼠,术前经历Morris水迷宫训练6 d后,在再灌注48 h进行水迷宫测试。于再灌注48 h时,每组另取16只大鼠处死,其中8只用于脑水肿、氧化应激及Western blotting检测,另外8只用于免疫组织化学等形态学指标观察。如有术前测试异常或术后未到观察时点死亡,则排除本研究,重新补足动物。
2.3 Morris水迷宫实验 各组大鼠均在术前连续6 d开始Morris水迷宫训练。(1)定位航行实验(place navigation)选择一个象限的固定位置将大鼠置入水中,以入水起至找到平台的时间为潜伏期,如120 s内未找到平台,引导其登上站台适应10 s,则潜伏期记为120 s。其总行程为游泳距离,计算游泳速度,以评判大鼠的空间学习能力。每天测试4次,启动监测装置,观察并记录动物找寻平台所需时间、游过的距离及游泳速度,取其平均值。(2)空间搜索实验(spatial probe test)每天第4次训练后撤除平台,然后在原入水点将大鼠面向池壁放入水中,测其在120 s内跨过原平台所在位置的次数,以评判大鼠的空间记忆能力。测试结束后即行手术。于再灌注后48 h再次行Morris水迷宫测试,取上述指标平均值。
2.4 海马形态学观察 脑组织固定24 h后,经梯度蔗糖脱水后,行冰冻切片制成30 μm厚的冠状面切片,苏木精 -伊红(HE)染色,400倍光学显微镜(Olympus)下观察海马CA1区病理结构并拍照,并计算正常神经细胞数。
2.5 脑水肿测定 在手术显微镜观察下,取出部分海马组织,迅速吸尽表面水分,称取湿重后放入105℃恒温烤箱中烘烤48 h后称取干重,计算脑组织含水量。含水率(%)=(湿重-干重)/湿重×100%。
2.6 ROS、MDA含量和MPO、SOD活性测定 取少量海马组织,在冰浴中研碎,根据湿重补充加入生理盐水制成10%组织匀浆,采用DCF法测定ROS含量,硫代巴比妥酸法测定MDA含量,黄嘌呤氧化酶法测定SOD活性,髓过氧化物酶法测定MPO活性,具体操作步骤参照说明书及作者既往文献[9]。
2.7 小胶质细胞标志物Iba1测定 采用免疫组织化学法测定海马CA1区Iba1表达。冰冻切片加用相应Ⅰ抗Iba1,4℃过夜孵育。洗涤后,滴加相应Ⅱ抗,37℃水浴箱孵育30 min。洗涤后,DAB显色,常规脱水、透明、封片,显微镜下观察。
2.8 Cleaved caspase-3蛋白表达的测定 采用Western blotting法分析海马CA1区中促凋亡蛋白cleaved caspase-3的表达水平。取少量海马组织,提取蛋白及定量,凝胶电泳后转膜,兔抗 cleaved caspase-3多克隆I抗1∶1 000稀释4℃下孵育过夜。然后使用辣根过氧化物酶(HRP)标记的山羊抗兔IgG(1∶10 000)II抗室温孵育1 h。ECL发光液显色,暗室内用胶片压片曝光,显影。使用ImageJ软件进行实验结果图像处理,测定灰度值。将同一张蛋白印迹膜曝光后,使用0.5%SDS洗脱抗体,加入βactin进行孵育杂交以作为内参照。
2.9 海马细胞凋亡的观察 采用TUNEL法分析海马CA1区细胞凋亡情况,37℃ proteinase K消化10 min,加入TdT反应液37℃孵育90 min,加入TB缓冲液室温15 min终止反应;HRP标记的链霉卵白素工作液孵育37℃ 1 h后,DAB显色,苏木素复染,显微镜下观察。细胞核中有棕黄色颗粒者为阳性细胞。400倍光镜下随机选取不重叠的5个视野,计数阳性细胞,计算凋亡指数。凋亡指数(%)=TUNEL阳性细胞数/细胞总数×100%。
2.10 动物存活时间的观察 大鼠自由进食、饮水,观察各组大鼠再灌注7 d的生存率。
3 统计学处理
数据以均数 ±标准差(mean±SD)表示,采用SPSS 16.0统计分析软件,组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t检验。生存率的比较采用log-rank检验。以P<0.05为差异有统计学意义。
结 果
1 海马组织形态学观察
光镜下见sham组大脑海马层次结构清晰,神经元排列齐、致密,胞核无固缩、变形,胞浆无水肿。LI/R组海马组织损伤明显,胞核固化、深染、溶解或消失,胞浆嗜酸性变,神经细胞形态不规则;LI/R+EA组损伤较轻,大部分神经元结构基本正常,少数神经元胞核固缩,胞浆水肿。LI/R组及LI/R+EA组正常神经元计数均低于sham组(P<0.05或P<0.01);LI/R+EA 组高于 LI/R 组(P <0.05),见图1。
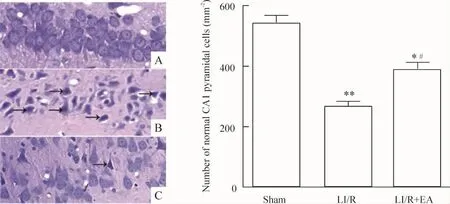
Figure 1.Histology of hippocampal CA1 region(HE staining,×400).Arrows indicate injured neurons.A:sham;B:LI/R;C:LI/R+EA.Mean ±SD.n=8.*P <0.05,**P <0.01 vs sham group;#P <0.05 vs LI/R group.图1 各组光镜下海马形态学的变化
2 海马cleaved caspase-3蛋白表达的变化
与sham组比较,LI/R组及LI/R+EA组海马cleavedcaspase-3蛋白表达均显著增高(P<0.05或P<0.01)。与LI/R组比较,LI/R+EA组caspase-3蛋白表达量显著降低,差异显著(P<0.01),见图2。
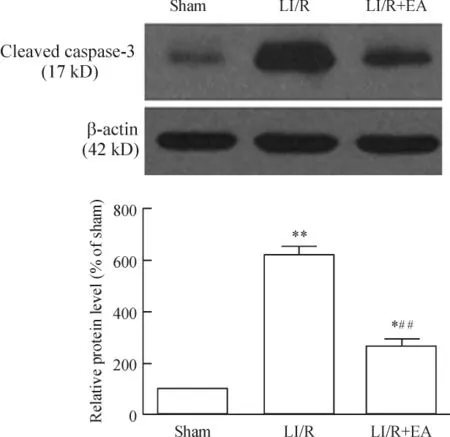
Figure 2.Expression of cleaved caspase-3 in hippocampus of rats.Mean ± SD.n=8.*P < 0.05,** P < 0.01 vs sham group;##P <0.01 vs LI/R group.图2 各组海马cleaved caspase-3蛋白的表达
3 凋亡指数的比较
TUNEL法检测海马细胞凋亡情况发现,sham组海马几乎未见TUNEL阳性细胞;LI/R组凋亡阳性细胞数量明显增加;LI/R+EA组凋亡细胞数量明显减少。与sham组比较,LI/R及LI/R+EA组细胞凋亡指数均显著升高(P<0.01);与LI/R组比较,LI/R+EA组细胞凋亡指数降低(P<0.01),见图3。
4 脑组织含水量
LI/R及LI/R+EA组均高于sham组(P<0.05或P<0.01),LI/R+EA组低于 LI/R组(P<0.01),见图4。
5 小胶质细胞表达
Sham组大鼠海马组织Iba1只有少量弱表达,LI/R组48 h时Iba1阳性表达增加,与sham组比较,差异有统计学意义 (P<0.05或P<0.01);与LI/R组比较,LI/R+EA组Iba1阳性细胞数减少,差异有统计学意义(P <0.01),见图5。
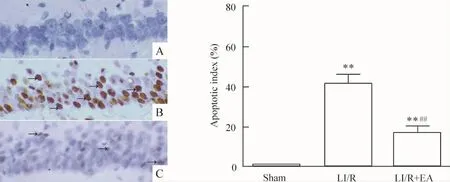
Figure 3.Neuronal apoptosis(TUNEL staining,×400).TUNEL-positive cells(containing dark brown-stained nuclei)in the hippocampal CA1 region are indicated by arrows.A:sham;B:LI/R;C:LI/R+EA.Mean±SD.n=8.**P <0.01 vs sham group;##P <0.01 vs LI/R group.图3 各组光镜下海马神经细胞凋亡情况
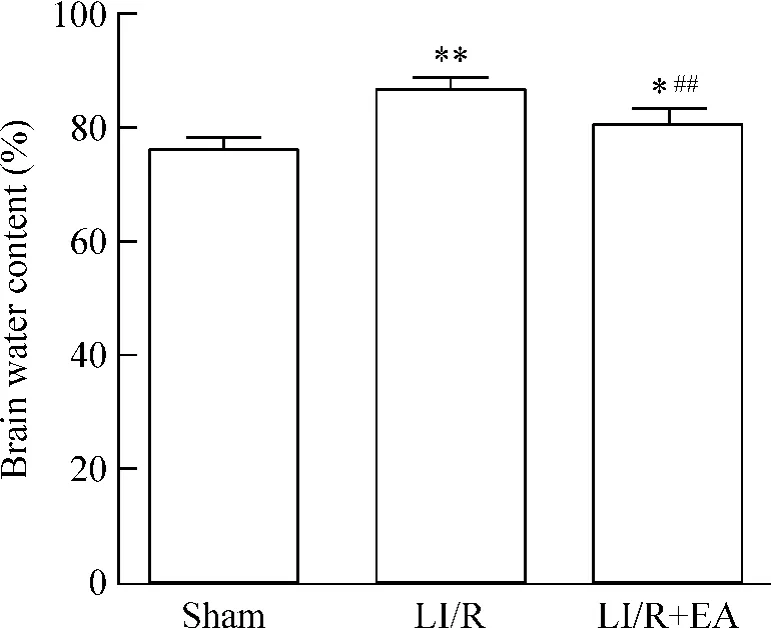
Figure 4.Brain water content in hippocampus among the threegroups 48 h after LI/R.Mean ± SD.n=8.*P <0.05,**P<0.01 vs sham group;##P <0.01 vs LI/R group.图4 各组大鼠脑含水量的比较
6 海马ROS、MDA含量及MPO、SOD活性变化
与sham组比较,LI/R及 LI/R+EA组 ROS、MDA含量及MPO活性增加,SOD活性减少,差异具有统计学意义(P<0.05或P<0.01)。与LI/R组比较,LI/R+EA组ROS、MDA含量及MPO活性降低,SOD活性增加,差异有统计学意义(P<0.01),见图6。
7 Morris水迷宫测试结果
与sham组比较,LI/R组及LI/R+EA组潜伏期及游泳距离延长,穿越平台次数减少,差异有统计学意义(P <0.05或P <0.01)。与 LI/R 组比较,LI/R+EA组潜伏期和游泳距离缩短,穿越平台次数增加,差异有统计学意义(P<0.01),见图7。
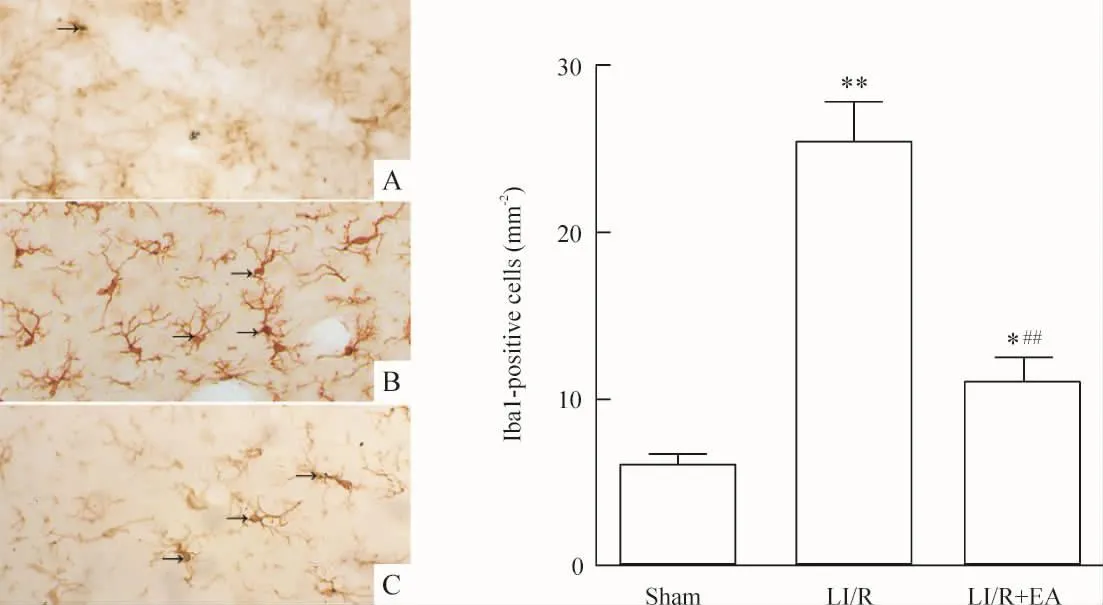
Figure 5.Immunohistochemistry demonstrating microglia in the hippocampal CA1 region(ABC staining,×400).Iba1-immunopositive microglia are darkly stained and indicated by arrows in representative micrographs from sham(A),LI/R(B),and LI/R+EA(C)groups.Mean ±SD.n=8.*P <0.05,**P <0.01 vs sham group;##P <0.01 vs LI/R group.图5 各组光镜下海马小胶质细胞变化情况
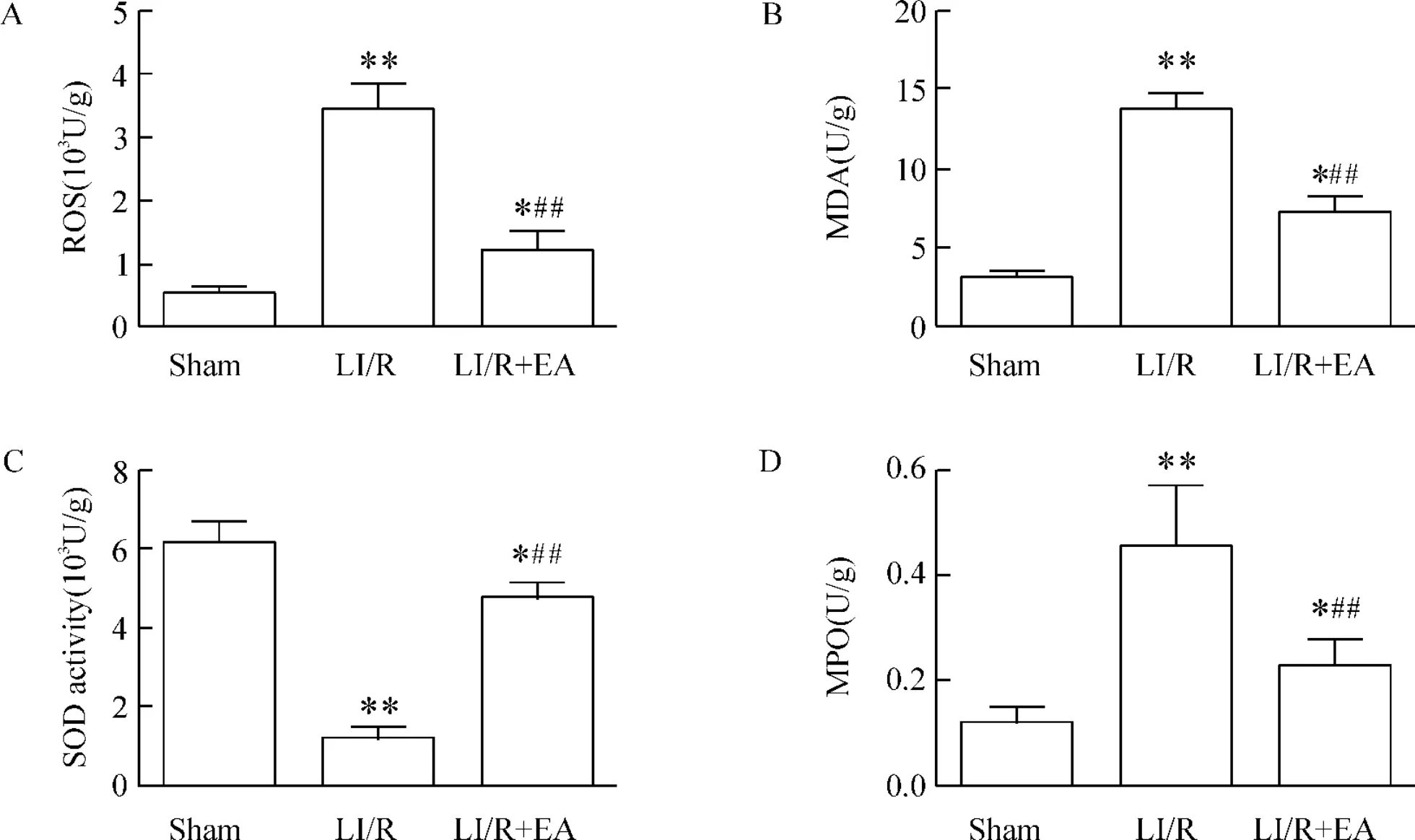
Figure 6.Changes of reactive oxygen species(ROS;A),malondialdehyde(MDA;B),myeloperoxidase(MPO;C)and superoxide dismutase(SOD;D)in rat hippocampus at 48 h after LI/R.Mean±SD.n=8.*P <0.05,**P <0.01 vs sham group;##P <0.01 vs LI/R group.图6 各组大鼠海马ROS、MDA含量及MPO、SOD活性的比较
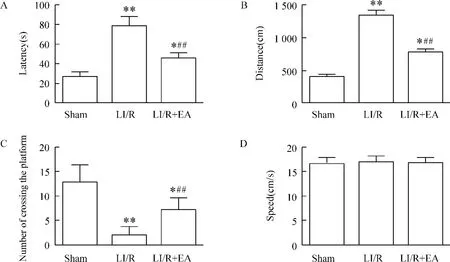
Figure 7.Latency to the platform(A),swimming distance to platform(B),the number of crossing the platform(C)and swimming speed(D)throughout the experiments.Mean ± SD.n=8.*P <0.05,**P <0.01 vs sham group;##P <0.01 vs LI/R group.图7 各组大鼠Morris水迷宫测试参数的比较
8 生存率比较
Sham组7 d内无大鼠死亡,生存率为100%;LI/R大鼠于模型后7 d生存率为40%;电针预处理治疗明显提高LI/R大鼠的生存率,7 d生存率为80%(P <0.05 或 P <0.01),见图8。
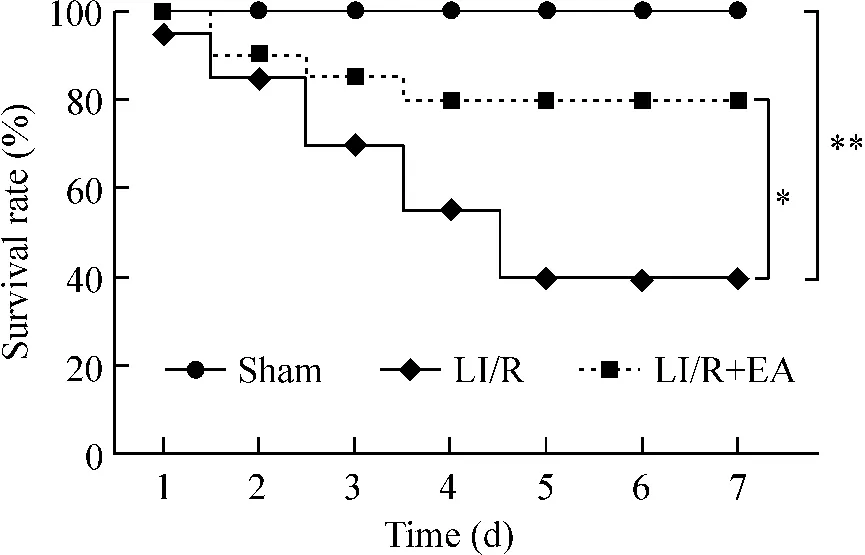
Figure 8.Effects of electroacupuncture on survival rates of the rats after LI/R among the three experimental groups.n=20.*P <0.05,**P <0.01.图8 电针对肢体缺血再灌注后大鼠生存率的影响
讨 论
本研究成功复制了阻断大鼠双后肢3 h,再灌注48 h的肢体I/R损伤模型,光镜下可见肢体I/R组海马组织结构不清,神经细胞体积缩小,核固缩深染,胞浆嗜伊红,同时正常神经元计数减少,提示海马组织损伤严重;上述结果与既往研究[3]结果一致。同时本研究也证实肢体I/R能导致大鼠生存率下降及出现长期的认知功能障碍,而电针预处理能改善上述异常变化,这表明电针对肢体I/R导致的脑损伤及认知功能障碍有很大的临床治疗价值。
有大量研究[10-11]表明上述危重病患者即使经治疗存活下来,但因脑损伤而发生长期性的记忆、认知功能障碍的风险极大,严重影响患者的生活能力。与假手术组相比,肢体I/R大鼠需要较长的平均逃避潜伏期和游泳距离,才能达到隐藏的平台。3组之间游泳速度没有差异,表明肢体I/R能导致大鼠出现认知功能障碍,但并不是由于损害大鼠的运动能力而造成的。然而,与肢体I/R组比较,电针预处理组大鼠找到平台的潜伏期及游泳距离更短,在原平台所在象限停留时间及跨过原平台位置次数增加。值得一提的是,电针预处理组和假手术组水迷宫测试结果差异很小,与组织形态学及其它指标变化不太一致。目前导致该现象的原因还不是很清楚,但有研究报道强制运动能改善学习和记忆能力[12]。因此,我们推测可能是重复水迷宫训练一定程度上提高了学习和记忆能力,加上电针对认知功能障碍的治疗作用,导致了电针预处理组和假手术组之间测试结果差异极小。
肢体I/R导致远隔器官损伤的机制是既复杂而又知之甚少。然而,肢体I/R损伤到大脑可能是氧化应激的结果。由于神经元的高代谢率,中枢神经系统特别容易受到过多生成的 ROS攻击损害[13]。作为主要的中枢神经系统的免疫细胞,小胶质细胞被激活时,能释放ROS等神经毒性物质。既往研究表明脑I/R后发生炎性反应时,中性粒细胞聚集,释放自由基等物质,损伤神经元和胶质细胞,释放促炎性介质和细胞因子,引起更多的中性粒细胞聚集和浸润,加重炎性反应。MPO是中性粒细胞的特征酶,其活性可反映中性粒细胞的聚集程度[14]。另外,MDA是脂质过氧化的降解产物,测定其含量可反映过氧化的程度;而SOD为自由基清除剂,其活力则可反映内源性氧自由基清除能力的高低,因此MDA和SOD可以反映体内自由基的变化情况。本研究发现,给予肢体I/R损伤大鼠电针预处理能减少MPO活性,提示电针预处理对损伤后中性粒细胞浸润为标志的炎症反应有抑制作用。同时还显示,给予电针预处理后,氧化应激指标得到相应改善,MDA减少,SOD活性得到提高,这与作者既往研究得出的两者变化关系一致[15];证实给予电针预处理可增强机体清除自由基的能力,能明显抑制缺血再灌注后脑组织中自由基的产生,降低自由基对细胞膜性结构的破坏,从而发挥药物对脑组织的保护作用。我们初步可以认为电针预处理可以阻止海马小胶质细胞活化,减轻该部位氧化损伤。
总之,目前的研究表明肢体I/R能导致大鼠脑氧化损伤,认知功能障碍及存活率下降。电针预处理可以抑制小胶质细胞激活,减轻氧化应激,从而改善肢体I/R诱发的上述相关影响。这表明,电针预处理作为一种神经保护疗法,在临床中具有很大的实用性。
[1]Yassin MM,Harkin DW,Barros D'Sa AA,et al.Lower limb ischemia-reperfusion injury triggers a systemic inflammatory response and multiple organ dysfunction[J].World J Surg,2002,26(1):115-121.
[2]Peng TC,Jan WC,Tsai PS,et al.Heme oxygenase-1 mediates the protective effects of ischemic preconditioning on mitigating lung injury induced by lower limb ischemiareperfusion in rats[J].J Surg Res,2011,167(2):e245-e253.
[3]史中立,凌亦凌,姚玉霞,等.大鼠肢体缺血再灌注所致脑损伤及其机制探讨[J].中国病理生理杂志,2001,17(5):451-454.
[4]Glantzounis GK,Sheth H,Thompson C,et al.Acute limb ischemia caused by femoral arterial line induces remote liver injury in a rabbit model of liver ischemia/reperfusion injury[J].Angiology,2009,60(5):554-561.
[5]Block ML,Zecca L,Hong JS.Microglia-mediated neurotoxicity:uncovering the molecular mechanisms[J].Nat Rev Neurosci,2007,8(1):57-69.
[6]胡 森,张立俭,白慧颖,等.电针足三里对脓毒症大鼠组织肿瘤坏死因子和多脏器功能损害的影响[J].中国病理生理杂志,2010,26(2):353-356.
[7]曾 毅,熊利泽,陈绍洋,等.重复电针预处理对兔脊髓缺血损伤后热休克蛋白90表达的影响[J].针刺研究,2004,29(4):261-265.
[8]华兴邦,李辞蓉,周浩良,等.大鼠穴位图谱的研制[J].实验动物与动物实验,1991,(1):1-5.
[9]周 军,刘克玄,魏继承,等.肠缺血再灌注对大鼠脑组织小胶质细胞活化的影响[J].中华麻醉学杂志,2012,32(5):559-562.
[10]Hopkins RO,Jackson JC.Long-term neurocognitive function after critical illness[J].Chest,2006,130(3):869-878.
[11]Hopkins RO,Jackson JC.Assessing neurocognitive outcomes after critical illness:are delirium and long-term cognitive impairments related?[J].Curr Opin Crit Care,2006,12(5):388-394.
[12]Ang ET,Dawe GS,Wong PT,et al.Alterations in spatial learning and memory after forced exercise[J].Brain Res,2006,1113:186-193.
[13]Andersen JK.Oxidative stress in neurodegeneration:cause or consequence?[J].Nat Med,2004,10(Suppl):S18-S25.
[14]Wang Q,Tang XN,Yenari MA.The inflammatory response in stroke[J].J Neuroimmunol,2007,184(1-2):53-68.
[15]周 军,陈 烨.电针预处理对兔肝脏缺血再灌注NO、NOS及氧自由基的影响[J].中国针灸,2011,31(2):149-152.

