小鼠心肌微血管内皮细胞的原代培养及生物学特性*
辛 毅,许秀芳,黄益民,张 颖,李温斌,李 娜
(首都医科大学附属北京安贞医院,北京市心肺血管疾病研究所分子生物学研究室,北京100029)
近年来大量研究表明,心肌微血管内皮细胞(myocardial microvascular endothelial cells,MMVECs)的功能和病理改变直接影响心肌细胞功能,也是诸多毒素、炎症因子及病毒等重要靶位[1],其作为体外研究的细胞模型在心肌缺血/再灌注发病机制和细胞间旁分泌细胞生长因子研究中起着重要作用[2]。国内已广泛开展大鼠心肌微血管内皮细胞的培养技术[3-4],而小鼠心肌微血管内皮细胞原代培养技术的研究较少,其难点在于小鼠心肌微血管内皮细胞的分离培养方法要求极高。如何建立一种比较简单、快速有效的方法,尽可能地获得较高活力及存活率的细胞,仍是细胞培养的关键。本研究摸索出一种简便、可靠、稳定的Ⅱ型胶原酶消化分离、经差速贴壁再结合内皮细胞专用培养基、以多聚赖氨酸对培养皿作预包被培养出纯度较高、结构和功能良好的MMVECs的方法,为心血管疾病的体外研究提供了更有效的技术手段和较理想的靶细胞模型,并对其基本生物学特性进行了初步观察,为今后细胞培养起到了一定的指导作用。
材料和方法
1 动物
SPF级C57BL/6乳小鼠,雌雄不限,1~3日龄,体质量1.2~1.5 g,来源于北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2006-009。
2 主要试剂
高糖/DMEM培养基(high glucose/DMEM,HG/DMEM)、胎牛血清(fetal bovine serum,FBS)、青霉素和链霉素均为Gibco产品;内皮细胞专用培养基(endothelial cell medium,ECM)为ScienCell产品;Ⅱ型胶原酶、胰蛋白酶和多聚赖氨酸均为Sigma产品;MTT为Promega产品;波形蛋白(vimentin)兔抗小鼠(Ⅰ抗,Santa Cruz)、兔抗小鼠vWF相关抗原多克隆抗体、兔抗小鼠CD31及CD34多克隆抗体(Ⅰ抗,Santa Cruz);FITC标记的羊抗兔IgG及TRITC标记的羊抗兔IgG(Ⅱ抗,Jacson);细胞培养板、离心管、培养皿等耗材购自Corning。
3 主要方法
3.1 取材 将乳鼠于体积分数75%乙醇缸中浸泡10 s,转移至超净台。将乳鼠固定于左手掌中,右手用无菌棉签沾体积分数75%乙醇消毒胸、腹部皮肤3次。用眼科虹膜剪在剑突处正中线稍偏左向上开胸后,用剪子压住胸骨右缘,使心脏自然跳出,用弯镊子勾住心尖根部,取出心脏,置于盛预冷0.01 mol·L-1磷酸盐缓冲溶液(phosphate buffered solution,PBS)的培养皿中。将鼠心脏全部取出后,剪去心房、剔除心脏上结缔组织、脂肪及血管,于预冷0.01 mol·L-1PBS(含双抗)清洗3次,去除血污。将心脏剪成约1 mm×1 mm×1 mm的组织块,备用。
3.2 MMVECs酶消化分离培养法 将组织碎块放入50 mL离心管中,再加入2 g·L-1Ⅱ型胶原酶消化,消化液体积为心肌组织的10~15倍,同时加入FBS 1 滴,置37 ℃、80 r·min-1水浴摇床消化40 min后,吸管轻轻吹打组织块2 min分散细胞,此时消化液变混浊,大部分组织块变成白色,用吸管吸取细胞悬液放入15 mL离心管中,加入含体积分数10%FBS HG/DMEM终止消化,收获细胞,所有的细胞悬液过200目铜网。
3.3 MMVECs细胞培养 吸取细胞悬液入15 mL离心管,1 000 r·min-1离心5 min,弃上清,细胞沉淀中加入含体积分数10%HG/DMEM 8 mL,吹打均匀后放入100 mm培养皿,置体积分数5%CO2、37℃培养箱中培养,放置60 min差速贴壁,最先贴壁为心肌成纤维细胞,将未贴壁的细胞悬液(含有心肌微血管内皮细胞及心肌细胞)收集到15 mL离心管中,1 000 r·min-1离心5 min,弃上清,加入 ECM 培养基重悬细胞,置于100 mm多聚赖氨酸预包被培养皿中继续培养。
3.4 MMVECs分离纯化及传代培养 在细胞培养中,依据心肌成纤维细胞和心肌微血管内皮细胞贴壁时间不同的原理进行差速分离,心肌成纤维细胞贴壁较早且生长迅速,经过体外长时间的消化及内皮细胞专用培养基的应用,心肌细胞基本死亡。待MMVECs生长到培养皿的50% ~60%时,加入0.01 mol·L-1PBS 洗2 次,用 2.5 g·L-1胰蛋白酶消化,在显微镜下观察消化程度,细胞形态由紧密贴壁椭圆形逐渐变成圆形,加入ECM培养基终止消化,把细胞悬液收集到15 mL离心管中,1 000 r·min-1离心5 min,弃上清,加入ECM培养基1∶3传代。
3.5 MTT测定MMVECs增殖活力 取第1、3、5代处于对数生长期的细胞,以每孔约2×104个细胞等量接种于96孔板中,每孔加入100 μL培养液,置37℃、5%CO2细胞培养箱内孵育。每24 h向其中5孔加入20 μL MTT溶液,置于37℃、5%CO2孵育3 h后,用酶标仪在490 nm波长处测定各孔的吸光度值(A490),每天测5孔,连续测7 d。设立平行对照孔(加入培养液,不加细胞)并调零,测定MMVECs增殖及存活能力。
3.6 生长曲线的测定 取第1、3、5代处于对数生长期的细胞,按2×107/L接种于24孔培养板,每孔接种500 μL。从接种时间算起,每24 h计数3孔内的细胞密度,算出平均值,共记7 d。以培养时间(d)为横坐标,细胞密度为纵坐标作生长曲线。
3.7 MMVECs体外血管形成实验 4℃冰上融化Matrigel胶,每孔150 μL均匀加至24孔板,不要有气泡,静置于37℃、5%CO2细胞培养箱孵育3 min后,待凝固后每孔逐渐缓慢加入200 μL细胞悬液,内含MMVECs为 3×105cells/well。在倒置显微镜下观察其体外血管形成过程。
3.8 MMVECs免疫荧光法鉴定
3.8.1 MMVECs DiI-ac-LDL 和 FITC-UEA-1 双荧光染色 细胞爬片上细胞长满约80%后鉴定,细胞在含DiI-ac-LDL(10 mg·L-1)的培养液中避光孵育4 h,PBS漂洗后,用 40 g·L-1的多聚甲醛固定 30 min,PBS漂洗后再加 FITC-UEA-1(10 mg·L-1)避光孵育1 h,PBS漂洗后,DAPI染核10 min,在荧光显微镜下观察,显示红色荧光的为DiI-ac-LDL阳性细胞,显示绿色荧光的为UEA-1阳性细胞,蓝色为细胞核,显示双荧光阳性(黄色)的细胞被认为是MMVECs。随机计数10个非重叠视野,计算双阳性细胞比例。
3.8.2 MMVECs vWF、CD31 和 CD34 抗原的鉴定
取第3代MMVECs以1×105个接种于放有无菌盖玻片的24孔板,2~3 d后用0.01 mol·L-1PBS洗3次,每次 2 min;40 g·L-1多聚甲醛固定 20 min,0.01 mol·L-1PBS 洗3 次,每次2 min;3 g·L-1Triton X-100室温孵育30 min,用0.01 mol·L-1PBS洗3次,每次2 min;200 μL胎牛血清室温封闭1 h,滴加200 μL兔抗小鼠 vimentin、CD31、vWF和 CD34(Ⅰ抗;1∶100),4 ℃过夜,用0.01 mol·L-1PBS 洗 3 次,每次2 min;然后分别加1∶100 TRITC标记或FITC标记的羊抗兔IgG(Ⅱ抗)200 μL,室温避光孵育1 h,用0.01 mol·L-1PBS洗3次,每次2 min;最后用DAPI染核,室温避光孵育15 min;同时做同型对照,不加Ⅰ抗,余步骤同前,在荧光显微镜下观察,统计阳性细胞数。
4 统计学处理
应用SPSS 11.0软件进行统计学分析,计量资料以均数±标准差(mean±SD)表示,多组间比较采用方差分析,以P<0.05为差异有统计学意义。
结 果
1 MMVECs形态特征及生长特点
MMVECs酶消化分离细胞,细胞于24 h后贴壁,胞质完全伸展,见图1A;第3 d细胞开始生长,呈三角形、不规则型,见图1B;第4~5 d细胞开始增殖,可见多数核分裂像,细胞密度迅速增大,见图1C、D;第6~7 d后长成致密细胞层,呈短梭形、多角形,为铺路石样排列(图1E、F),MMVECs纯度为(91.0±3.8)%以上。

Figure 1.Primary culture of MMVECs.A:day 2;B:day 3;C:day 4;D:day 5;E:day 6;F:day 7.图1MMVECs的原代培养
2 MMVECs传代细胞成活率
台盼蓝法计数 MMVECs,1 000个细胞中,(95.0±2.6)%的细胞未着色,即细胞的成活率为95%以上,表明培养的细胞消化传代成活率高。
3 MMVECs生长曲线
从生长曲线上看,第1、3代细胞接种3 d后,细胞数明显增加,第3~4 d为对数生长期,5 d后细胞数量减少,呈现“潜伏期——对数生长期——停滞期”的生长模式,见图2;第5代细胞接种后无明显变化,细胞数无明显增加。
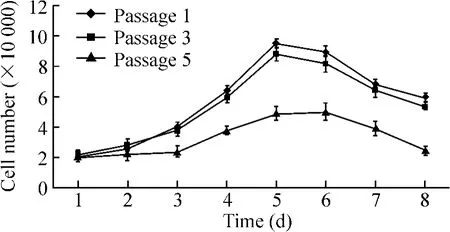
Figure 2.The growth curves of MMVECs in the first,third and fifth passages.图2 MMVECs第1、3、5 代生长曲线
4 MMVECs增殖活力
取第1、3、5代对数期生长的细胞,MTT法连续7 d测定MMVECs增殖能力,结果见表1。第1代与第3代比较,MMVECs生长前2 d无明显增殖,提示此段时间内MMVECs增殖能力较弱;3~5 d变化比前2 d较为显著(P<0.05),提示此段时间内细胞出现增殖;6~7 d变化比3~5 d有显著差别(P<0.05),提示此段时间内细胞出现衰老,与MMVECs生长曲线结果相一致,故认为第3~5 d为传代的最佳时机。第5代细胞无明显增殖,增殖能力较弱,活力较弱。
5 体外血管形成实验
MMVECs接种于基质胶后,细胞2 h后即可贴壁、黏附,4~6 h形成分散的网状及管腔结构,管腔周围聚集单层细胞,其数量逐渐增多,见图3A,10~12 h网状结构相互连接,形成小管腔样结构,见图3B。

表1 第1、3、5代小鼠心肌微血管内皮细胞增殖活力测定Table 1.Viability of MMVECs in the first,third and fifth passages(mean±SD.n=5)

Figure 3.Dynamic process of the tube formation of MMVECs plated on Matrigel.A:6 h;B:12 h.图3 体外血管形成的动态过程
6 DiI-ac-LDL和FITC-UEA-1双荧光染色鉴定
荧光显微镜下观察,MMVECs的DiI-ac-LDL和FITC-UEA-1双荧光染色阳性率(89.2±3.5)%,见图4。
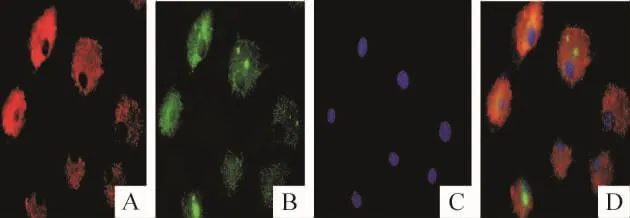
Figure 4.Identification of MMVECs by DiI-ac-LDL and FITCUEA-1 immunofluorescent staining(×1 000).A:DiI-ac-LDL;B:FITC-UEA-1;C:DAPI;D:merged.图4MMVECs DiI-ac-LDL和FITC-UEA-1双荧光染色鉴定
7 CD31、vWF和CD34免疫荧光鉴定
倒置显微镜下观察CD31、vWF和CD34染色阳性率分别为(56.7±3.7)%、(78.5±2.6)%和(67.8±4.2)%,见图5;vimentin阴性表达。
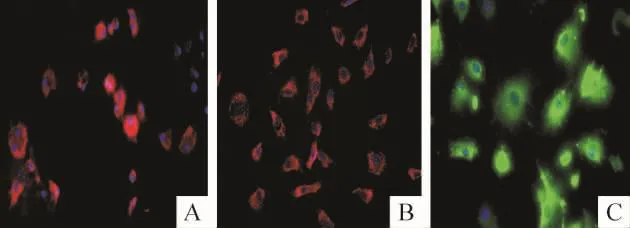
Figure 5.Identification of MMVECs by CD31,vWF and CD34 immunofluorescent staining(×400).A:CD31;B:vWF;C:CD34.图5MMVECs CD31、vWF和CD34免疫荧光鉴定
讨 论
血管内皮细胞位于血管腔内膜表面,为单层紧密排列,互相连接的一层薄膜,构成了一道循环血液与局部组织之间的屏障,目前血管内皮细胞的培养大多数来源于大血管内皮细胞,而大血管内皮细胞与微血管内皮细胞无论在分泌功能及调节体内各种生物信息的应答和生理功能等方面均存在着明显的差异,微血管内皮细胞具有显著的组织器官异质性[5]。因此,如何简便、成功地获得纯度较高的心肌微血管内皮细胞是如今进行心血管疾病研究的一个突破点。
原代培养常用的方法有酶消化法和组织块法:Nishida等[6]报道了一种通过心脏灌注、胶原酶和胰蛋白酶消化及机械剪切的方法,但该方法需要特殊的实验设备,步骤较复杂、费时,虽然该方法培养周期短,但酶活性浓度、酶作用时间不易掌握,培养不易成功。目前国内实验室已经广泛开展大鼠心肌微血管内皮细胞的原代培养,常采用组织贴块培养法,需在手术显微镜下操作,对操作环境要求较高,体外培养细胞周期较长,且同时出现上皮细胞和成纤维细胞混杂生长。对小鼠心肌微血管内皮细胞的原代培养仍有一定难度,本研究首次应用以多聚赖氨酸对培养皿作预包被,Ⅱ型胶原酶消化经差速贴壁分离法结合内皮细胞专用培养基,简便、成功地获得纯度较高的心肌微血管内皮细胞。
本研究选用Ⅱ型胶原酶消化,此酶特异性作用于结缔组织的胶原,对胶原或细胞间质有很好的消化作用,减轻了对细胞的损伤程度,更使其内的细胞容易迁出,但长时间的消化会影响心肌细胞的活力,本研究采用Ⅱ型胶原酶40 min消化,可以消除心肌细胞的污染;依据心肌成纤维细胞贴壁速度很快,而心肌微血管内皮细胞相对较慢,通过差速贴壁60 min,可以有效地分离心肌成纤维细胞[7]和心肌微血管内皮细胞;此外,本研究在培养基质中用多聚赖氨酸对培养皿进行预包被,而没有使用鼠尾胶原或纤维连接蛋白,多聚赖氨酸作为一种中介蛋白,促进细胞连接到胶原等细胞外基质上,在MMVECs的体外培养中主要起到促进贴壁的作用。本研究使用了多聚赖氨酸预包被培养皿,也能发挥与鼠尾胶原、纤维连接蛋白相同的作用,结果发现这种培养方法也能获取较多的MMVECs,使其成本大大减低且简化操作程序;体外培养MMVECs并结合内皮专用培养基的应用,可以选择性地培养血管内皮细胞,减少心肌细胞及心肌成纤维细胞的混杂生长,为该细胞体外培养创造适宜的环境,为进一步探讨心脏微环境生理及病理改变的研究提供了实验基础。
研究MMVECs增殖能力有助于更多地了解其生长特性[8]。本研究采用2种指标即细胞生长曲线、细胞增殖活力(MTT)来反映细胞的生长增殖能力。
细胞生长曲线是一定数量的细胞在一定空间的培养皿中贴壁生长的细胞数与时间的关系曲线。本研究通过细胞计数法绘制第1、3、5代细胞生长曲线,结果显示第1、3代细胞生长曲线近似“S”形,潜伏期约2 d;2 d后进入对数生长期,此时细胞增殖最为迅速,可用于实验研究;5 d后进入停滞期,细胞数量很多但细胞分裂却近乎停止,细胞处于生长抑制期,细胞不能应用于实验;第5代细胞无明显增殖且逐渐凋亡甚至死亡,此时已经进入衰退期,因此最好不要超过5d进行传代,MMVECs在体外培养传代次数有限且3代内的细胞可用于实验。
MTT法检测第1、3、5代细胞增殖活力的结果显示,第1、3代细胞吸光度值(A490)在细胞传代后3~5 d增长较快,表明此时间内MMVECs增殖活力较强。第5代MMVECs几乎无增殖。从上述结果可以显示,第3代以内的MMVECs在体外传代3~5 d可作为理想的实验细胞,与生长曲线相一致。
大量研究证明微血管内皮细胞在生理与病理过程中起着非常重要的作用[2,9],当机体创伤、缺血、缺氧及炎症反应时,内皮细胞及蛋白酶激活后,基质降解和内皮细胞的黏附、迁移、增殖、分化成毛细血管的过程,体外管腔形成实验是血管内皮细胞在基质胶上形成具有管腔的毛细管状结构,涉及微血管内皮细胞功能,接近体内血管新生的机制,本研究将心肌微血管内皮细胞接种于预包被的基质胶上,结合ECM培养基体外培养6~12 h可以形成毛细血管样网络和血管样结构,建立血管发生的实验模型来评价抗血管药物的疗效及相关的分子调控机制。
关于内皮细胞的表面抗原有多种方法的鉴定,由于CD34、vWF和CD31被认为是内皮细胞的特征性表面标志,CD34和CD31主要表达于血管内皮细胞表面[10-11];血管性血友病因子(vWF)作为内皮细胞合成和分泌的一种糖蛋白,反映内皮细胞的功能状态和损伤程度的指标[12],本研究通过对培养MMVECs进行CD31、vWF和CD34免疫荧光鉴定,结果显示,细胞大多数阳性表达CD31、vWF和CD34且vimentin表达阴性,其阳性率分别为(56.7±3.7)%、(78.5±2.6)%和(67.8±4.2)%。培养的MMVECs经形态学观察,在融合成单层后呈铺路石样,符合血管内皮细胞特殊的生长形态,因此,通过细胞形态学及表型鉴定,可以认为这些细胞都是比较纯的MMVECs,而且基本排除了心肌成纤维细胞的干扰。
目前国内外最常用的内皮细胞的鉴定金标准为DiI-ac-LDL和FITC-UEA-I双染色法鉴定[13]。吞噬ac-LDL虽然是内皮细胞的特征之一,但是吞噬细胞也具有此特征。为进一步区分二者,同时行凝集素鉴定。凝集素是从植物或无脊椎动物中提取的糖蛋白,不同种属的凝集素能和细胞表面的特定糖基特异性结合,从而作为细胞鉴定标志,荆豆凝集素I(UEA-I)能与内皮细胞表面糖基特异性结合。因此本研究对所分离的细胞进行DiI-ac-LDL和FITCUEA-I双染色鉴定,结果显示(89.2±3.5)%阳性细胞,即可确定为内皮细胞。
综上所述,本实验首次以多聚赖氨酸对培养皿作预包被,Ⅱ型胶原酶消化、经差速贴壁分离法结合内皮细胞专用培养基,简便、成功地获得纯度较高的新生小鼠MVECs。通过台盼蓝染色表明传代细胞成活率高达95%以上;经绘制细胞生长曲线和MTT法分别观察MMVECs生长、增殖特性;DiI-ac-LDL和FITC-UEA-1荧光双标及细胞表面相关抗原CD31、vWF和CD34免疫荧光染色法鉴定,体外管腔形成实验进一步证实为MMVECs。本研究为建立稳定的MMVECs细胞系提供了方法,并为以MMVECs作为靶细胞,从细胞分子水平研究心血管疾病病因、机制和防治提供实验基础。
[1]Vinten-Johansen J,Jiang R,Reeves JG,et al.Inflammation,proinflammatory mediators and myocardial ischemiareperfusion injury[J].Hematol Oncol Clin North Am,2007,21(1):123-145.
[2]Nie L,Wise ML,Peterson DM,et al.Avenanthramide,a polyphenol from oats,inhibits vascular smooth muscle cell proliferation and enhances nitric oxide production [J].Atherosclerosis,2006,186(2):260-266.
[3]康焕菊,曹 苏,沈施仁.原代大鼠心肌微血管内皮细胞培养方法优化[J].广东医学,2010,31(23):3032-3034.
[4]柳爱华,杨向红,王延林,等.大鼠心脏微血管内皮细胞的培养[J].中国医科大学学报,2009,38(1):55-56.
[5]Ryzhov S,Solenkova NV,Goldstein AE,et al.Adenosine receptor-mediated adhesion of endothelial progenitors to cardiac microvascular endothelial cells[J].Circ Res,2008,102(3):356-363.
[6]Nishida M,Crarley WW,Gerritsen ME,et al.Isolation and characteristion of human and rat cardiac microvascu lar endothelial cells[J].Am J Physiol,1993,264(2 Pt 2):H639-H652.
[7]张 涛,滕可导,田启超,等.乳鼠心肌膜微血管内皮细胞的体外培养[J].解剖学报,2008,39(1):121-123.
[8]Takayama T,Taguchi T,Koyama H,et al.The growth of a vascular network inside a collagen-citric acid derivative hydrogel in rats[J].Biomaterials,2009,30(21):3580-3587.
[9]高润娣,曹 婕,卢 珊,等.小鼠肺微血管内皮细胞的培养鉴定及其血管形成功能的研究[J].中国病理生理杂志,2012,28(1):186-188,192.
[10]Chen SS,Gao XF,Sun YH,et al.Analysis of HK-2 cells exposed to oxalate and calcium oxalate crystals:proteomic insights into the molecular mechanisms of renal injury and stone formation [J].Urol Res,2010,38(1):7-15.
[11]梁光波,金惠铭.微血管内皮细胞的分离和培养[J].中国微循环,2002,6(1):59-61.
[12]宁艳霞,王新红,金惠铭,等.大鼠心肌微血管内皮细胞的培养及基因芯片分析的研究[J].中国病理生理杂志,2005,21(12):2295-2300.
[13]宋丽娜,董小黎,周以健.急性缺氧时内皮细胞中vWF的变化[J].中华血液学杂志,2000,21(9):475-478.

