羟丙基壳聚糖-胰岛素微球的制备及性能
来水利, 高莹华, 王克玲, 肖雨晨
(1.陕西科技大学 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021; 2.郑州市商业技师学院,河南 郑州 450121 )
0 引言
壳聚糖(CS)是天然多糖中唯一的碱性多糖,含有游离的一级氨基,可通过体内的溶菌酶作用分解为葡胺糖,被人体吸收.因其来源丰富、无毒、有优良的生物相容性和减缓药物扩散和溶出等特性[1-3],可以很好地用于药物载体[4-6].但是CS的水溶性较差,只能溶于弱酸,这会限制CS的应用范围,影响微球的制备和药物释放.所以在不改变其碱性和正电性的情况下,将其羟丙基化,制备水溶性的羟丙基壳聚糖(HPCS),即可解决壳聚糖水溶性较差的问题[7].本文通过CS与环氧丙烷反应制备HPCS,并将其用于载胰岛素微球的载药材料,研究了微球的结构和性能.
1 实验部分
1.1 实验仪器和试剂
壳聚糖(CS):青岛海汇生物有限公司生产;异丙醇:分析纯,济南试剂总厂;丙酮:分析纯,齐鲁石化公司研究院试剂厂;环氧丙烷:化学纯,上海试剂一厂.
RE-52旋转蒸发器:上海亚荣生化仪器厂;Spectrum100型红外吸收光谱仪:美国Perkin Elmer公司;HITACHI S-570型扫描电子显微镜:日本日立公司;DX-2500型X-射线衍射仪:丹东方圆仪器有限公司.
1.2 羟丙基壳聚糖制备方法
称取25 g CS分散于60 mLw(NaOH)=40%的水溶液中,搅匀后放置3 h,使其充分溶胀,放入冰箱冷冻7 d后,室温解冻,加入三口烧瓶中,添加100 mL异丙醇,室温下搅拌反应1 h.再滴加环氧丙烷,使n(CS)∶n(环氧丙烷) =1∶12~16,室温搅拌反应1 h,然后升温至40~45 ℃,再反应8 h后,冷却,离心分出不溶物.用异丙醇反复洗涤不容物,再取少量水溶解,用1∶1(v/v)的盐酸中和至pH≈7,将溶液装入透析袋中,自来水透析1 d,换去离子水透析3 d.透析液经旋转蒸发仪浓缩后,以丙酮沉淀,并离心分出,于60 ℃真空干燥得羟丙基壳聚糖(HPCS).
1.3 羟丙基壳聚糖-胰岛素微球的制备
采用单凝聚法[8]制备:取60 mL液体石蜡,加入适量乳化剂,室温搅拌2 h,作为连续相.再将HPCS水溶液与一定量的胰岛素混合均匀,滴入搅拌中的连续相,滴完后室温反应一定时间,然后加入一定量的交联剂戊二醛,交联反应2 h.反应液低速离心,沉淀用石油醚洗涤两到三次,真空干燥48 h,得到HPCS-胰岛素微球.同法,不加胰岛素制备空白微球.
1.4 羟丙基壳聚糖-胰岛素微球包埋率的测定
参考文献[9]中,分别称取两份空白微球和一份胰岛素微球,制备空白液、标准液(HPCS微球+胰岛素)和样品液.将上述三种溶液加热回流2 h,使微球全部降解.以空白液做参比,将空白液和标准液按不同的体积混合配制一系列不同浓度的标准溶液,采用紫外分光光度计276 nm下测定吸光度值,绘制标准曲线,计算样品液的胰岛素含量.根据以下公式计算包埋率:
EE=M1/M2×100%
(1)
式中:EE为微球包埋率,M1为实际测得的胰岛素含量,M2为试验中所加胰岛素量.
2 结果与讨论
2.1 微球制备条件的确定
2.1.1 搅拌速度对包埋率的影响
当转速过慢,不能使药物和载药材料均匀分散,微球成块状,有粘结现象,导致药物不能包埋在微球内部,包埋率很低;转速过快,剪切力过大,容易破坏微球的交联或发生空化作用,使得微球形态不均匀,使微球的收率降低,包埋率也降低.如图1所示,搅拌速度为400 r/min时包埋率较高,为较佳搅拌速度.

图1 搅拌转速的影响
2.1.2 HPCS用量对包埋率的影响
如图2所示,当HPCS加入量较小时,制得的微球强度较差,易粘结在一起,包埋率很低;当HPCS加入量较大时,粘度较大,难分散,包埋率也下降.实验发现,当HPCS的质量分数w(HPCS)=8%时,微球形态较好,粒径较小,包埋率最高,为制备微球的最佳用量.

图2 HPCS用量的影响
2.1.3 交联剂用量的影响
戊二醛的醛基与HPCS中2位氨基之间发生醛氨缩合反应,进行交联,固化成囊,形成致密的立体网状结构,使药物被包裹在囊心,阻滞药物向外扩散[10],但用量太少,将不能对微球有效的固化,微球将呈半固体状态,其中的药物易流出;用量太多,微球变为褐色或黑色,这使HPCS变质,甚至会使药物发生交联反应破坏药物的活性.如图3所示,当交联剂戊二醛的体积分数φ=0.25%(对液体石蜡)时,包埋率最高,可达到63%.

图3 交联剂用量的影响
2.2 HPCS-胰岛素微球的结构表征及性能分析
2.2.1 微球的红外光谱
如图4所示,在HPCS的谱图上,3 440 cm-1处为较强的O-H和N-H伸缩振动吸收峰的叠加,而b、c此处的吸收峰都加宽,并且发生了不同程度的移动,说明HPCS的N-H与戊二醛发生了醛氨缩合反应,产生 N=C键,使N-H键消失.在HPCS的谱图上,2 970 cm-1和1 460 cm-1处出现了极为明显的吸收峰,这两处分别是-CH的伸缩振动和弯曲振动,说明在壳聚糖上引入了羟丙基基团,羟丙基取代后引入了大量的甲基,b、c在此处的峰更加明显,说明交联剂戊二醛引入了C-H键.

图4 微球的红外谱图
2.2.2 微球的XRD谱图
如图5所示,HPCS由于在CS上引入了羟丙基后破坏了CS的结晶结构,转变为非晶结构;HPCS空白微球和HPCS-胰岛素微球均无明显的衍射峰,属于非晶结构,可能HPCS和胰岛素这两种大分子并没有发生化学结合.
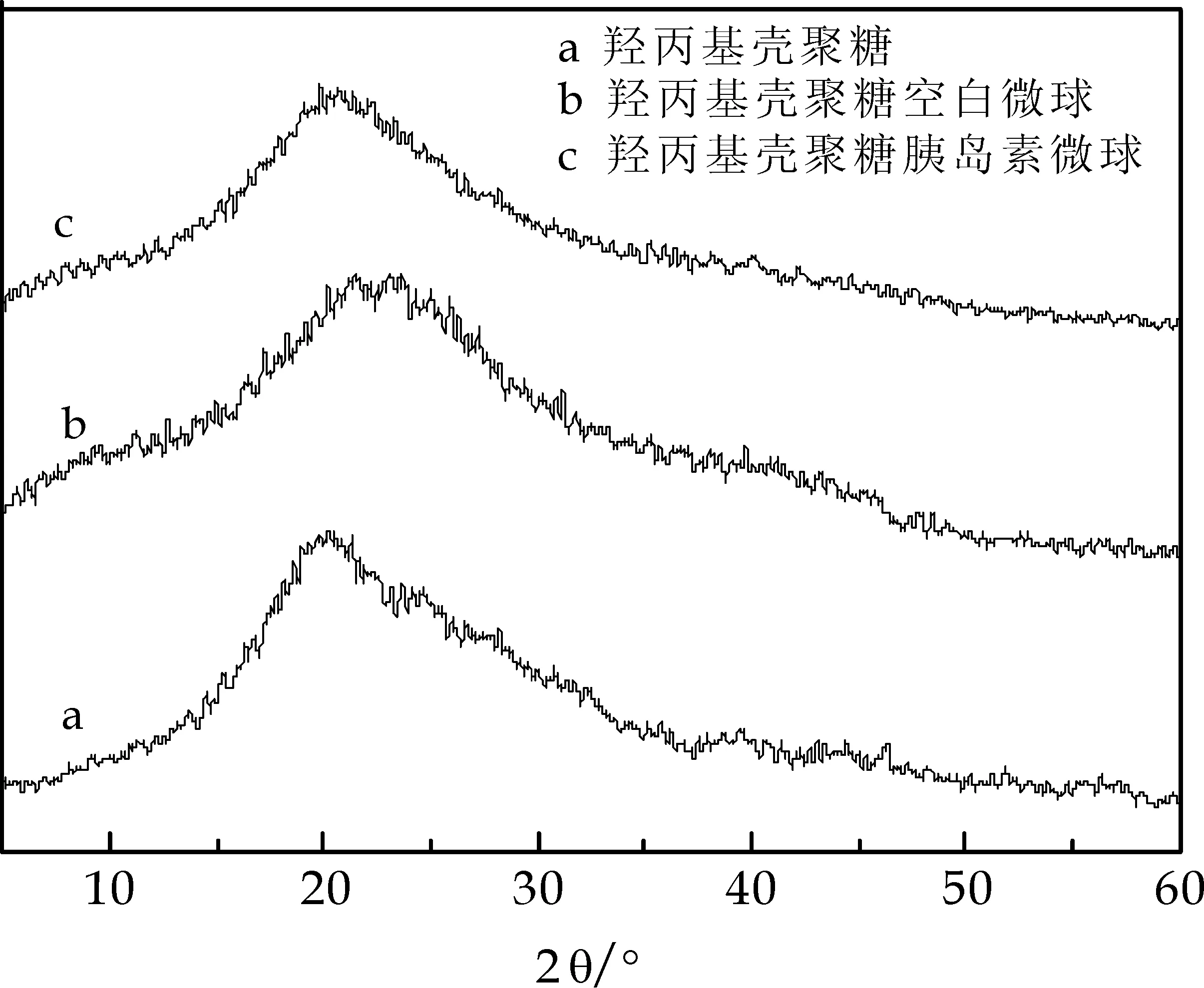
图5 微球的XRD谱图
2.2.3 微球的热稳定性分析
如图6所示,HPCS在248 ℃出现吸热分解峰,而HPCS空白微球的吸热分解峰出现在312 ℃,提高了64 ℃,可能是交联固化作用使HPCS的热分解温度提高.HPCS-胰岛素微球在309 ℃处出现了胰岛素的二级构型转变放热峰,抵消了此温度附近的热分解峰,可知HPCS-胰岛素微球的热分解温度没有明显提高.

图6 微球的DSC谱图
2.2.4 微球外貌及粒径分析


图7 微球的粒径分布图
2.2.5 微球的外貌观察
如图8所示,载药微球明显大于空白微球,微球的表面结构密实,分散性较好;空白微球表层有稍微突起的棱角,可能是因为空白微球内部有空隙,从溶液中离心分出的过程中相互挤压形成的.

图8 微球的扫描电镜照片
3 结束语
(1)HPCS-胰岛素微球制备的较佳制备条件为:搅拌速度为400 r/min,HPCS的用量为w(HPCS)=8%,交联剂戊二醛的体积分数φ=0.25%(对液体石蜡).
(2)采用HPCS包覆胰岛素制备的微球,形态规整,表面密实,分散性较好.其粒径较小且分布较窄,微球的平均粒径为13.34μm,包埋率较高,最高可达63%.
[1] Szczubialka K,Zomerska K,Karewicz A,et al.Novel drug carrier-chitosan gel microspheres with covalentlyattached nicotinic acid[J].Journal of Controlled Release,2006,116(2):13-15.
[2] 来水利,潘志友, 李晓峰. 微波辐射下壳聚糖降解性能的研究[J].陕西科技大学学报,2005,23(1):38-40.
[3] 来水利,韩武军,王克玲,等. 壳聚糖及其衍生物用于降血糖的最新研究进展[J].食品工业科技,2011,32(2):369-372.
[4] 杨利芳, 薛伟明, 高 茜, 等.载胰岛素壳聚糖微球口服降血糖作用的研究[J].化学工程,2008,36(1):71-74.
[5] 来水利,王克玲,张 敏.丝素-羟丙基壳聚糖微球的结构和释药性能[J].精细化工,2010,27(2):160-164.
[6] Xu Y M,Du Y M.Effect of molecular structure of chitosan on protein delivery properties of chitosan nanoparticles[J].Inter J Pharm,2003,250(1):215-226.
[7] 居成学,尹建伟,黄 凌,等.聚乳酸/羟丙基淀粉复合降解型材料的制备和表征[J].塑料,2008,37(6):67-69.
[8] Pan Y,Li YJ,Zhao HY,et al.Bioadhesive polysaccharide in protein delivery system:chitosan nanoparticles improve the intestinal absorption of insulin in vivo[J].Int J Pharm,2002, 249(1-2):139-147.
[9] 古永红,王连艳,谭天伟,等.尺寸均一的壳聚糖微球的制备及其作为胰岛素控释载体的研究[J].生物工程学报,2006,22(1):150-155.
[10] 荣 峰,彭代银,钱金粉,等.胰岛素壳聚糖缓释机理的研究[J].药学服务与研究,2004,4(4):332-334.

