非洲猪瘟病毒VP73结构蛋白表达及鉴定
董 林,王艳萍,张春玲,沈志强*
(1.山东省滨州畜牧兽医研究院,山东滨州256600;2.山东绿都生物科技有限公司,山东滨州256600)
非洲猪瘟病毒(African swine fever virus,ASFV)是一种虫媒传播的DNA 病毒,是引起非洲猪瘟的病原[1],以全身出血、呼吸障碍和神经症状、高死亡率为主要特征[2]。ASFV 基因编码160~170开放阅读框,根据基因序列差异分为22个基因型,其基因组DNA 大小为170 000~190 000nt[3]。ASFV 开放阅读框VP73编码蛋白是其主要结构蛋白,不同毒株间同源性可达97.8%~100%[4],是保守性最高的编码基因。Pastor等[5]研究发现,ASFV 至少8 个血清型,不同毒株诱导机体产生的VP73抗体的相应抗原性十分保守,且VP73蛋白占整个病毒结构蛋白的32%左右,是ASFV 血清学诊断的良好候选结构蛋白。
ASF流行病学监测显示,世界范围内ASF 流行地域呈现不断扩散趋势,流行毒株基因组变异日趋明显,且软蜱在ASFV 流行和传播中十分重要[6]。但目前国内还未见该病的相关报道,并且跨境传入风险不断增大。因此,建立快速、准确的ASFV 检测方法十分必要。由于国家法律禁止该类活病毒引进,使得利用全病毒进行研究的常规手段受到限制,所以本试验利用人工合成VP73主要抗原表位区,体外构建ASFV 重组抗原表达载体,试图获得ASFV 病毒抗原蛋白的方法,以期为建立快速、安全的诊断和检验ASFV 方法奠定基础。
1 材料与方法
1.1 材料
1.1.1 载体和菌株 感受态细胞DH5α、BL21(DM3)表达菌、pGEX-KG表达载体均由本实验室保存。
1.1.2 主要试剂 10×PCR Buffer、dNTP、Taq 酶、DL 2 000DNA Marker、EcoRI和SalI限制性内切酶、T4DNA连接酶、IPTG 诱导剂、低分子量蛋白质Marker均购自大连宝生物工程公司;胰蛋白胨、酵母提取物为OXID公司产品;高纯度质粒小量制备试剂盒、多功能DNA 纯化回收试剂盒购自北京百泰克生物技术有限公司;鼠抗GST 单克隆抗体,兔抗鼠-HRP,二氨基联苯胺(DAB)购自Sigma公司。
1.1.3 标准血清 ASFV 标准阳性血清、标准阴性血清、参考血清由英国Reading University惠赠。
1.2 方法
1.2.1 ASFV VP73主要抗原区基因的人工合成
根据GenBank(登录号:S89966)中ASFV VP73基因序列,考虑到大肠杆菌翻译时的密码子偏爱性,选取基因保守性强的抗原表位基因,由生工生物工程(上海)有限公司合成该段基因,构建pUC57-VP73克隆载体,转化到DH5α感受态细胞。
1.2.2 引物设计及PCR 扩增 依据选定合成的VP73基因序列,设计上下游引物,VP73-P1:5-CGGAATTCCAGGATGCTCCGATTCAG-3;VP73-P2:5-GCGTCGACATCGGTAAGAATAGGTTT-GC-3。上下游引物分别引入EcoRI、SalI内切酶,引物由生工生物工程(上海)有限公司合成。以构建的pUC57-VP73克隆载体为模板,PCR 扩增VP73基因。PCR 反应体系(25.0μL 体系):10×PCR Buffer 2.5μL,dNTP2.0μL,上下游引物各1.0 μL,模板1.0μL,Taq酶0.5Taq酶,ddH2O 17.0 μL,总体系25.0μL。PCR 扩增反应程序:94 ℃4 min;94 ℃45s,54 ℃35s,72 ℃45s,30个循环;72 ℃10 min。PCR 扩增完成后,取扩增产物3.0 μL,于1.5%琼脂糖凝胶中电泳检测。
1.2.3 ASFV VP73 表达载体构建 以pUC57-VP73质粒为模板,用PCR 方法扩增VP73基因片段,DNA 胶回收试剂盒回收目的PCR 基因产物,用内切酶EcoRI、SalI同时对获得基因片段和pGEXKG载体进行双酶切并回收DNA。使用T4DNA连接酶将VP73基因片段和pGEX-KG载体连接构建重组质粒。连接产物转化到DH5α感受态细胞,筛选阳性克隆,提取质粒,进行酶切鉴定和序列测定。
1.2.4 VP73重组蛋白的诱导表达 提取鉴定好的重组表达质粒,转化进表达菌株BL21(DM3),挑选单个菌落,接种到5mL 含100μg/mL Amp的LB液体培养基,37 ℃培养过夜。将过夜培养重组均以1%体积比接种到含100μg/mL Amp 液体LB培养基,37 ℃震荡培养至OD600nm 为1.0时,加入诱导剂IPTG 至终浓度为1 mmol/L,37 ℃诱导培养4h后,8 000rpm,离心15min,收集菌体,通过15%SDS-PAGE电泳评估表达效果。
1.2.5 VP7 重组蛋白纯化 将重组质粒表达菌BL21(DM3)接种到350 mL 液体LB 培养基,震荡培养至OD600nm 为1.0 左右时,加入诱导剂IPTG 至终浓度为1 mmol/L,37 ℃诱导培养4h后,离心收集菌体,SDS-PAGE 评估表达情况。8 000rpm,4 ℃,离心15min,收集菌体,超声破碎,提取包涵体。使用8M 尿素使包涵体变性后,用GST-Protein Purtification Kit纯化表达的目的蛋白,具体步骤按使用说明书进行,SDS-PAGE 检测纯化效果。
1.2.6 VP73重组蛋白Western blot分析 收集纯化的VP73重组蛋白进行SDS-PAGE 电泳,将电泳的蛋白转移到NC膜上,使用鼠抗GST 单克隆抗体为一抗,兔抗鼠-HRP 为二抗,进行Western blot分析,以检测表达产物的表达活性。
2 结果与分析
2.1 VP73基因合成及PCR 扩增结果
根据Genebank(登录号:S89966)中ASFV VP73基因序列,合成其保守性强的349-777nt区段429nt大小基因。用引物VP73-P1、VP73-P2以合成基因为模板,进行PCR 扩增,取扩增产物3.0 μL,于1%琼脂糖凝胶中电泳检测,结果显示在429 nt出现特异性目的条带,大小与预期相符(见图1)。
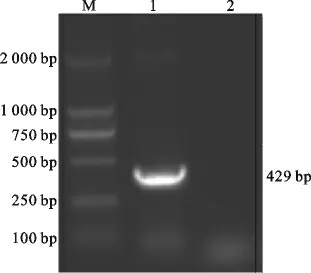
图1 PCR 扩增结果Fig.1 The amplified product of VP73gene by PCR

图2 重组质粒酶切鉴定结果Fig.2 Digestion of pEGX-KG-VP73
2.2 重组表达载体构建与鉴定
pEGX-KG-VP73 重组质粒经EcoRI、SalI限制性内切酶双酶切鉴定,经1.5%琼脂糖凝胶电泳可见约429nt大小的DNA 片段,与预期结果一致,说明重组质粒构建成功(图2)。重组质粒经序列测定显示与Genebank(登录号:S89966)中ASFVVP73基因序列同源性100%,与GenBank 中登录的VP73基因同源性均在98%以上,说明构建的重组质粒含VP73基因同源性好,这位PCR 试剂盒的应用提供了保证。
2.3 VP73重组蛋白诱导表达
重组质粒pGEX-KG-VP73,转化进原核表达菌BL21(DM3)中,筛选阳性菌落,诱导培养,收集菌体,经15%SDS-PAGE 检测,结果表明,在约41.0 Ku位置出现一条与预期分子量大小相符浓染蛋白条带(图3),而未经诱导的重组质粒转化菌和经诱导的空质粒转化菌培养提取物没有相应目的条带,表明VP73重组蛋白进行了有效表达,表达量占菌体蛋白总量的35%左右。
2.4 VP73重组蛋白纯化及表达活性鉴定
重组蛋白经GST-Protein Purtification Kit纯化后,15%SDS-PAGE电泳分析显示目的蛋白获得了良好纯化,且纯度可到90%以上(图4)。Western blot分析,抗GST 抗体与转染到NC 膜上的重组VP73重组蛋白可以反应,经DAB 显色后在41Ku左右有一明显特异性条带,表明表达的VP73重组蛋白具有的良好表达活性(图5)。

图3 VP73重组蛋白诱导表达Fig.3 The SDS-PAGE of product of pEGX-KG-VP73

图4 重组VP73蛋白纯化Fig.4 Affinity chromatography purification of recombinant N protein
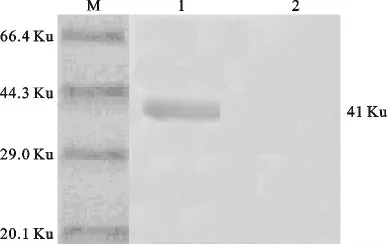
图5 重组VP73蛋白Western blot分析Fig.5 Western blot of the recombinant VP73protein
3 讨论
现阶段我国还未有ASFV 传入的报告,但跨境传播的风险不断增强,因此,研制基于体外诱导重组抗原的血清学诊断试剂,并应用于进口动物ASFV口岸检疫具有重要意义。目前,国外已研制了多种ASFV 基因及血清学诊断方法,并有产品投向市场;国内学者也开展了ASFV 诊断方法及检疫的相关研究工作,但还都处在起步阶段,急需开展进一步研究。VP73是ASFV 主要结构蛋白,其稳定性好,抗原保守性强,可诱导机体产生特异性抗体,具有抗原保守性强的优势,是建立ASFV 血清学快速诊断的良好候选抗原[9]。
本试验利用体外合成方法构建了含ASFV VP73主要抗原表位基因片段,避免了直接操作ASFV 病毒所带来的生物安全威胁。通过基因工程手段将获得ASFV VP73基因片段克隆到pEGX-KG原核表达载体多克隆位点,构建ASFV VP73重组蛋白表达载体,进行了体外诱导表达重组蛋白VP73,SDS-PAGED分析表明重组蛋白VP73获得了高效表达,经薄层扫描分析融合蛋白在菌体中的表达了约为35%。Western blot检测显示重组蛋白VP73能与ASFV 阳性血清发生特异性显色反应,说明其具有生物学活性。我们使用GST 亲和层析纯化试剂盒对目的蛋白进行了纯化,检测表明纯化后重组VP73蛋白纯度达到90%以上,可基本满足血清学诊断抗原需要。现阶段,我们正在研制基于重组VP73蛋白的ELISA 等血清诊断试剂。本试验为下一步以ASFV VP73蛋白作为抗原的诊断试剂的研制奠定了一定基础。
[1]殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997,1 197-1 205.
[2]Williamr,Hess Adv.African swine fever:a reassessment[J].Vet Sci ComP Med,2010,25:39-69.
[3]Rowlands R J.African swine fever virus isolate,Georgia,2007[J].Emerg Infect Dis,2008,14:1 870-1 874.
[4]Claudio L,Carlos A,Aleiandro B,et al.Characterization of P30,a highly antigenic membrane and secreted protein of Afri-can swine fever virus[J].Virology,2010,189:368-373.
[5]Pastor M J,Arias M,Esefibano J M.Comparison of two antigen for use in an ELISA to detect African swine fever virus antibody[J].Am J VetRes,2011,51:1 540-1 543.
[6]Renniel L,Wilkinson P J,Mellor P S.Transovarial transmission of African swine fever virus in the argasid tick Ornithodoros moubata[J].Med Vet Entomol,2009,15(2):140-146.
[7]Garcia-Barreno B,Sanz A,Nogal M L,et al.Monoclonal antibodies of African swine fever virus:Antigenic differences among field virus isolates and viruses passages in cell culture[J].J Virol,2006,58:385-392.
[8]Rafael,Yanez,Javier M,et al.Analysis of the complete Nucleotide Sequence of African Swine Fever virus[J].Virology,2005,208:249-279.
[9]蒋正军,马世东,蔡丽娟,等.非洲猪瘟间接ELISA 诊断试剂盒的研究[J].中国预防兽医学报,2000,22(S):107-113.

