邻苯二甲酸丁基苄酯对小鼠学习和记忆能力的影响
刘锋明,刘旭东,闵安娜,赵莉琴,叶染枫,李 慧,张玉超,陈明清,杨 旭(华中师范大学生命科学学院,环境科学实验室,湖北 武汉 430079)
邻苯二甲酸丁基苄酯(BBP)是邻苯二甲酸酯类化合物PAEs的一种,是70种环境激素之一[1],被美国国家环保局(EPA)列为优先控制污染物[2].由于其加工性能、耐油性、耐污染性好,在工业中广泛运用,普遍存在于城市污泥及大气中[3-4].所以说邻苯二甲酸丁基苄酯对人和动物的暴露事实上是难以避免的,它可以通过饮食、口鼻吸入、皮夫接触、医疗暴露等途径进入人和动物体内,其中,经饮食进入体内是最主要的途径[5-6].研究表明,邻苯二甲酸丁基苄酯具有生殖毒性和发育毒性[7].暴露高剂量的BBP可以导致肝、肾损害,引起癌症的发生,导致胎儿畸形和死亡.邻苯二甲酸酯被认为是具有环境雌激素效应的内分泌干扰物,可以通过母体血液,经过胎盘或乳汁干扰胎儿或新生儿的内分泌系统,影响生殖功能和器官的发育[8].此外,BBP光解水解及挥发速率较慢,对人和动物体有长期的影响.并可能改变正常的大脑发育[9].评价邻苯二甲酸酯的毒性及其致病机制是当前的研究热点之一.特别是邻苯二甲酸酯被认为是一种内分泌干扰物,它的生殖毒性和发育毒性引起了人们广泛的重视,并得到了很多动物毒理学及流行病学调查研究的支持[10-12].然而BBP对神经系统特别是对大脑的影响却鲜有文献报道.Hidetoyo等[13]较早就比较了BBP、邻苯二甲酸正二己酯(DNHP)、邻苯二甲酸二异丁酯(BLP)等物质对新生鼠小脑神经细胞和神经胶质细胞的生长的影响,但这是在离体的条件下进行的,对于BBP通过口暴露后能否克服体内的血脑屏障而造成对脑组织的损伤还是不清楚的.
因此,本研究通过检测BBP对小鼠学习和记忆的影响、海马组织的氧化损伤水平来评价BBP的神经毒性.
1 材料与方法
1.1 材料
1.1.1 实验动物 本研究所用的动物为鼠龄3周左右的SPF级雄性昆明小鼠,体重23~33g,购自湖北省实验动物中心.实验动物饲养在华中师范大学实验动物中心,每天12h光照/12h黑暗,允许自由进食和饮水.
1.1.2 主要试剂与仪器 邻苯二甲酸丁基苄酯(BBP),(Sigma 公司,纯度>99%),2’,7’—二氯荧光黄双乙酸盐(DCFH-DA)(Sigma公司,纯度>97%),硫代巴比妥酸(TBA,国药集团化学试剂有限公司),5’,5’-二硫代二硝基苯甲酸(DTNB 分析纯,国药集团化学试剂有限公司).其他试剂均为国产分析纯.低温冷冻离心机(Eppendorf-5415R),电热恒温水箱,涡旋器,全波长酶标仪(Bio-teck),荧光酶标仪(Bio-teck).
1.2 实验方法
1.2.1 染毒方法 将24只雄性昆明小鼠随机分成4组,每组6只,分别标记为对照组、低浓度组、中浓度组和高浓度组,分别对应体内染毒浓度为0,50,250,1,250mg/(kg·d)BBP[14].将 BBP:吐温 80体积比1:1用生理盐水配制成125mg/mL的染毒母液,使用时按照比例稀释成5,25,125mg/mL的染毒液进行实验.染毒组每天清晨使用灌胃针按照0.01mL/g体重的灌胃比例灌注相应浓度的染毒液,对照组按照同样比例灌注生理盐水,连续染毒11d.实验小鼠每天除染毒和行为学实验外,其他时间均饲养于实验动物中心,12h光照/12h黑暗,允许自由进食和饮水.
1.2.2 Morris水迷宫实验 如图1所示,水迷宫实验主体装置由一个直径120cm、高50cm、内壁不反光的不锈钢圆形水池组成,置于灯光布局合理,与外界相对隔绝的实验室中央.迷宫池以根据东西南北4个等距点将水池假想地等分为4个象限,分别记为SW、SE、NW及NE象限.在SE象限的正中距离池壁30cm处放置一直径为9.5cm、高25cm的黑色平台,淹没于水下1cm.水温控制在25℃.实验期间保持周围环境恒定.实验时,根据具体采用的实验方案选择恰当的水点,抓取小鼠,使其面向池壁,在水平面高度将其轻放入水中,让其自由游泳.其游泳轨迹被迷宫上方的摄像机记录并传入计算机,由AnyMaze软件记录分析.
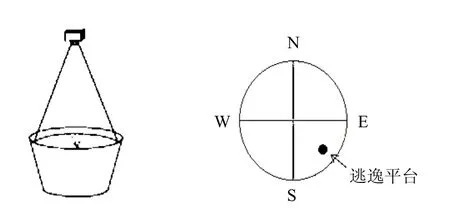
图1 Morris水迷宫实验装置示意Fig.1 Experimental system ofMorris water maze
Morris水迷宫测试分为定位航行实验和空间探索实验2部分.其中,定位航行实验主要检测小鼠的学习能力,前11d的实验中,每天染毒完毕6h后开始进行游泳训练.将小鼠分别从4个象限中向水池放入,并开始记时录像,记录小鼠60s内找到平台的时间,该时间也就是小鼠的逃避潜伏期.在前11d时,若小鼠在1min内未找到平台,则由实验者用手将其引导上平台,让其在平台上停留60s,目的在于让其观察四周,学习定位平台位置.通过了前11d的定位航行学习过程后,再经过2d的遗忘期,在第14d对小鼠进行空间探索实验.拆掉平台,以同样方法进行水迷宫实验,由软件记录60s内小鼠在各象限内游泳的时间以及跨越平台位置的次数.通过记录小鼠在移除平台后的水迷宫各个象限的游泳时间和游泳轨迹,分析得到小鼠对实验环境的空间记忆能力的强弱.
1.2.3 悬尾实验 悬尾实验基于Steru等[15]建立的方法.将实验动物尾部固定,使其头部向下悬挂,动物在该环境中拼命挣扎,企图摆脱困境,在经过努力仍不能摆脱后,出现间断性不动,显示“行为绝望”状态.该实验采用悬尾计算机实时检测分析处理系统进行“不动时间”测试.
1.2.4 强迫游泳实验 此实验在Porsolt[16]建立的方法上做了一些改进.将动物单独地放在柱状塑料桶中(水深 l5cm,直径 20cm),水温(25±1)℃.强迫游泳6min,用摄像机记录小鼠游泳的全过程,然后采用AnyMaze软件分析并记录小鼠的“不动时间”(不动即“小鼠停止挣扎或呈漂浮状态,四肢有轻微动作以保持头部在水面”).
1.2.5 组织匀浆的制备 14d的染毒及行为学实验结束后,将小鼠脱颈处死,迅速取出脑、肝、肾各组织,至于冰上,称重并记录后,将左右半脑一分为二,取小鼠的左半脑置于4.0%的多聚甲醛固定过夜,用于大脑海马组织切片;剩余的右半脑同肝和肾一样,使用匀浆器于冰上加PBS制成浓度为10%的组织匀浆.将组织匀浆液于4℃、5000r/min,离心10min,收集上清液冷冻保存,进行ROS、GSH和MDA含量的测定.
1.2.6 氧自由基(ROS)水平的测定 组织匀浆中ROS水平的测定使用的是DCF荧光法[17].将10mmol/L的DCFH-DA荧光染料用PBS缓冲液稀释1000倍,将待测脑组织匀浆液并用PBS稀释2倍,肝肾组织匀浆稀释10倍后,各取100µL混匀,在37℃下避光保存10min后,测量其在480nm激发光,520nm发射光下的荧光强度.
1.2.7 丙二醛(MDA)含量的测定 MDA含量的测定采用硫代巴比妥酸(TBA)法[18].取10mL试管,每管加入0.5mL待测样品液,调零管加入0.5mLPBS,然后各管加入2mL 0.6%TBA溶液,混匀后沸水浴15min,取出后流水冷却.10000r/min,离心10min,取上清液分别在450,532,600nm波长下测定吸光值,按照公式C=6.45(D532-D600)-0.56D450,计算出每管样品中MDA的浓度(C)[19](µmol/L).
1.2.8 还原型谷胱甘肽(GSH)含量的测 GSH的含量采用荧光染料DTNB来测定[20].取200µL细胞匀浆上清,加入50µL浓度为10%的TCA,混匀.10000r/min,离心5min.然后取50µL上清加入酶标板,再加150µL,60ng/mL的DTNB室温避光5min,测定412nm波长下的吸光值.
1.2.9 小鼠大脑海马组织切片分析 将置于4.0%的多聚甲醛固定过夜的脑组织.第2d送武汉谷歌生物科技有限公司做HE染色大脑海马组织切片;最后,显微镜观察、拍照.
1.2.10 统计学分析 用Origin6.1软件作图,SPSS17.0软件对实验数据进行ANOVA分析,两两比较采用LSD检验法检验染毒组与对照组之间的差异.
2 实验结果
2.1 小鼠体重的变化
实验染毒过程中,小鼠每天自由进食和饮水,小鼠的体重也会发生变化.图2统计小鼠每天体重的变化及最后1d与第1d小鼠体重的净变化.从图2A中可以看出,小鼠的体重逐渐增加.从图2B中可以知,染毒组小鼠体重的缓慢增加,但是染毒组和空白对照组小鼠体重并没有显著性的变化.
2.2 水迷宫实验
从图3中可以看到,在第14d的实验中,对照组小鼠在平台所在象限(SE象限)所停留的时间明显多于其他象限,而BBP染毒组的小鼠在平台所在象限停留的时间较少.同时,用SPSS17.0软件统计分析各组小鼠在平台所在象限停留时间之后得出,1250mg/(kg·d)剂量染毒组的小鼠与对照组相比,有显著性差异(*P<0.05).结果说明通过学习,对照组小鼠获得了很好的记忆能力,而BBP染毒组小鼠的记忆能力则受到了不同程度的损伤.
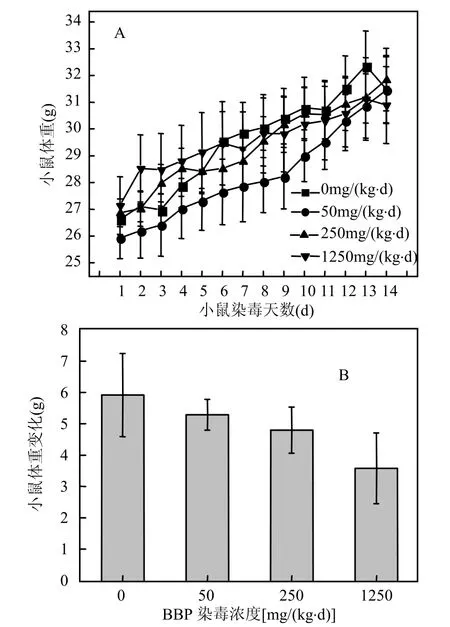
图2 小鼠体重的变化及净增长量Fig.2 The net growth and change of the weight in mice

图3 小鼠空间探索实验结果Fig.3 The results of mouse space exploration experiment
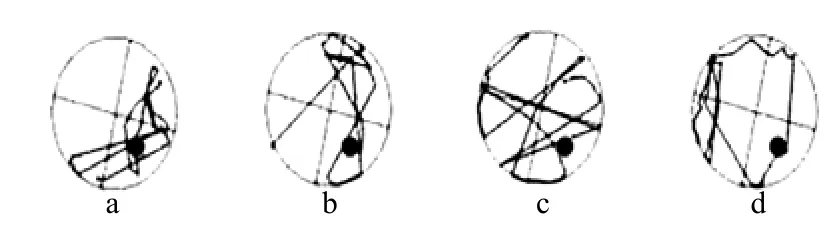
图4 实验第14d空间探索实验中小鼠游泳轨迹Fig.4 mice swimming trajectories of space exploration experiment
由图4可见,对照组小鼠游泳路径具有很强的目的性和方向性,主要集中在SE象限即原平台所在象限,而BBP染毒组小鼠游泳路径大多是不规则的、无目的性的.
2.3 悬尾实验
以50mg/(kg·d)的染毒剂量时,小鼠的悬尾不动时间明显高于空白对照组(*P<0.05),在1250mg/(kg·d)的高剂量浓度时小鼠的悬尾不动时间相对于空白对照组出现极显著差异(图5).
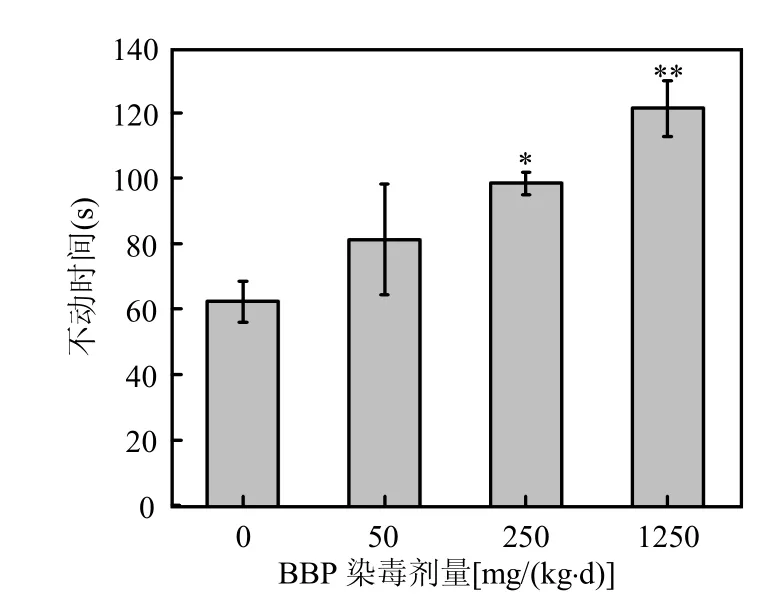
图5 悬尾实验Fig.5 Tail suspension test of mice
2.4 强迫游泳实验
与小鼠悬尾实验结果不同的是,在1250mg/(kg·d)的高剂量浓度时小鼠的不动时间对比与空白对照组才出现显著性差异(*P<0.05),而50mg/(kg·d)的染毒剂量时无显著性的差异,如图6.

图6 小鼠强迫游泳实验Fig.6 Forced swimming test of mice
2.5 BBP对小鼠脑、肝、肾组织中ROS水平的影响
从图7中可以看出,随着BBP染毒浓度的增加,小鼠脑、肝、肾组织中ROS水平也逐渐上升,在脑组织中高剂量组1250mg/(kg·d)BBP染毒组与对照组相比具有显著性差(*P<0.05).在肝和肾组织中在250mg/(kg·d)BBP染毒组与对照组相比具有显著性差异,在高剂量组1250mg/(kg·d)BBP染毒组与对照组相比具有极显著性差异(**P<0.01).结果说明,BBP能够使小鼠脑、肝和肾组织中活性氧含量水平上升,并且随着BBP浓度的增大,ROS水平上升越明显.

图7 BBP染毒对小鼠各组织中ROS含量的影响Fig.7 Changes of ROS concentrations after administration by BBP
2.6 BBP对小鼠脑、肝、肾组织中MDA含量的影响
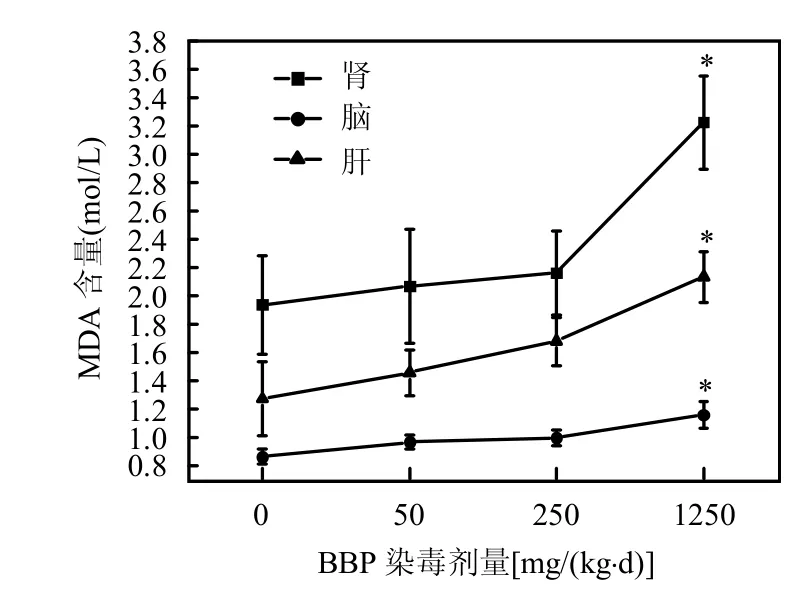
图8 BBP染毒对小鼠各组织中MDA含量的影响Fig.8 Changes of MDA concentrations after administration by BBP
从图8中可以看出,随着染毒浓度的增加,小鼠脑、肝、肾组织中MDA含量逐渐上升,并且经过统计分析,1250mg/(kg·d)BBP染毒组与对照组相比,具有显著性差异(*P<0.05),说明BBP能够对小鼠脑组织产生了脂质过氧化,并且随着BBP浓度的增大,氧化损伤程度越高.
2.7 BBP对小鼠脑、肝、肾组织中GSH含量的影响
从图9中可以看出,随着染毒浓度的增加,小鼠脑、肝、肾组织中GSH含量逐渐下降.并且经过统计分析,脑组织中在250mg/(kg·d)BBP时染毒组与对照组相比,具有显著性差异(*P<0.05),而肝和肾在1250mg/(kg·d)BBP的高浓度染毒组相比对照组,才出现显著性差异(*P<0.05).说明BBP能够对小鼠脑、肝、肾组织产生了氧化自由基,并且随着BBP浓度的增大,氧化损伤程度越高,消耗的GSH的量也更多.
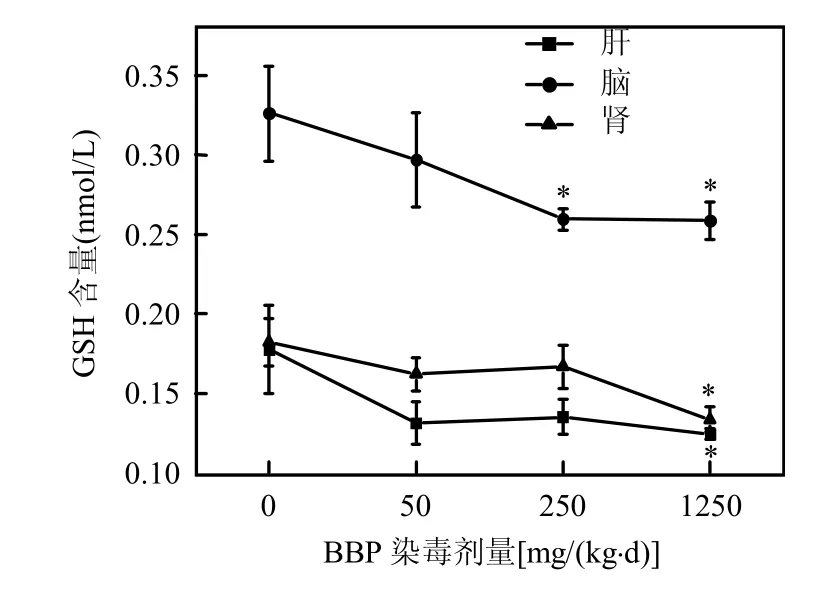
图9 BBP染毒对小鼠各组织中GSH含量的影响Fig.9 Changes of GSH concentrations after administration by BBP
2.8 BBP对小鼠大脑海马区细胞的影响
李文英等[21]认为,在获得新信息方面海马结构完整性对于学习记忆至关重要[22].经BBP染毒后,小鼠大脑海马区细胞相比与对照组出现不同程度的凋亡,随着染毒浓度的逐渐增大,出现凋亡的细胞也逐渐增多,如图10.结果表明,BBP染毒对小鼠的海马细胞有一定程度的损伤,进而影响了小鼠的学习和记忆能力.

图10 小鼠大脑海马区HE染色组织切片Fig.10 Tissue sections of mouse brain hippocampus
3 讨论
在本研究中,小鼠Morris水迷宫定位航行实验中,BBP染毒组的小鼠在平台所在象限停留的时间较少,特别是1250mg/(kg·d)高剂量染毒组的小鼠与对照组相比,有显著性差异(*P<0.05).结果表明BBP染毒组小鼠的记忆能力则受到了不同程度的损伤.空间探索实验游泳路径显示,对照组小鼠游泳路径具有很强的目的性和方向性,而BBP染毒组小鼠游泳路径大多是不规则的、无目的性的.悬尾实验和强迫游泳实验结果表明染毒小鼠的不动时间明显高于空白对照组.这些结果表明经过灌胃暴露BBP的小鼠学习记忆能力受到了影响.
氧化损伤是引起机体细胞衰老、损伤、凋亡、死亡的重要原因.已有研究认为DEHP、DBP、BBP等邻苯二甲酸酯都能导致氧化损伤[23-24].王婧等[25]对离体大鼠肺细胞进行BBP染毒,结果表明BBP对大鼠肺细胞有着明显的毒性作用,能使其发生氧化损伤.由于BBP所引起的氧化损伤作用较弱,在DEHP、DBP、BBP等3种邻苯二甲酸酯中所引起的氧化损伤作用最弱.并且BBP进入脑组织对脑神经细胞造成损伤还要突破脑血屏障,因此BBP能否对活体动物脑组织造成氧化损伤还是不清楚的.本研究结果显示BBP能够使小鼠脑组织中活性氧含量水平上升,特别是在高剂量组1250mg/(kg·d)BBP染毒组与对照组相比具有显著性差(*P<0.05).MDA检测表明BBP能够对小鼠脑组织产生了脂质过氧化,并且随着BBP浓度的增大,氧化损伤程度越高.GSH检测显示BBP染毒小鼠随着染毒剂量的升高,脑组织中GSH含量逐渐下降.因此,可以认为BBP可以引起小鼠脑组织的氧化损伤.
李文兰等[26]的研究认为邻苯二甲酸丁基苄酯在动物血清、肠道被代谢成邻苯二甲酸单丁酯及邻苯二甲酸甲丁酯.那么是进入脑组织对脑细胞造成损伤的到底是BBP还是他的代谢产物邻苯二甲酸单丁酯和邻苯二甲酸甲丁酯,它们是否有相同的神经毒性作用;有待进一步的研究.
4 结语
一定浓度的BBP染毒会导致小鼠的脑、肝、肾组织损伤,尤其是大脑海马区的损伤,会引起小鼠学习与记忆能力的减弱,说明BBP对小鼠具有一定的氧化损伤毒性和神经毒性.
[1]Wezel A P,Vlaardingen V,Posthumus R,et al.Environ mental risk limits for two phthalates,with special emphasis on endocrine disruptive properties[J].Ecotoxico.Environ.Safety,2000,46:3205-3214.
[2]张锡辉.高等环境化学与微生物学原理及应用口咽[M].北京:化学工业出版社,2001:147-149.
[3]Cantreeds W.Comparision between the organic Fraction of Suspended Matter at a Background and an urban station[J].Total Environ.,1997,8(1):79-88.
[4] 莫测辉,蔡全英,吴启堂,等.我国城市污泥中邻苯二甲酸酯的研究 [J].中国环境科学,2001,21(4):362-366.
[5]Swan S H.Environmental phthalate exposure in relation to reproductive outcomes and other health endpoints in humans[J].Environ.Res.,2008,108:177-184.
[6] Mikula.P,Svobodová Z,Smutná M.Phthalates:toxicology and food safety-a review[J].Food Sci.,2005,23:217-223.
[7]Lyche J L,Gutleb A C,Bergman A,et al.Reproductive and developmental toxicity of phthalates.[J].Toxicol.Environ.Health B Crit.Rev.,2009,12:225-249.
[8]Latini G.Monitoring phthalate exposure in humans[J].Clin.Chim.Acta,2005,361:20-29.
[9]Tanida T,Warita K,Ishihara K,et al.Fetal and neonatal exposure to three typical environmental chemicals with different mechanisms of action:mixed exposure to phenol,phthalate,and dioxin cancels the effects of sole exposure on mouse midbrain dopaminergic nuclei[J].Toxicol.Lett.,2009,189:40-47.
[10]McIntyre B S,Barlow N J,Wallace D G,et al.Effects of in utero exposure to linuron on androgen-dependentreproductive development in the male Crl:CD(SD)BR rat[J].Toxicol.Appl.Pharmacol.,2000,167:87-99.
[11]Parks L G,Ostby J S,Lambright C R,et al.The plasticizer diethylhexyl phthalate induces malformations by decreasing fetal testosterone synthesis during sexual differentiation in the male Rat[J].Toxicol.Sci.,2000,58:339-349.
[12]McIntyre B S,Barlow N J,Sar M,et al.Effects of in utero linuron exposure on rat Wolf an duct development[J].Reprod Toxicol.,2002,16:131-139.
[13]Hidetoyo T,Minoru K,Keiko A,et al.Toxicology letters[Z].1983.
[14]Ema M,Miyawaki E,Hirose A,et al.Decreased anogenital distance and increased incidence of undescended testes in fetuses of rats given monobenzyl phthalate,a major metabolite of butyl benzyl phthalate[Z].2003.
[15]Steru L,Chermat R,Thierry B,et al.The tail suspension test:a new method for screening antidepressants in mice[J].Psychopharmacology(Berlin),1985,85(3):367-379.
[16]Poreolt RD,Anton G,Blavot N.Behavioral despair in rats:a new model sensitive to antidepressant treatments[J].Eur.J.Pharmacol.,1978,47(4):379-391.
[17]聂金雷,时庆德.利用荧光探针直接测定线粒体活性氧的形成 [J].中国应用生理学杂志,2002,18(2):196-198.
[18]Tandon V,Gupta R K.Effect of Vitex negundo on oxidative stress.Indian[J].Pharm.,2005,37:38-40.
[19]张志良.植物生理学实验指导(第二版)[M].北京:北京高等教育出版社,1990.
[20]马 萍.纳米Fe3O4对小鼠肺细胞的氧化损伤 [J].生态毒理学报,2012,7(1):44-48.
[21]李文英.大鼠海马神经元参与学习记忆能力的机制及影响因素的研究进展 [J].四川解剖学杂志,2012,20(1):32-35.
[22]McAuliffe J J,Miles L,Vorhees CV.Adult neurological function following neonatal hypoxiaischemia in a mouse model of the term meonate:water maze performance is dependent on separable cognitive and motor components[J].Brain Res.,2006,1118(1):208-221.
[23]Gray LE Jr,Ostby J,Furr J,et al.Perinatal exposure to the phthalates DEHP,BBP,and DINP,but not DEP,DMP,or DOTP,alters sexual differentiation of the male Rat[J].Toxicol.Sci.,2000,58:350-365.
[24]Wormuth M,Scheringer M,Vollenweider M,et al.What are the sources of exposure to eight frequently used phthalic acid esters in Europeans[J].RiskAnal.,2008,6:803-814.
[25]王 婧,曾 强,杨 旭.邻苯二甲酸丁基苄酯致大鼠肺细胞氧化损伤作用的体外研究 [J].医学研究杂志,2009,38(09):16-18.
[26]李文兰,季宇彬,姜安玺,等.环境激素领苯二甲酸丁基苄酯在动物脏器中的代谢 [J].哈尔滨工业大学学报,2005,37(12):1674-1678.

