拟蜘蛛牵丝蛋白基因单体(S)原核表达及多克隆抗体制备
孟凡华 房君 王海涛 邢燕平 齐昱 周欢敏
(内蒙古农业大学生命科学学院,呼和浩特 010018)
蜘蛛牵丝是目前已知的最为坚韧的天然纤维之一。它具有优异的机械特性,其超强的强度和出色的弹性是其它天然和人工材料所无法比拟的。它的强度非常高,同等重量的蜘蛛牵丝强度是钢的5倍。蜘蛛牵丝优异的机械特性使它在军工、医疗、建材和纺织等行业具有广阔的应用前景。1996年,美国首先在Science杂志上发表3篇文章相继揭示了棒络新妇蛛牵丝蛋白的分子结构,发现其为复合蛋白,氨基酸组成为多重复序列,很难获得完整的基因序列[1-3]。接着各国科学家就根据发表的部分片段人工合成拟蛛丝基因,生产蛛丝蛋白[4]。人工生产蛛丝的主要载体有大肠杆菌[5],酵母[6],植物[7,8],哺乳动物乳腺[9]和桑蚕[10]等。目前,对于蛛丝的研究主要集中在如何通过原核或真核表达获得大量的拟蛛丝蛋白,用于纺出机械性能接近天然蛛丝的人工蛛丝[11,12]。利用原核表达获得的拟蛛丝蛋白,既可以制备多克隆抗体用于体外定性定量检测拟蛛丝蛋白的真核表达,也可用于人工纺丝研究。国内关于原核生物表达拟蛛丝蛋白的研究较多,如李敏[13]、郭廷晴[14]、许红韬[15]、罗芳[16]和施长华[17]等都有相关研究论文刊出。本研究以pGEX-2T为骨架载体,构建含有GST标签的拟蛛丝蛋白基因单体(S)原核表达载体pGEX-S;同时利用IPTG诱导重组质粒pGEX-S在大肠杆菌感受态细胞BL21中表达,并对所表达目的蛋白进行Western blot检测和纯化;用纯化后的融合蛋白制备抗血清,此研究将为人们在真核水平检测拟蜘蛛牵丝蛋白表达情况奠定基础。
1 材料与方法
1.1 材料
拟蜘蛛牵丝蛋白基因单体(S)人工合成(上海生工),片段大小为536 bp;pGEX-2T载体(本实验室保存);BL21菌种(本实验室保存);质粒小提试剂盒(TIANGEN);胶回收试剂盒(TIANGEN);感受态制备试剂盒(TAKARA);蛋白提取试剂盒(QIAGEN);蛋白纯化试剂盒(BBI);弗氏佐剂(Sigma);GST一抗(Sigma);羊抗兔二抗(生工生物);显色液TMB可溶单组分(TIANGEN)。
1.2 方法
1.2.1 原核表达载体的构建 根据发表的基因片段,人工合成了棒络新妇蛛拟蛛牵丝蛋白基因单体(S),片段长度为525 bp。两端加了相应酶切位点。连接到克隆载体pUC57上,即为pUC57-S。采用BamH I和SmaI双酶切pGEX-2T和pUC57-S,同时切开载体和切下基因,然后通过电泳、胶回收、连接和转化等即可获得基因单体S的原核表达载体pGEX-S。载体图谱如图1所示。
1.2.2 重组质粒鉴定 酶切鉴定:利用BamH I和SmaI双酶切重组质粒pGEX-S,经电泳检测若能切下插入片段S则能初步说明载体构建正确。由于没设计引物,下一步直接进行测序。 委托上海生工完成测序。目的蛋白诱导表达:用测序正确的的重组质粒pGEX-S转化BL21感受态细胞,涂LB(AMP+)平板,37℃倒置培养过夜。次日挑取单菌落于LB(AMP+)液体培养基中37℃,150 r/min振摇培养,直到菌液在600 nm处的吸光值OD600=0.8-1.0。然后加入IPTG至其终浓度为0.1 mmol/L, 25℃ 180 r/min振摇培养4-5 h,诱导融合蛋白的表达。
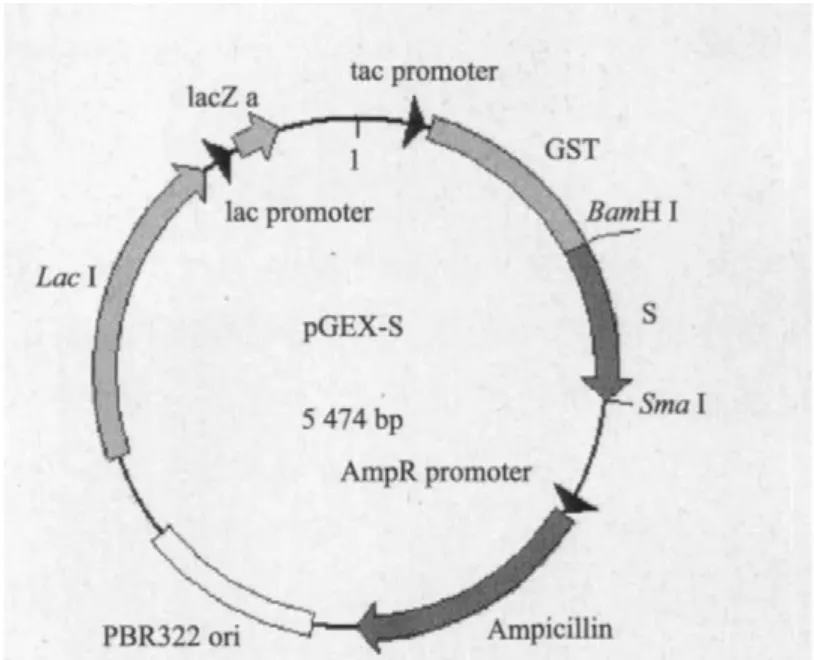
图1 原核表达载体pGEX-S
1.2.3 融合蛋白的提取与纯化 蛋白提取参照试剂盒 Bacterial Protein Prep Kit(QIAGEN)
1.2.4 SDS-PAGE与Western blot检测 详细步骤见分子克隆实验指南。
1.2.5 多克隆抗体制备
1.2.5.1 抗原浓度测定 抗原浓度测定选用Bradford法。首先利用配制不同浓度的牛血清白蛋白(BSA)溶液绘制标准曲线,抗血清稀释后按上述方法测定OD595,对照标准曲线,求得融合蛋白S-GST含量。
1.2.5.2 免疫前处理 选取8只健康的雄鼠小白鼠CDⅠ,用断尾的方法采集免疫前血液,分离血清,放置于-20℃冰箱保存作为阴性对照。
1.2.5.3 免疫 每只小鼠取50 µg的免疫抗原,加入200 µL的生理盐水再加入250 μL完全弗氏佐剂混匀后用针管反复抽吸,至乳化完全后,多点皮下免疫小白鼠,此为初免;初免10 d后把改用不完全弗氏佐剂混合并乳化,进行二免;用同样的方法在二免10 d后进行三免和四免。
1.2.5.4 采血 免疫期结束后,同样采取断尾的方法收集免疫后小鼠的血液,离心分离血清,做ELISA检测。
1.2.6 ELISA检测 采用ELISA间接法测定抗体效价,详细步骤见分子克隆实验指南,以待测血清OD450值为阴性对照2倍以上判为阳性。
2 结果
2.1 酶切鉴定
采用BamH I和SmaI双酶切pUC57-S和载体pGEX-2T。胶回收S和线性载体pGEX-2T,采用T4连接酶连接回收的基因片段S和载体片段pGEX-2T,转化涂板后,次日共挑6个单菌落,编号为pGEXS-1、pGEX-S-2、pGEX-S-3、pGEX-S-4、pGEX-S-5 和pGEX-S-6酶切鉴定。酶切产物电泳结果如图2所示,pGEX-S-4和pGEX-S-6切出了550 bp和5000 bp两条带,其余酶切结果与目的片段大小不符,初步确定pGEX-S-4和pGEX-S-6重组质粒正确。
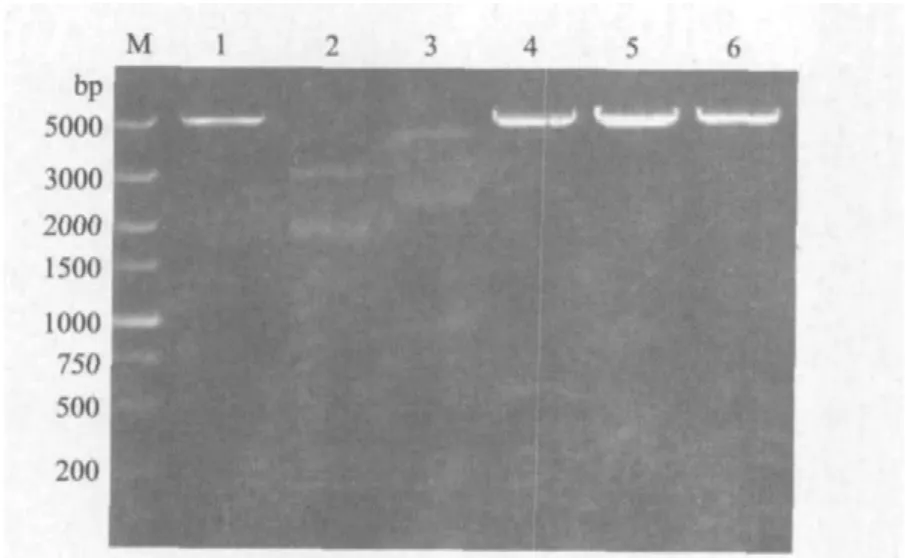
图2 pGEX-S酶切鉴定
2.2 测序
将酶切鉴定正确的质粒pGEX-S-4和pGEX-S-6送上海生工测序。将测序结果与合成的基因单体(S)进行序列比对(序列比对结果略),结果显示序列完全匹配,确定载体构建成功。
2.3 SDS-PAGE与Western blot检测
用IPTG诱导质粒pGEX-S-6 表达,提取蛋白后进行Tris-甘氨酸-聚丙烯酰胺凝胶电泳和Western blot检测。共配制两块胶,一块胶用于考马斯亮蓝染色,染色结果如图3所示,5、6泳道在43 kD下面有目的蛋白条带出现(实际的大小是41 kD);另一块胶做Western blot,结果如图4所示,5、6泳道在41 kD处出现杂交带。
2.4 纯化后蛋白Western blot检测和浓度测定
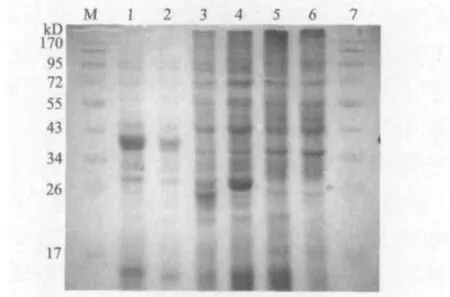
图3 SDS-PAGE电泳图
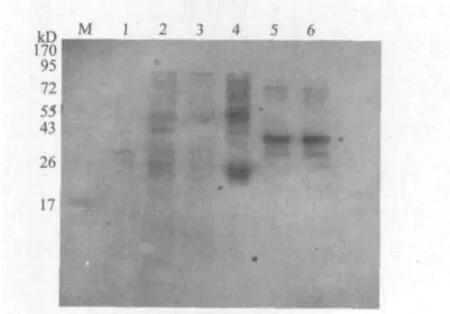
图4 融合蛋白杂交图
取鉴定后的单菌落摇菌,提蛋白后利用GST亲和层析的方法分离纯化蛋白,进行SDS-PAGE电泳后做Western blot检测,可见1、2、3泳道在41 kD处有明显杂交带出现,其它杂蛋白信号较弱(图5),认为蛋白纯化成功,为了确定免疫剂量,利用考马斯亮蓝法测定了融合蛋白的浓度,为1 356 µg/mL,图6为蛋白标准曲线。

图5 纯化蛋白杂交图
2.5 ELISA检测结果
4免结束后,取8只小白鼠的血液,离心分离血清,分别稀释了500、1000、2000和5 000四个梯度,阴性血清做对照,用间接ELISA法测定抗体活性。以测定组OD450为阴性对照组两倍判定为阳性,从表1中可以看出稀释5 000倍后A和F小鼠抗体OD符合判定标准,为阳性血清,可用于后续试验。
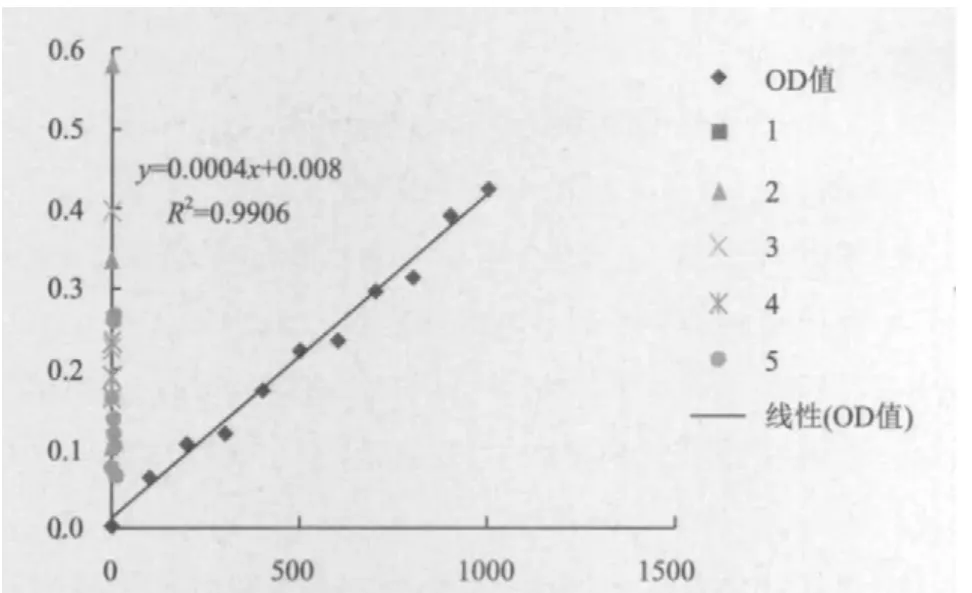
血清稀释度图6 BSA蛋白标准曲线
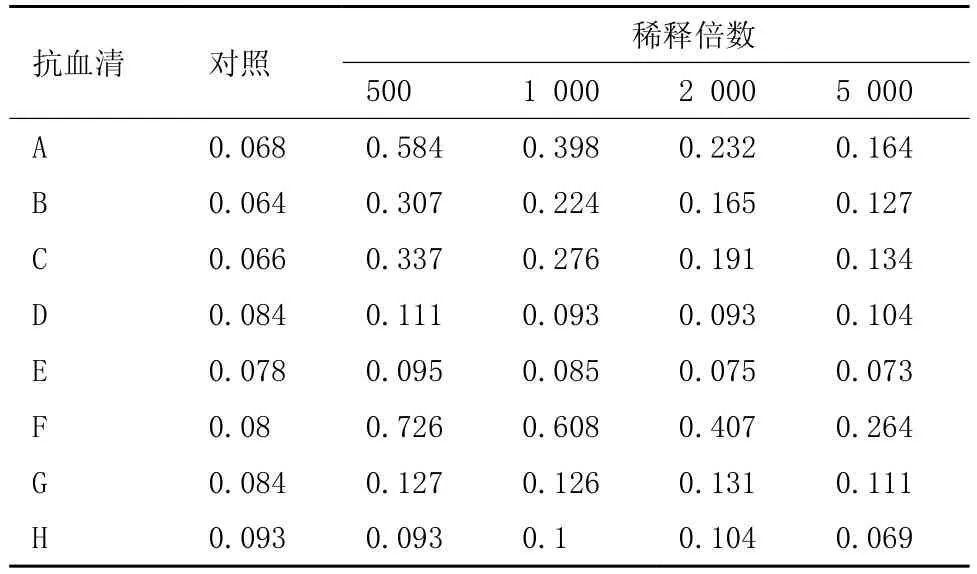
表1 血清的ELISA检测结果(OD450值)
3 讨论
牵丝蛋白主要由有序的结晶区(小分子的侧链为主,多为β片层)和无序的非结晶区(大分子侧链为主)交替排列,这种结构方式可使丝承受的张力并不直接落在多肽链的共价键上,从而赋予蛛丝很好的抗张强度、较高的强力和韧性[18]。Xu等[19]从棒络新妇蛛牵丝蛋白中分离出两种成分,分别命名为MaSp1和MaSp2,其中MaSp1中β 片层相交替,使牵丝保持高强度,而MaSp2中α-螺旋含量上升,使牵丝弹力大大增加。我们在设计拟蜘蛛牵丝蛋白单体(S)时,兼顾其两方面的特性,根据文献报道进行了最佳配比,其比例为3∶2。同时为了增加蛋白的溶解性,在重复序列两端我们还插入了丝氨酸和甲硫氨酸,以利于表达产物的分离纯化。
Western blot高背景一直是蛋白印迹中棘手的问题,我们经过几次反复试验发现,要想有效避免,第一:控制诱导时间,由于牵丝蛋白的表达量与诱导时间和菌体生长量呈正相关,诱导时间过长,蛋白质极易降解,所以应将诱导表达时间控制在表达量较高而时间较短时,不宜超过4 h,否则杂蛋白表达量会明显增多,影响结果的观察;第二:点样量尽量减少,要控制在3-8 μL之间;第三:转膜完毕后,在后续的试验中应注意膜的保湿,避免膜的干燥;第四:抗体的稀释倍数要在6 000倍以上;第五:显色时间要控制好,否则极易出现高背景。在纯化蛋白Western blot时,我们采取了逐一减少点样量的策略,结果发现点样量减少背景带较少,但第四泳道点样量减少至2 µL时,杂交信号太弱,不易观察。
蜘蛛牵丝蛋白作为一种得天独厚的新型生物材料已逐渐引起人们的关注,但由于蜘蛛本身难于规模饲养,天然牵丝蛋白的获得很不容易。为此,一些研究者通过揭示蜘蛛丝性质与结构的关系,期望以人工合成的方式替代丝蛋白。而利用基因工程手段又是获取大量蜘蛛牵丝蛋白的有效的途径。本试验通过对重组牵丝蛋白在大肠杆菌中表达做了研究,同时又利用其制备了多克隆抗体,为大规模培养获取大量牵丝蛋白提供参考,同时也为在真核水平检测蜘蛛牵丝蛋白基因的表达打下基础。
4 结论
(1)构建了原核表达载体pGEX-S。(2)诱导表达后进行聚丙烯酰胺凝胶电泳和Western blot检测显示目的蛋白表达。(3)利用S-GST蛋白免疫小白鼠CDⅠ成功制备了多克隆抗体。
[1] Simmons AH, Michal CA, Jelinski LW. Molecular orientation and two-component nature of the crystalline fraction of spider dragline silk[J]. Science, 1996, 271(1):84-87.
[2] Guerette PA, Ginzinger DG, Weber BH, Gosline JM, et al. Silk properties determined by gland-specific expression of a spider fibroin gene family[J]. Science, 1996, 272(5258):112-115.
[3] Tirrell DA. Putting a new spin on spider Silk[J]. Science, 1996,271(1):39-40.
[4] Prince JT, Mcgrath KP, Kaplan DL. Construction, cloning and expression of synthetic genes encoding spider dragline silk[J].Biochemistry, 1995, 34:10879-10885.
[5] Yang YJ, Choi YS, Jung D, et al. Expression of redesigned mussel silk-like protein inEscherichia coli. Korean J chem Eng, 2011, 28(8):1744-1748.
[6] 田保中, 汪生鹏, 王建南, 等.类蜘蛛丝丝素蛋白SPF198在毕赤酵母中的分泌表达[J].蚕业科学, 2006, 32(2):276-279.
[7] Piruzian ES, Bogsh VG, Sidoruk KV, et al.Construction of the syntheic genes or Protein analogs of spider silk carcass spidroin and their expression in tobaceo plants[J]. MolBiol(Mosk), 2003, 37(4):654-662.
[8] Seheller J, Gührs KH, Grosse F, et al. Produetion of spider silk proteins in tobaceo and potato[J].Nat Bioteehnol, 2001, 19(6):573-577.
[9] Anthoula L, Steven A, Yue H, et al. Spider silk fibers spun from soluble recombinant silk produced in mammalian cells[J].Science, 2002, 18(1):472-476.
[10] Yamo M, Katayama N, Nakazawa H, et al. Gene targeting in the silkworm by use of a baculovirus[J].Genes & Eev, 1999, 13:511-559.
[11] Seidel A, Liivak O, Calve S, et al. Regenerated spider silk:processing properties and structure[J]. Macromolecules, 2000(33):775- 780.
[12] Vollrath F, Knight DR. Liquid crystalline spinning of spider silk[J]. Nature, 2001, 410:545-548.
[13] 李敏, 章文贤, 黄智华, 等.蜘蛛拖丝蛋白基因的构建及在大肠杆菌中的表达[J]. 生物工程学报, 2002, 18(3)∶331.
[14] 郭廷晴, 赵昀, 汪生鹏, 等.兔抗仿蜘蛛牵丝蛋白抗体的制备及应用[J]. 生物化学与生物物理学报, 2003, 35(8):756-760.
[15] 许红韬.拟蜘蛛牵丝蛋白基因在大肠杆菌和小鼠乳腺表达研究[D].北京:中国农业大学, 2004.
[16] 罗芳.二聚化蜘蛛拖丝蛋白的原核表达纯化及多克隆抗体的制备[D].哈尔滨:东北林业大学, 2010.
[17] 施长华.蛛丝蛋白基因在大肠杆菌中表达研究[J].生物学杂志 , 2011,(1):26-30.
[18] Hinman MB, Jones JA, Lewis RV. Synthetic spider silk:amodular fiber[J].Trends Biotechnol, 2000, 18:374-379.
[19] Xu M, Lewis RV. Structure of aprotein super fiber:spider dragline silk[J].Proc Narl Acad Sci, 1990, 87:7120-7124.

