射频消融联合肝动脉栓塞化疗对无手术切除机会原发性肝癌的治疗价值*
钟以胜 孙斐予 曾明亮 董小强 熊共鹏
(厦门中医院肝外科,福建 厦门 361009)
迄今为止原发性肝癌的首选治疗方法仍是外科手术切除,但临床中大约70%~80%的患者一旦诊断为原发性肝癌就已经进入了癌症II期甚至III期,大多患者已经失去了根治性手术切除甚至手术切除的机会,只能采取非手术治疗措施。但近年在肿瘤综合治疗取得长足进展的背景下,许多非手术切除的治疗方法也逐渐被临床医生所采纳和认可。例如经皮射频消融术(radiofrequency ablation,RFA)[1]和肝动脉栓塞化疗(transcatheter hepatic arterial chemoembolization, TACE),在临床实践中越来越广泛应用于原发性肝癌的治疗。本研究旨在探讨射频消融联合肝动脉栓塞化疗对患者免疫功能的影响和临床意义。
1 资料与方法
1.1一般资料 2008年5月至2012年 7月,选择经病理或临床证实的原发性肝癌患者74例进入本研究。单个癌灶不超过9.0 cm,多个病灶数目不超过4个,直径不超过5.0 cm。肿瘤最大径6.0~8.0 cm,平均(5.4±0.5)cm。男52例,女22,年龄41~79岁,平均(63.0±8.5)岁。患者因年龄,心、肺功能障碍,肿瘤大小、数目、位置等原因未获宜手术治疗机会。对照组41例行单纯TACE治疗,联合组33例先行TACE治疗后再行RFA治疗。两组病例的平均年龄、病灶大小、数目以及肝功能分级、术前血清AFP经检验差异无统计学意义。
1.2治疗方法 TACE组:运用Seldinger技术,经皮股动脉穿刺导管尽可能超选肿瘤供血动脉进行栓塞化疗术,常用化疗药物为5-Fu 1000 mg、表阿霉素20 mg、顺铂40 mg,栓塞剂为超液化碘油5~20 ml和2 mm2的明胶海绵颗粒,一般治疗1~2次。联合组(TACE+RFA): 经常规检查及完善术前相关准备后,先行TACE治疗,方法及使用药物同前,视患者肝功能分级及全身反应情况,行1~2次治疗。根据肝功能恢复情况在1~2周内再接受RFA治疗,射频治疗仪为美国RADIONICS公司生产的冷循环超能射频肿瘤治疗系统(Cool-tip RF System),功率200 W,频率480 kHz, 采用冷循环射频脉冲发送方式,射频时间为12 min。在超声导引下,采用经皮途径。所有研究组病例均经过射频治疗2次及2次以上。
1.3检测指标 所有病例及时记录TACE组和联合组的并发症,密切观察患者免疫功能的变化和临床疗效。检测指标:①治疗前和治疗后4周检测两组外周血CD4+、CD8+、CD4+/CD8+的变化;②治疗前和治疗后4周进行增强CT/MRI检查观察肿瘤坏死范围的改变,以cm表示;③两种方法治疗后12周检测患者血清AFP的变化,以μg·L-1表示;④两种方法治疗后患者的术后生存时间,以月表示。
1.4疗效判断 所有病例以影像学检查结果和肿瘤血清学结果为判断标准,肿瘤坏死范围以CT/MRI结合彩色多普勒血流显像(CDFI)检测为准。病灶坏死:治疗后4周CT/MRI增强示病灶在增强后不强化,CDFI检查病灶内无血流,整个病灶回声增强。
2 结 果
2.1免疫功能的变化情况 单纯TACE组治疗前后CD4+、CD8+、CD4+/CD8+差异均无统计学意义(P>0.05)。联合组治疗前后CD4+、CD4+/CD8+、CD8+差异均有统计学意义(P<0.05,表1)。
2.2术后肿瘤的生物学行为 TACE组与联合组术后肿瘤坏死范围分别为(0.27±0.06)cm和(2.06±0.24)cm,二者之间差异有统计学意义(P<0.01)。联合组术后血清AFP含量为(53.24±7.92)μg·L-1,与TACE组术后血清AFP含量(374.72±23.11)μg·L-1相比差异有统计学意义(P<0.01)。
2.3术后患者的平均生存期分析 TACE组术后平均生存时间11.7月,联合组术后平均生存时间19.5月,二者之间差异有统计学意义(P<0.01,表2)。
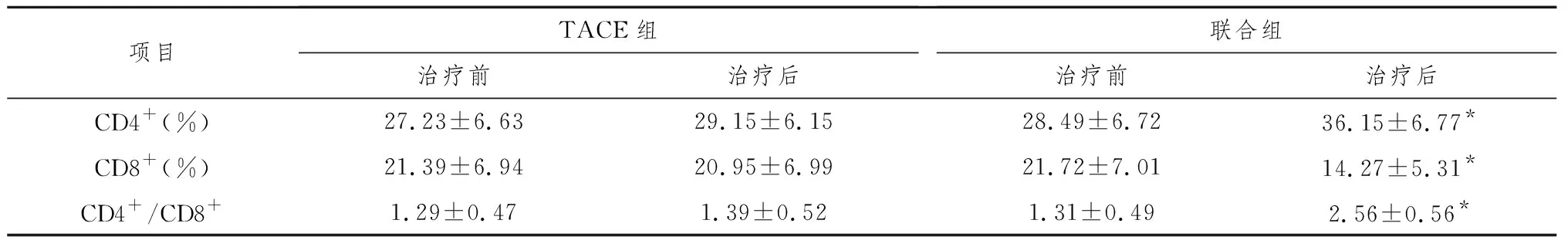
表1 两种方法治疗前后患者免疫功能的改变
注:与治疗前比较,*P<0.05。

表2 两种方法处理后患者平均生存时间的比较
注:与TACE组比较,##P<0.01,采用Kaplan-Meier法计算预期生产率并预测平均生存期。
3 讨 论
临床上对无手术切除指征的肝癌患者单纯进行TACE治疗,肿瘤完全坏死率低,而且往往需要经过反复多次的TACE治疗,伴随着化疗药物使用后带来的严重毒副作用以及碘油栓塞引发的肝脏缺血再灌注损伤[2],常常会引起患者全身免疫力的降低、严重的肝功能损害甚至肝功能衰竭等并发症,加速了病情恶化的倾向,使得患者无法再次接受后续治疗,甚至直接危及生命。
射频消融术是在B超或者CT的帮助下引导射频电极经皮穿刺入肿瘤内及富血供的肿瘤周围以及卫星灶,根据医疗技术操作者的经验,发挥三维适形或立体布针的作用,利用射频热消融效应造成肿瘤组织凝固性坏死而达到治疗肿瘤的目的。RFA应用于无手术切除机会的原发性肝癌,对直径<3.0 cm肝癌的治疗疗效已经得到充分肯定。对于直径>5.0 cm的大肝癌在临床上无手术指征时,单纯RFA治疗由于易残留和复发率高等问题而导致疗效欠佳,单纯采用TACE治疗也面临前述问题。这就对本研究带来了一个对临床疗效再评价的好机会。在本研究中,联合组采用RFA与TACE两种方法治疗无手术切除机会的原发性肝癌,明显提高了肝癌治疗的临床疗效。联合组术后肝癌的完全坏死范围与单纯TACE组比较差异有显著性意义(P<0.01);联合组术后血清AFP含量与单纯TACE组比较差异亦有显著性意义(P<0.01)。联合组术后平均生存期(23.7月)与单纯TACE组(12.9月)比较差异亦有统计学意义(P<0.01)。据此分析可能是二者的协同作用提高了临床疗效。单纯RFA治疗时,由于受射频电极布针局限以及肝癌病灶周围富血供血流带走部分热量,减弱了RFA的效能。而先行TACE治疗可以突破射频布针的物理缺陷,同时缩减肿瘤血供屏蔽RFA的弱点,可以使热量集中于病灶,从而提高RFA的效能。同时,射频产生的高热也可以提高化疗药物对肿瘤细胞的杀伤性。有研究[3]表明,在肝癌动物模型中,应用RFA联合肿瘤内表阿霉素直接注射能明显增加消融范围,提高射频消融的疗效。而在单纯TACE治疗时,由于受限于化疗药物的毒副作用及肝功能损害,以及患者体质、免疫功能、门脉癌栓、肿瘤病灶乏血供或者侧枝循环血供等的影响,TACE的疗效并非常常令人满意。在联合组,TACE后间隔进行的RFA治疗,延长了TACE治疗间期患者肝功能受损的恢复时间,也保证在下一次行TACE术治疗时能够消除上次化疗药物残留带来副作用的风险。并且由于RFA治疗相对TACE术治疗局限,更减轻了TACE术引发的肝功能损害和免疫功能损害。因此可见RFA联合TACE既能够充分发挥彼此的协同效应又能够相互消除彼此的弱点,对提高临床疗效是肯定和有帮助的。
由于细胞免疫中CD4+T淋巴细胞介导的免疫杀伤作用在抗肿瘤免疫中发挥了重要作用,CD4+细胞可合成释放IL-2而杀伤肿瘤细胞,CD8+细胞则可以直接抑制B细胞合成抗体。在本研究中,我们通过观察治疗前后CD4+、CD8+、CD4+/CD8+的变化也证实了联合治疗能明显改善患者的免疫功能。单纯TACE组治疗前后CD4+、CD8+、CD4+/CD8+均无显著性差异(P>0.05),而联合组治疗前CD4+为28.49%±6.72%,治疗后CD4+为36.15%±6.77%,二者之间差异有显著性意义(P<0.05)。联合组CD4+/CD8+治疗前(1.31±0.49),与治疗后(2.56±0.56)差异有统计学意义(P<0.05)。联合组CD8+治疗前(21.72%±7.01%)与治疗后(14.27%±5.31%)差异有统计学意义(P<0.05)。本研究说明,RFA联合TACE明显提高患者机体的抗肿瘤免疫力。其发生机制,目前学者认同的有以下观点:①患者全身情况的改善有利于免疫功能的恢复,尤其是RFA属于相对局部治疗,易于操作,创伤小,能减少因频繁行单纯TACE术造成的免疫功能破坏;②RFA在局部释放出大量热量,可能使肿瘤细胞表面抗原决定簇暴露[4],从而增加肿瘤的抗原性;③肿瘤细胞的灭活使机体免疫状态的抑制得到缓解[5];④肿瘤热疗后可以合成一种应激性蛋白-热休克蛋白HSP70,使肿瘤特异性抗原呈递作用增强,刺激机体的免疫系统,提高机体抗肿瘤免疫能力[6]。
综上所述,RFA联合TACE疗效是肯定的,同时可明显改善患者的免疫功能,加之RFA在B超等引导下容易操作,并发症少,更容易为患者所接受,越来越受到临床医生的欢迎。同时,RFA也为术中难以切除的肿瘤病灶和可疑未切除的小病灶提供了术中射频的补充手段[7],也能够配合肝癌切除术后复发肿瘤小病灶的治疗,逐渐成为肝癌非手术治疗中很重要的手段之一。因而,原发性肝癌的联合治疗在临床治疗策略中越来越具有指导意义。
[1] Seienfeld J, Korn A, Aronson N. Radiofrequency ablation of unresectable primary liver cancer[J]. Journal of the American College of Surgeons, 2002,194(6):813-828.
[2] Yi J, Liao X, Yang Z, et al. Study on the changes in microvessel density in hepatocellular carcinoma following transcatheter arterial chemoembolization[J]. Journal of Tongji Medical University, 2001, 21(4):321-322.
[3] Meloni MF, Goldberg SN, Moser V, et al. Colonic perforation and abscess following radiofrequency ablation treatment of hepatoma[J]. Europe Journal of Ultrasound, 2002,15(1-2):73-76.
[4] Dromi SA, Walsh MP, Herby S, et al. Radiofrequency ablation induces antigen-presenting cell infiltration and amplification of weak tumor-induced immunity[J]. Radiology,2009,251(1):58-66.
[5] Willemsen RA, Debets R, Chames P, et al. Genetic enginering of T cell specificity for immunotherapy of cancer[J]. Human Immunology, 2003,64(1):56-68.
[6] Menoret A. Purification of recombinant and endogenous HSP70s[J]. Methods, 2004,32(1):7-12.
[7] Machi J, Uchida S, Sumida K, et al. Ultrasound-guided radiofrequency thermal ablation of liver tumors: percutaneous, laparoscopic, and open surgical approaches[J]. Journal of Gastrointestinal Surgery, 2001,5(5):477-489.

