Rheb突变体重组腺病毒载体的构建及鉴定*
赵 莉 邹镇洪 叶永斌 侯敬申
(1.广州医科大学药学院蛇毒研究所,广东 广州 510182; 2.南方医科大学基础医学院细胞生物学教研室,广东 广州 510515;3.广州医科大学附属第二医院急诊外科,广东 广州 510260)
Rheb(Ras homolog enriched in brain)是一种Ras蛋白,在结节性硬化症(tuberous sclerosis complex, TSC)相关蛋白TSCl/TSC2和多功能丝氨酸/苏氨酸蛋白激酶哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)之间传递信号。Rheb通过与mTOR的内源性抑制分子FKBP38结合活化mTOR通路[1],进而使其下游靶标S6K1(40S ribosomal S6 kinase 1)和4E-BP1(eukaryotic translation initiation factor 4E-binding protein 1)的磷酸化,从而调控蛋白质合成,细胞生长、增殖、迁移和分化[2]。
肿瘤细胞的一个显著特征是增殖能力明显增强,通过抑制Rheb活性进而使阻断mTOR信号转导通路有可能使细胞增殖减慢,起到延缓癌症进展的目的[3]。本研究采用复制缺陷型腺病毒作为基因表达载体,构建携带Rheb显性失活型突变体的重组腺病毒载体,通过转染人乳腺癌细胞MCF-7,验证Rheb及其下游蛋白的表达;将包装病毒颗粒感染乳腺癌细胞MDA-MB-231,观察其在无血清时的增殖情况,为体内外研究Rheb基因对mTOR通路的作用及乳腺癌的基因治疗奠定基础。
1 材料与方法
1.1质粒与菌株 大肠杆菌E.coli TOP10菌株及携带野生型Rheb或Rheb突变基因的原始质粒pCDNA3.1-flag-Rheb-WT、pCDNA3.1-flag-Rheb-D60K和 pCDNA3.1-flag-Rheb-Q64L(南方医科大学细胞生物学教研室保存);穿梭质粒pacAd5 CMVK-NpA、pacAd5 CMV-GFP Control Vector、腺病毒骨架载体pacAd5 9.2-100(New England Biolabs);病毒包装细胞HEK-293 AD-100细胞(Cell BioLabs);人乳腺癌细胞株MCF-7及MDA-MB-231(上海细胞库)。
1.2酶及其他生化试剂 限制性内切酶EcoRⅠ、XhoⅠ和PacⅠ(New England Biolabs);T4 DNA ligase、DNA纯化回收试剂盒(TaKaRa);1 kb plus DNA Ladder(天根生化科技(北京)有限公司);质粒DNA小/中提试剂盒(深圳市易瑞生物技术有限公司);脂质体LipofectamineTM 2000(Invitrogen);DMEM高糖细胞培养基(赛默飞世尔生物化学制品(北京)有限公司);胎牛血清(GIBCO);腺病毒纯化试剂盒(Cell BioLabs);Rheb单克隆抗体(MILLIPORE Cat.#09-247);β-actin多克隆抗体(SIGMA Cat.#A2668);S6多克隆抗体(SANTA CRUE BIOTECHNOLOGY Cat.#SC-74459);P-S6多克隆抗体(CELL SIGNALING TECHNOLOGY Cat.#2211);辣根过氧化物酶标记(HRP)-兔二抗(北京中杉金桥生物技术有限公司)。PCR引物合成及基因片段测序由上海生工生物工程技术服务有限公司完成。四甲基偶氮唑盐(MTT)为Amresco进口分装。
1.3重组质粒pacAd5 CMV-Rheb的构建与鉴定 取pacAd5 CMVK-NpA和pCDNA3.1-flag-Rheb-WT质粒,分别经EcoRⅠ、XhoⅠ双酶切,将目标片段电泳回收、纯化;将pacAd5 CMVK和Rheb-WT片段用T4 DNA ligase 16 ℃定向连接过夜,连接产物转化感受态细胞,培养过夜,随机挑选菌落,扩增、小量提取质粒,用EcoRⅠ/XhoⅠ 双酶切筛选含Rheb基因片断的重组质粒pacAd5 CMV-Rheb-WT,将酶切初步鉴定阳性的质粒送测序。同样的方法获得pacAd5 CMV-Rheb-D60K和pacAd5 CMV-Rheb-Q64L。
1.4pacAd5-GFP和pacAd5-Rheb重组腺病毒的包装、扩增与纯化 转染前1 d,将HEK-293 AD-100细胞接种于60 mm培养皿中,常规培养至70%~80%融合。分别取pacAd5 CMV-GFP和pacAd5 9.2-100质粒,经PacⅠ酶切线性化,LipofectamineTM 2000脂质体共转染。当细胞出现完全细胞病变效应时,收集细胞,于-80 ℃与37 ℃反复冻融3次,由此获得第一代pacAd5-GFP腺病毒。将第一代腺病毒感染HEK-293 AD-100细胞进行反复扩增,-70 ℃冻存备用。同样的方法获得pacAd5-Rheb-WT、pacAd5-Rheb-D60K和pacAd5-Rheb-Q64L重组腺病毒。
1.5pacAd5-GFP和pacAd5-Rheb重组腺病毒的PCR扩增及鉴定 取纯化的pacAd5-GFP对照病毒与pacAd5-Rheb病毒上清液各5 μl,分别与1 μl蛋白酶K(20 g·L-1)在55 ℃的温水中水浴1 h,100 ℃煮沸5 min。离心后取1 μl上清稀释液为模板,使用引物5′-CCGCTCGAGACCATGGACTACAAAGACCATCATGACG-3′(p1)和5′- AGCATTGAATTCTCACATCACCGAGCATGAAGA-3′(p2)。PCR扩增Rheb基因。产物大小约为555 bp。
1.6pacAd5-Rheb在MCF-7细胞中的表达及免疫印迹鉴定 将MCF-7细胞以5×106/孔密度接种于6孔板中,待融合至80%~90%密度时, 加入病毒感染(包括对照病毒及磷酸盐缓冲液)。 48 h后收集细胞,抽提总蛋白,进行Western blotting检测。
1.7重组腺病毒介导Rheb的过表达和功能抑制对乳腺癌细胞MDA-MB-231无血清条件下增殖的影响 调整MDA-MB-231细胞浓度为3×104个/ml,接种于96 孔板,每孔100 μl,每组设6个平行孔。培养24 h待细胞贴壁后,血清饥饿,分别加入pacAd5-Rheb-WT、pacAd5-Rheb-D60K、pacAd5-Rheb-Q64L和pacAd5-GFP重组腺病毒,继续培养48 h后,弃去培养基,每孔加入20 μl MTT(2 mg/ml)。37 ℃孵育4 h,弃去MTT溶液,每孔加入150 μl二甲基亚砜(DMSO),微孔板振荡器上振荡10 min,待结晶物完全溶解后,用酶标仪检测各孔在570 nm波长处的吸光度值A。
1.8统计学方法 采用SPSS13.0软件进行统计学分析。细胞体外增殖实验用重复测量数据的方差分析,两样本均数比较用t检验。
2 结 果
2.1重组质粒pacAd5 CMV-Rheb的构建与鉴定 携带Rheb目的基因的pCDNA3.1-flag-Rheb经EcoRⅠ和XhoⅠ双酶切后PCR扩增可获得大小为555 bp(Rheb)的单个片段(图1) 。穿梭质粒pacAd5 CMVK-NpA经 EcoRⅠ和XhoⅠ双酶切后可获得大小约为6.2 kb的单个片段(图2)。EcoRⅠ/XhoI 双酶切筛选携带Rheb基因片断的重组质粒pacAd5 CMV-Rheb,可获得大小分别为6.2 kb(pacAd5 CMV)和(500~700)bp(Rheb)之间的两个片段(图3)。将酶切后(500~700)bp(555bp)的基因片段经测序,证明为正确的目的片段。
2.2pacAd5 9.2-100质粒PacⅠ酶切线性化 取pacAd5 9.2-100质粒经PacⅠ酶切释放出一段大于20 kb(33 kb)的大片段和约2 kb的特征性小片段(图4)。

图1 原始质粒pCDNA3.1-flag-Rheb 经PCR后双酶切鉴定
M:DNA markers; 1:pCDNA3.1-flag-Rheb-WT; 2:pCDNA3.1-flag-Rheb-D60K;3:pCDNA3.1-flag-Rheb-Q64L
图2 穿梭质粒pacAd5 CMVK-NpA双酶切鉴定
M:DNA markers;1:pacAd5 CMVK-NpA
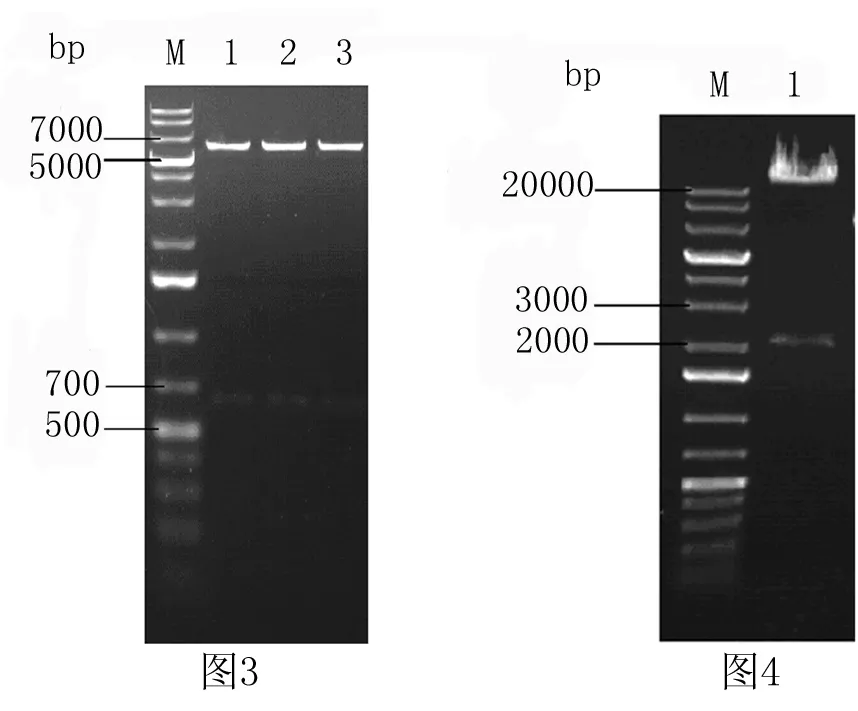
图3 重组质粒pacAd5 CMV-Rheb的双酶切鉴定
M:DNA markers;1:pacAd5 CMV-Rheb-WT;2:pacAd5 CMV-Rheb-D60K;3:pacAd5 CMV-Rheb-Q64L
图4 腺病毒骨架载体pacAd5 9.2-100的PacⅠ单酶切鉴定
M:DNA markers;1:pacAd5 9.2-100 backbone vector
2.3pacAd5-GFP和pacAd5-Rheb重组腺病毒的包装与扩增 转染后2 d,普通光源与倒置荧光显微镜下显示:感染了pacAd5-GFP病毒的HEK-293 AD-100细胞中有GFP表达,并随时间逐渐增强,8 d后细胞呈现明显细胞病变效应(cytopathic effect,CPE):细胞变圆,脱壁、变大,出现明显噬斑。
2.4pacAd5-GFP和pacAd5-Rheb重组腺病毒PCR鉴定 取pacAd5-GFP对照病毒与pacAd5-Rheb病毒上清液各5 μl,分别与1 μl蛋白酶K(20 g/L)在55 ℃的温水中水浴1 h,100 ℃煮沸5 min,高速离心后取1 μl上清稀释液为模板,以特异性引物进行PCR扩增,获得(500~700)bp(555bp)的特异性扩增条带(图5)。
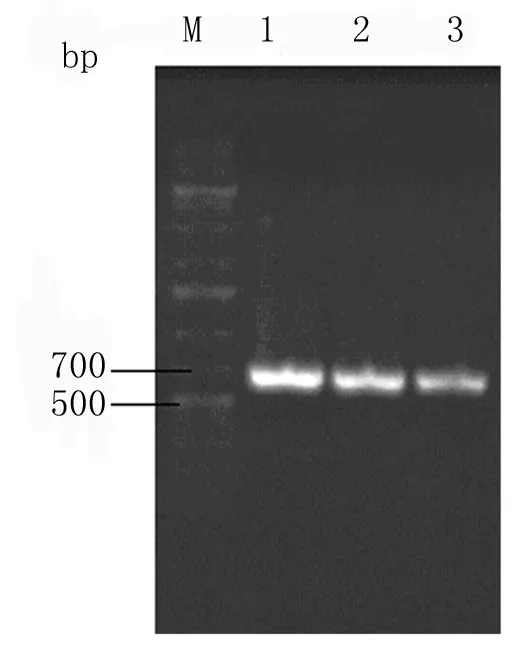
图5 pacAd5-GFP和pacAd5-Rheb突变体重组腺病毒上清Rheb基因的PCR鉴定
M:DNA markers;1:pacAd5-Rheb-WT;2:pacAd5-Rheb-D60K;3:pacAd5-Rheb-Q64L
2.5重组腺病毒pacAd5-GFP和pacAd5-Rheb在MCF-7细胞中的表达 取纯化后的pacAd5-GFP对照病毒及pacAd5-Rheb重组病毒,感染MCF-7细胞,结果表明Rheb重组病毒与GFP对照病毒均能较好感染MCF-7细胞,24 h时细胞状态均良好(图6)。GFP对照病毒组感染后24 h,MCF-7细胞内出现较多GFP表达,随时间增强。Western blotting结果显示,腺病毒感染的MCF-7细胞内Rheb蛋白表达较对照组明显增强,S6及β-actin蛋白的表达各组间没有显著性差异,而WT和Q64L组MCF-7细胞的P-S6表达较阴性对照组和D60K组显著增强 (图7)。

图6 重组pacAd5-GFP腺病毒感染乳腺癌MCF-7细胞株

图7 Western blot检测Rheb在MCF-7细胞株的表达
1:negative control(PBS); 2:pacAd5-Rheb-WT;3:pacAd5-Rheb-D60K ; 4:pacAd5-Rheb-Q64L
2.6感染Rheb突变体的重组腺病毒对无血清培养的乳腺癌细胞株MDA-MB-231增殖能力的影响 感染Q64L组的细胞在血清饥饿时增殖能力较对照组、WT和D60K组增强。而感染D60K组乳腺癌细胞增殖较其他组明显减慢(图8)。
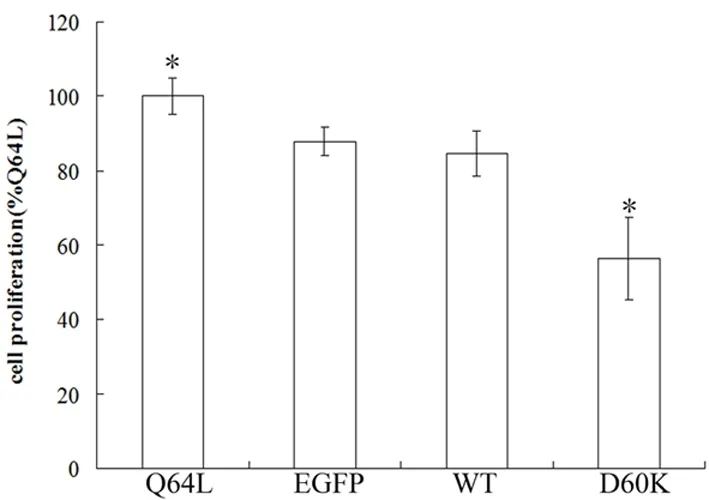
图8 感染Rheb突变体重组腺病毒对血清饥饿48h乳腺癌细胞株MDA-MB-231增殖的影响
*vs EGFP,P﹤0.05。
3 讨 论
mTOR是哺乳类动物中的一个高度保守的丝氨酸/苏氨酸蛋白激酶,是细胞生长过程中的中心调节因子,Rheb可以激活该通路[2]。对Rheb的结构及突变分析表明,Rheb的switch I、switch II结构域及一些氨基酸对其功能的发挥起重要作用,这些氨基酸位点的突变体可改变Rheb本身及对mTOR的活性,如Rheb Q64L、S16H起激活作用,而D60K、S20N、T38M、I39K、N41A为抑制其活性[4-5]。
由于腺病毒载体在实验动物及细胞上进行基因转移和蛋白表达的高效性,使其在基因治疗和临床研究中应用广泛,是使用最多的病毒载体之一[6]。复制缺陷型腺病毒载体既可以感染分裂细胞又可以感染非分裂细胞;感染效率高,容易制备高滴度的病毒粒子;不裂解靶细胞,重组腺病毒导入细胞的目的基因并不整合入宿主细胞染色体中。其在腺病毒中插入报告基因GFP,使得病毒感染效率检测简单方便[7]。本实验成功构建携带Rheb及其显性失活突变体的腺病毒表达载体,同时初步研究Rheb-D60K对乳腺癌细胞血清饥饿后增殖能力的影响。结果显示:腺病毒pacAd5-Rheb-D60K感染的MCF-7 细胞能使Rheb下游的S6 和P-S6蛋白表达减少;pacAd5-Rheb-D60K感染乳腺癌细胞MDA-MB-231后,在血清饥饿后细胞增殖明显变慢,这将为后续更好地研究Rheb基因对乳腺癌细胞生长、增殖、凋亡、分化调控及其信号转导通路的作用机制奠定坚实基础。
[1] Bai X, Ma D, Liu A, et al. Rheb activates mTOR by antagonizing its endogenous inhibitor, FKBP38[J]. Science,2007,318(5852):977-980.
[2] Laplante M, Sabatini D M. mTOR Signaling in Growth Control and Disease[J]. Cell,2012,149(2):274-293.
[3] Karassek S, Berghaus C, Schwarten M, et al. Ras homolog enriched in brain (Rheb) enhances apoptotic signaling[J]. J Biol Chem,2010,285(44):33979-33991.
[4] Ma D, Bai X, Guo S, et al. The switch I region of Rheb is critical for its interaction with FKBP38[J]. J Biol Chem,2008,283(38):25963-25970.
[5] Long X, Lin Y, Ortiz-Vega S, et al. The Rheb switch 2 segment is critical for signaling to target of rapamycin complex 1[J]. J Biol Chem,2007,282(25):18542-18551.
[6] 何金生,王健伟,洪涛. 腺病毒载体构建原理与方法的研究进展[J].中华实验和临床病毒学杂志,2001,15(6):399-401.
[7] Choi E W, Seen D S, Song Y B, et al. AdHTS: a high-throughput system for generating recombinant adenoviruses[J]. J Biotechnol,2012,162(2-3):246-252.

