11C-乙酸盐自动化合成改进工艺及PET/CT显像
甘满权,唐小兰,唐刚华,王红亮,胡孔珍
(1.广州医学院第一附属医院 PET/CT中心,广州 510230;2.华南农业大学 理学院,广州 510642; 3.中山大学附属第一医院 核医学科, 广州 510515)
11C-乙酸盐(11C-AC)是用于测定心脑氧化代谢、多种肿瘤 (如泌尿道肿瘤、头颈部癌、肝细胞癌等)类脂代谢的正电子发射断层(PET)显像剂,具有较高的灵敏度,优于2-18F-2-脱氧-D-葡萄糖(18F-FDG)[1-3]。国外已报道了多种11C-乙酸盐的自动化合成方法[4-12],国内也有文献[13]报道,主要有Loop环固相反应法和液相反应法,前体主要为溴化甲基镁和氯化甲基镁,改进处主要集中在11C-AC纯化方法。纯化方法有:1) 液-液提取法[14]。该法麻烦耗时,得到的11C-AC放化产率较低,合成时间较长,不便于实现全自动化生产。2) HPLC纯化法[15]。该法得到的11C-AC放化产率较高(校正产率约72%),放化纯度也高(>99%),但11C半衰期短,HPLC纯化耗时,合成时间较长,也不便于实现全自动化生产。(3)蒸馏法[5-6]。除去中间体11C-乙酰溴(或氯)化镁加合物中溶剂四氢呋喃后,加入酸并加热将11C-AC从溶液中蒸出。该法放化产率较低,合成时间较长,最终产品中可能含有机杂质11C-丙酮和11C-叔丁醇。(4) 固相小柱纯化法[4, 7-13, 16]。该法放化纯度、化学纯度和放化产率均较高,是目前合成乙酸盐最常用的方法。但是,该法可能生成AgCl或AgBr沉淀而造成管路堵塞和11C-AC合成失败,且终产品中需要加酸除11CO2并用碱中和,给11C-AC自动化生产带来不便。最近报道的液相反应结合中性氧化铝小柱纯化法[16],可弥补Loop环固相反应结合固相小柱纯化法的不足,但中性氧化铝小柱捕集11C-AC有限,也会损失部分11C-AC。本工作采用改进的Loop环合成11C-Ac,结合固相小柱水解纯化法,在国产碳-11胆碱/蛋氨酸合成模块中进行11C-AC的自动化合成,并建立简单放射性HPLC测定11C-AC放化纯度,为11C-AC自动化合成提供简便、快速、实用的合成工艺。
1 实验材料
碳-11胆碱/蛋氨酸自动化合成模块:派特北京科技有限公司;LC-10AT HPLC分析系统:日本Shimadzu公司产品,配有LB 508 型放射性流量探测器,德国EG&G公司产品;质检HPLC分析条件:Xdp-C18柱(4.5 mm×150 mm,5 μm),流动相为5%的乙腈溶液,流速为1 mL/min,紫外(UV)检测波长为214 nm,美国 Agilent公司;CS-9301 PC 薄层层析扫描仪:日本Shimadzu公司产品;γ计数仪:上海原子核研究所产品;CRC-15R型活度计:美国CAPINTEC公司产品;Sep-Pak C18小柱:美国Waters公司产品;掏空Sep-Pak Plus C18小柱和Sep-Pak Al2O3中性小柱:经消毒酒精和无菌水处理后,装载AG50w-X8树脂(H+型,Bio-Rad公司产品)或AG11A8离子滞留树脂,Bio-Rad公司产品,分别制作Sep-Pak Tscx小柱(600 mg)和Sep-Pak Tix小柱(1 200 mg);硅胶60薄层层析铝板:德国Merck公司产品;1.0 mol/L溴化甲基镁:Across Organics公司产品;NaOH、冰乙酸:分析纯,广州化学试剂公司;其他试剂为国产分析纯。
2 实验方法
2.1 合成方法
11C-AC合成路线示于图1。采用柱水解法自动化合成11C-AC。以溴化甲基镁为前体,在Loop环中与11CO2反应生成中间体11C-乙酰溴化镁加合物。该步不经纯化过程,通N2除净四氢呋喃(THF)后,加水依次通过一体化小柱(Sep-Pak Plus C18小柱、Sep-Pak Tscx小柱和Sep-Pak Tix小柱),中间体11C-乙酰溴(或氯)化镁在Sep-Pak Tscx小柱中发生进一步水解,并经一体化小柱分离纯化后,得11C-AC 注射液。
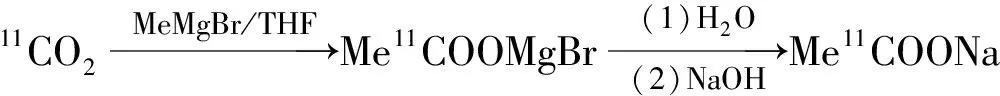
图111C-AC合成路线
图1Syntheticrouteof11C-AC
2.2 实验流程
采用碳-11胆碱/蛋氨酸模块合成11C-AC,其合成流程示于图2。在合成前,取浓度为0.87~1.5 mol/L的溴化甲基镁无水四氢呋喃溶液0.1 mL装于Loop环2中,Loop环2置于活度计内。由PETtrace回旋加速器通过14N(p, α)11C核反应生产11CO2,11CO2在液氮冷却下被捕集在置于冷阱的Loop环1中。在室温下,以10 mL/min N2作载气将11CO2载带至Loop环2中,并与环中的溴化甲基镁反应生成中间体乙酰溴化镁加合物,溶剂四氢呋喃在氮气载带下被传至废液瓶中。1号瓶中5 mL水在N2作用下(30 mL/min)经Loop环2将乙酰溴化镁载至一体化小柱,在柱上进一步发生水解反应。收集产品在无菌真空小瓶4中,继续通入30 mL/min N2流除去酸性条件下释放的11CO2。经碱溶液中和后过无菌滤膜得11C-AC注射液。
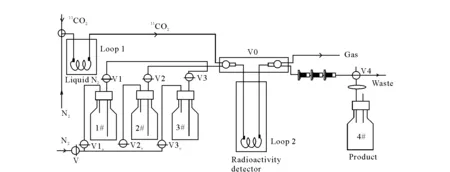
图2 碳-11胆碱/蛋氨酸模块合成11C-AC示意图Fig.2 Schematic diagram of 11C-AC synthesis using 11C-choline/methionine synthesizer
2.3 产品质量检验
用精密pH试纸测定注射液的pH,目测其颜色和澄清度。取即时制备的11C-AC注射液,用活度计测定不同时间点的活度,用半对数作图法估测半衰期和核纯度。用放射性HPLC系统及TLC法[5]测定11C-AC注射液的化学纯度和放化纯度。TLC硅胶铝板,样品加入1 mol/L NaOH后点样,展开剂为甲醇[11]。
按中华人民共和国药典2010年版所述方法对11C-AC注射液进行异常毒性检查、无菌检查及细菌内毒素检查。异常毒性检查:4组小鼠,每组10只,每只尾静脉给予0.5 mL衰变后的11C-AC注射液,观察48 h后小鼠生长情况。
2.4 正常和模型动物PET/CT显像
腹腔注射10%的水合氯醛麻醉SPF级实验兔(约3 kg),经耳缘静脉注射0.6 mL的11C-AC (18.5 MBq),固定于扫描床上。于注射20 min后行PET/CT全身显像,经衰减校正和迭代重建后,获得横断面、矢状面、冠状面断层图像及最大密度投影(maximum intensity projection,MIP)图像。
将S180纤维肉瘤细胞株复苏后,培养3~4代,制成癌细胞悬浮液,调整浓度为1×107个/mL,取0.1 mL注射到小鼠右肩皮下。接种后第10天,小鼠右背部可见明显的肿块,瘤直径大于1 cm入选为肿瘤模型。所有动物饲养于中山大学实验动物中心实验室动物房,恒温恒湿条件,定时给食。S180型纤维肉瘤模型小鼠经水合氯醛麻醉后,由尾静脉注射生理盐水稀释的11C-AC 约1.85~3.7 MBq (0.2 mL),20 min后固定于小鼠架上,行全身PET/CT扫描。经衰减校正和迭代重建后,获得横断面、矢状面、冠状面断层图像及MIP图像。
3 结果与讨论
3.1 11C-AC自动化合成
采用碳-11胆碱/蛋氨酸模块,以1 mol/L溴化甲基镁作前体,可自动化合成11C-AC,总过程耗时约8 min,总校正放化产率为(40.5±4.6)%(n=6)。废液中放射性约占24%,一体化小柱中放射性约占8%,还有约27%为未反应的11CO2(通氮气除去)和反应过程损失的放射性。用PETtrace加速器和质子束流25 μA轰击5 min,得 7.9 GBq的11CO2,可生产2.6 GBq的11C-AC注射液。
采用0.2 mL 0.9 mol/L溴化甲基镁替代0.1 mL 1.5mol/L溴化甲基镁,废液中放射性下降,粗产品中11CO2含量上升,标记率略降低。采用1 mol/L和1.5 mol/L溴化甲基镁作前体,可获得相同的放化产率。
本工作采用一体化小柱完成水解和纯化工作,与现有文献报道的小柱纯化法[4, 7-13,16]相比,本法很容易实现11C-AC的自动化合成,总合成时间较短。中间体11C-乙酰溴化镁加合物可在Sep-Pak Tscx强阳离子小柱中完成水解,从而可得较纯11C-AC注射液。
3.2 11C-AC质量检验
11C-AC注射液为无色或浅黄色溶液,pH约为7.0,比活度≥4.6×1011Bq/g。用时间衰变法测定11C半衰期约为20 min,放射性核纯度大于99%。
采用HPLC法测量11C-AC注射液的放化纯度,主峰(图3A)与标准品乙酸的紫外吸收峰(图3B)保留时间一致,11C-AC放化纯度大于95%。用放射性TLC法测定,11CO2在原点,11C-AC的Rf=0.8,11C-AC放化纯度大于98%。
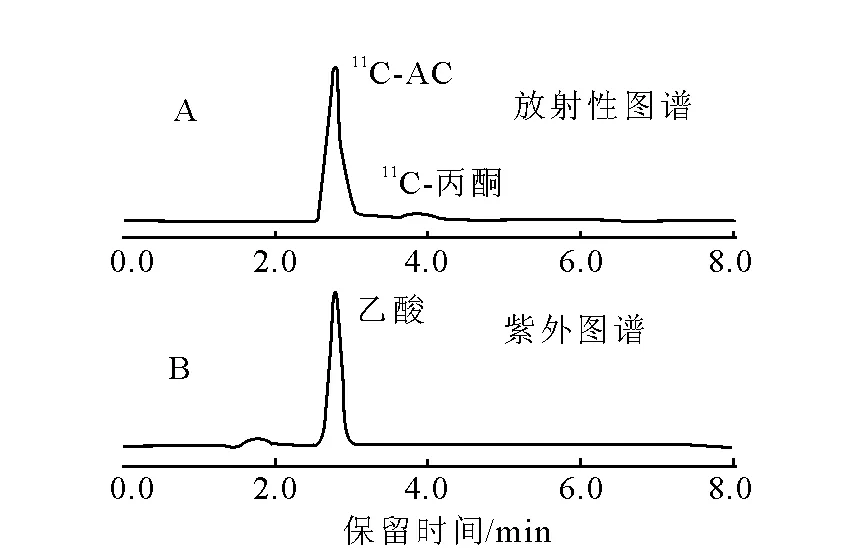
图3 HPLC测定纯化后11C-AC图谱Fig.3 HPLC chromatogram of purified 11C-AC. Figure A is radioactivity chromatogram and Figure B is UV chromatogram
此外,经放射性HPLC法测定,11C-AC 注射液在2 h内放化纯度没有明显变化,均大于95%。异常毒性检查:尾静脉给予11C-AC注射液0.5 mL后,观察48 h后,发现小鼠生长正常,无死亡及不良反应现象发生,解剖后观察,未见任何器官损伤。无菌检查和细菌内毒素检查均为阴性。
3.3 动物PET/CT显像
给予11C-AC后20 min,对正常实验兔进行全身PET/CT显像,显像结果示于图4。由图4可知,肺和肝脏有较高放射性分布,其他组织放射性摄取较低。
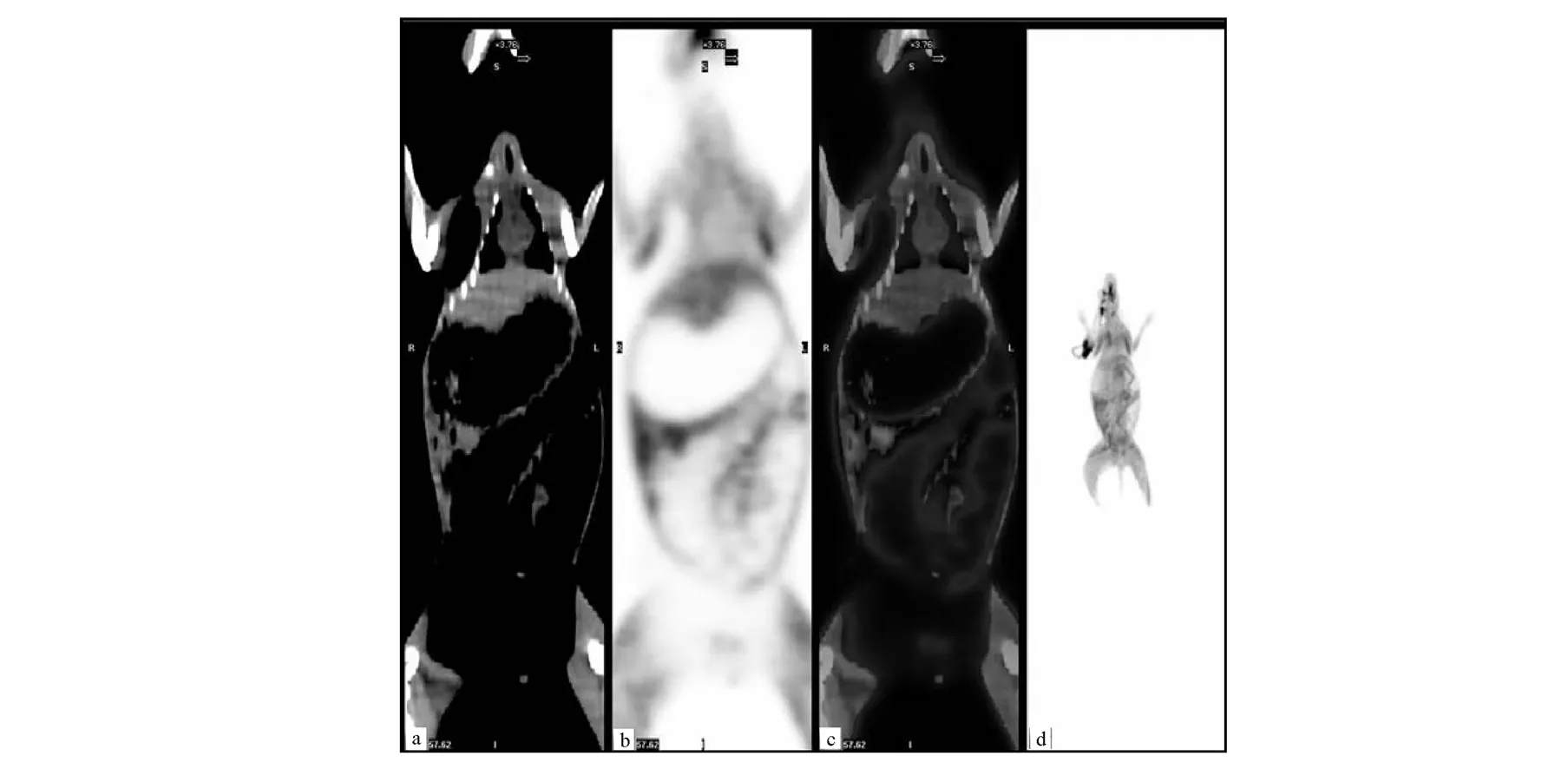
a—冠状CT断层图;b—冠状PET断层图;c—冠状PET/CT融合图;d—冠状MIP图。图4 正常兔全身11C-AC PET/CT显像图像a—coronal CT image;b—coronal PET image;c—coronal PET/CT fused image;d—coronal MIP imageFig.4 Whole-body 11C-AC PET/CT images of normal rabbit
另给予11C-AC后20 min,对荷S180纤维肉瘤小鼠行全身PET/CT显像,获得显像图示于图5。放射性主要分布于上腹部;给药后20 min,肿瘤组织有较低放射性摄取(肿瘤与健侧肌肉放射性摄取比约为1.5),其原因可能是S180纤维肉瘤对11C-乙酸盐的摄取不够敏感。给药后30 min,肿瘤组织放射性摄取略有增加(肿瘤与健侧肌肉放射性摄取比约为2.2)。

a—CT断层图;b—PET/CT横断层融合图;c—冠状PET/CT融合图;d—冠状MIP图。图5 荷S180纤维肉瘤小鼠全身PET/CT显像图像。a—Transverse CT images; b—Transverse PET/CT fused images;c—coronal PET/CT fused images; d— coronal MIP images.Fig.5 Whole body PET/CT images of S180 fibrosarcoma-bearing mice
4 小结
本工作建立了简单、快速自动化合成11C-乙酸盐(11C-AC)的工艺流程,总合成时间约8 min,校正放化产率为(40.5±4.6)%,放化纯度大于95%,经质量控制检验后符合放射性药物质量要求,并经正常动物和模型动物PET/CT显像验证。实验结果表明,自动化生产的11C-AC是安全、有效的,有望进一步用于人体PET/CT研究。
参考文献:
[1]Ho CL, Yu SC, Yeung DWC.11C-Acetate PET Imaging in Hepatocellular Carcinoma and Other Liver Masses [J]. J Nucl Med, 2003, 44:213-221.
[2]Sun A, Sorensen J, Karlsson M, et al. 1-[11C]-acetate PET imaging in head and neck cancer—a comparison with18F-FDG-PET: implications for staging and radiotherapy planning [J]. Eur J Nucl Med Mol Imaging, 2007, 34: 651-657.
[3]唐刚华, 伍光远. 正电子发射断层显像在泌尿系统肿瘤中的应用[J]. 同位素, 2007, 20(2): 114-119.
Tang ganghua, Wu guangyuan. Clinical Application of Positron Emission Tomography Imaging in Urologic Tumors[J]. Journal of Isotopes, 2007, 20(2): 114-119(in Chinese).
[4]Moerlein SM, Gaehle GG, Welch MJ. Robotic preparation of Sodium Acetate C 11 Injection for use in clinical PET [J]. Nucl Med Biol, 2002, 29: 613-621.
[5]Mitterhauser M, Wadsak W, Krcal A, et al. New aspects on the preparation of [11C]acetate—a simple and fast approach via distillation [J]. Appl Radiat Isot, 2004, 61: 1 147-1 150.
[6]Cheung M, Ho CL. A simple, versatile, low-cost and remotely operated apparatus for [11C]acetate, [11C]choline, [11C]methionine and [11C]PIB synthesis [J]. Appl Radiat Isot, 2009, 67: 581-589.
[7]Roeda D, Dolle F, Crouzel C. An improvement of [11C]acetate synthesis—non-radioactive contaminants by irradiation-induced species emanating from the [11C]carbon dioxide production target [J]. Appl Radiat Isot, 2002, 57: 857-860.
[8]Kruijer PS, Linden TT, Mooij R, et al. A practical method for the preparation of [11C]acetate [J]. Appl Radiat Isot, 1995, 46: 317-321.
[9]Lodia F, Trespidia S, Pierro DD, et al. A simple Tracerlab module modification for automated on-column [11C]methylation and [11C]carboxylation [J]. Appl Radiat Isot, 2007, 65: 691-695.
[10]Felicinia C, Nagrenc K, Bertonb A, et al. Development of an automated modular system for the synthesis of [11C]acetate [J]. Nucl Med Commun, 2010, 31:1 033-1 039.
[11]Le Bars D, Malleval M, Bonnefoi F, et al. Simple synthesis of [1-11C]acetate [J]. J Label Compd Radiopharm, 2006, 49: 263-267.
[12]Soloviev D, Tamburella C. Captive solvent [11C]acetate synthesis in GMP conditions [J]. Appl Radiat Isot, 2006, 64: 995-1 000.
[13]张锦明, 田嘉禾, 陈燕等.11C-胆碱模块合成11C-乙酸盐的研究[J]. 中华核医学杂志, 2008, 28(5): 319-322.
Zhang Jinming, Tian Jiahe, Chen yan, et al. A study of11C-acetate production using11C-choline commercial module[J]. Chinese Journal of Nuclear Medicine, 2008, 28(5): 319-322(in Chinese).
[14]Berridge MS, Cassidy EH, Miraldi F. [11C]acetate and [11C]methionine: Improved syntheses and quality control [J]. Appl Radiat Isot, 1995, 46(3): 173-175.
[15]Pike VW, Horlock PL, Brown C, et al. The remotely-controlled preparation of a11C-labelled radiopharmaceutical—[11C]acetate [J]. Int J Appl Radiart Isot, 1984, 35(7): 623-627.
[16]Mock BH, Brown-Proctor C, Green MA, et al. An automated SPE-based high-yield synthesis of [11C]acetate and [11C]palmitate: no liquid-liquid extraction, solvent evaporation or distillation required [J]. Nucl Med Biol, 2011, 38: 1 135-1 142.

