131I标记番泻苷A在正常小鼠体内分布和评价心肌活性研究
王俊虎 ,蒋翠花,江 骁,李 玥, 孙自平,殷志琦,张 健,倪以成,4
(1.中国药科大学 天然药物化学教研室, 江苏 南京 210009;2.江苏省中医药研究院 转化医学实验室, 江苏 南京 210028;3.山东省医学科学院 放射医学研究所, 山东 济南 564314;4.比利时鲁汶大学医学院 医学影像部, 比利时 鲁汶 BE-30000)
冠心病是心血管疾病中发病率、死亡率较高的疾病。冠心病患者心肌梗死后梗死区域内的细胞会变性坏死,形成坏死组织,不可再生。坏死组织的面积是急性心肌梗死的重要预后指标。急性心肌梗死的梗死区域可能存在着相当数量的存活心肌,可能在血流重建后或自发恢复心肌活力[1]。准确的识别冠心病患者的缺血心肌是否可逆对治疗方案的选择具有决定性的作用。因为心肌梗死的心脏上可能同时存在着冬眠心肌、顿抑心肌和坏死心肌,前两者属于可恢复功能的存活心肌[2-3]。如果患者已经形成了大面积不可逆的心肌梗死,此时存活心肌已很少,血流重建术治疗的疗效不仅很差,而且可能造成再灌注损伤加重病情[4],应选择的治疗方案是心脏移植或者对症治疗[1]。如果情况相反,心肌梗死病变区域还存在着较多的存活心肌(冬眠心肌、顿抑心肌),积极的再灌注措施可能使其功能形态恢复[5]。因此心肌梗死的准确诊断,对于冠心病的治疗有重要意义。
现在临床上用于检测存活心肌的方法主要有磁共振成像(MRI)[6]、正电子发射断层扫描(PET)、单光子发射断层扫描(SPECT)[1]和心电图[7]等,通过检测心肌细胞心肌纤维化,细胞
新陈代谢和血流灌注来评价心肌存活情况。但是由于每种方法都存在局限性,降低了诊断的准确率[8]。 近期研究发现,萘并二蒽酮类化合物金丝桃素,具有坏死组织亲和性[9],国外有学者利用放射性碘标记金丝桃素示踪发现,金丝桃素选择性聚集在肿瘤中心坏死组织上[10],Fonge等[11]发现金丝桃素可以与梗死心肌特异性结合,应用于心肌梗死的坏死区域检测。番泻苷A是一种中位二蒽酮类化合物,具有与金丝桃素相似的空间结构,可能也具有相同的活性,其结构图示于图1。为考察番泻苷A的坏死组织亲和性和评价应用于检测心肌细胞存活性的潜力,通过131I标记番泻苷A,研究其在心肌梗死模型大鼠上的分布,探讨检测坏死心肌细胞的可行性。
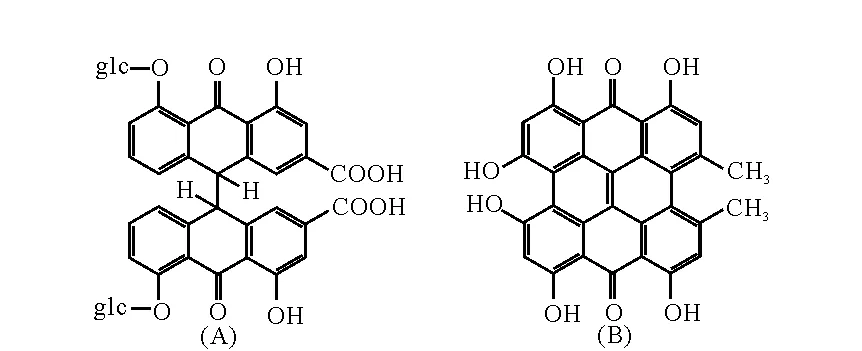
图1 番泻苷(A)和金丝桃素结构图Fig.1 Structure of sennoside A and hypericin
1 实验材料
1.1 主要仪器与装置
RM-905a活度计:中国计量科学研究院研制;SN-697伽马计数器:上海核所日环光电仪器有限公司;小动物呼吸机:上海奥尔科特生物科技有限公司;cyclone plus磷屏扫描仪:Perkin Elmer公司。
1.2 主要药物与试剂
番泻苷A:sennoside A,纯度大于98%,成都普瑞法科技开发有限公司;DMSO:分析纯,天津博迪化工有限公司;Iodogen试剂:美国Sigma公司;浓盐酸:分析纯,南京化学试剂有限公司;Na131I溶液:原子高科股份有限公司;2,3,5-氯化三苯基四氮唑:TTC,上海灵锦精细化工有限公司;其余试剂均为国产分析纯。
1.3 实验动物
SD大鼠:雄性,200~300 g,SPF级,购于上海斯莱克实验动物有限公司。KM小鼠:雄性,20~25 g,SPF级,购于上海斯莱克实验动物有限公司。
2 实验方法
2.1 大鼠心肌梗死模型的建立
SD大鼠腹腔注射10%的水合氯醛(0.3 μL/g)。麻醉后大鼠仰面固定于鼠台上,经口气管插管连接小动物呼吸机,呼吸频率60~80次/min,呼吸比1/1,潮气量4 μL/g。碘伏皮肤消毒后,沿胸骨左缘3、4肋间开胸,暴露心脏,剥离心包膜,在室间沟处左心耳下方平行穿线,结扎左冠状动脉前降支。结扎后,抽出胸腔空气,恢复胸腔负压,快速缝合胸腔,撤出气管插管,每只大鼠肌肉注射青霉素16万个单位。
2.2 131I标记番泻苷A溶液的制备
2.2.1标记条件的优化
1)反应时间对标记率的影响
取200 μL番泻苷A的DMSO溶液(0.2 g/L)加入Iodogen含量为20 μg的制备涂管中,然后加入50 μL的7.4 MBq Na131I溶液,振荡摇匀,室温反应。分别取5、15、30、60 min的反应液用纸层析法测定标记率,Whatman滤纸作为载体,0.1 mol/LHCl作为流动相展开。
2)番泻苷A的用量对标记率的影响
分别取200 μL浓度为0.05 g/L、0.1 g/L、0.2 g/L、0.5 g/L的番泻苷A的DMSO溶液加入Iodogen含量为20 μg的制备涂管中,然后加入50 μL的7.4 MBq Na131I溶液振荡摇匀,室温反应30 min,终止反应后,用纸层析法测定标记率。
3)Iodogen的用量对标记率的影响
取Iodogen含量为5、10、20、40 μg的制备涂管,分别加入200 μL番泻苷A的DMSO溶液(0.2 g/L)然后加入50 μL的7.4 MBq Na131I溶液,振荡摇匀,室温反应30 min,终止反应后,用纸层析法测定标记率。
2.2.2131I标记番泻苷A的体外稳定性
将0.1 mL131I标记番泻苷A溶液(活度约为11.1 MBq)加入至0.3 mL DMSO中,振荡摇匀,于室温条件下放置2、4、6、10、24、48 h后,在每个时间点采用纸色谱法测定放化纯度。
2.3 131I标记番泻苷A在正常小鼠体内分布
将配制好的131I标记番泻苷A溶液加入PEG 400与丙二醇以1∶1体积比的配比溶液稀释3倍。取雄性昆明小鼠9只(实验前一天喂食1%碘化钾溶液),随机分3组,每组3只,每只尾静脉注射稀释后的131I标记番泻苷A溶液0.37 MBq,分别在注射后4、24、48 h断头处死,取各脏器(甲状腺,肾脏,肝脏,脾脏,肺,心,小肠,胃,肌肉,骨骼,毛皮)分别称重并用伽马计数器测量放射性计数,经衰变和背景校正后,计算每克脏器或组织的放射性摄取率(%ID/g)。
2.4 131I标记番泻苷A在心肌梗死模型大鼠体内分布
将配制好的131I标记番泻苷A溶液加入由PEG 400与丙二醇以体积比1∶1配比溶液稀释3倍。取心肌梗死模型大鼠6只(实验前一天喂食1%碘化钾溶液),每只尾静脉注射稀释后的131I标记番泻苷A溶液3.7 MBq。24 h后,安乐处死模型大鼠,取各脏器(甲状腺、肾脏、肝脏、脾脏、肺、正常心肌、梗死心肌、小肠、胃、肌肉和毛皮等),分别称重并用伽马计数器测量放射性计数,经衰变和背景校正后,计算每克脏器或组织的放射活性摄取率(%ID/g)。
2.5 TTC染色和放射自显影
取模型大鼠离体心脏制成2 mm厚的切片,避光条件下用2 %的TTC溶液37 ℃孵育15 min。取TTC染色后的心脏切片,在暗室4 ℃下作用于高分辨感光磷屏曝光1 h,曝光结束后用磷屏扫描仪扫描显像。
3 结果与讨论
3.1 大鼠心肌梗死模型的建立
采用结扎左冠状动脉前降支法建立大鼠急性心肌梗死模型,手术过程如图2所示。结扎后心脏形成心肌梗死,病变部位心肌会缺血变为白色,如图3所示。
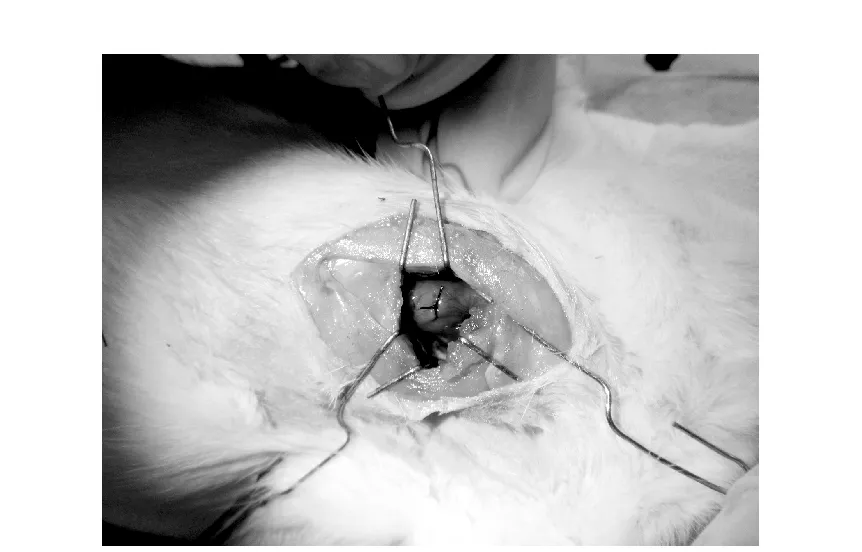
图2 大鼠心脏手术结扎图Fig.2 Image of Heart surgery in rats
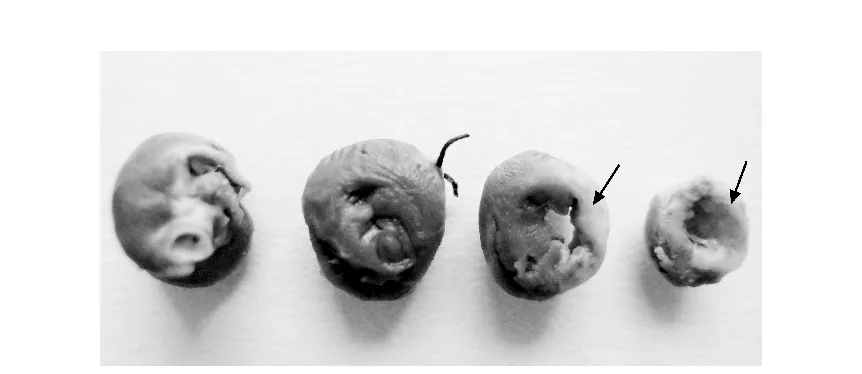
图3 心肌梗死心脏Fig.3 Image of infarcted heart
3.2 131I标记番泻苷A溶液的制备
3.2.1标记条件的优化
1)反应时间对标记率的影响
采用纸层析法测定标记率,游离的131I分布在前沿,而131I标记番泻苷A保留在原点。反应时间对标记率的影响示于图4。标记率随着时间的延长逐渐增高,30 min时达到90.3 %,继续反应标记率变化不明显,最佳反应时间确定为30 min。
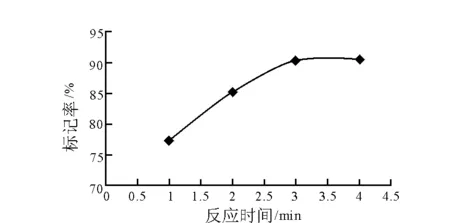
图4 反应时间对标记率的影响Fig.4 Effect of reaction time on labeling yield
2)番泻苷A的用量对标记率的影响
番泻苷A的用量对标记率的影响示于图5。标记率随着番泻苷A的用量增加而逐渐增高,当番泻苷A的浓度为0.2 g/L时标记率达提高90.3%,继续确定反应浓度为0.2 g/L。
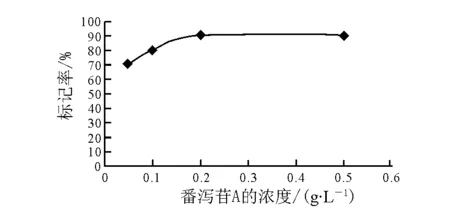
图5 番泻苷A的用量对标记率的影响Fig.5 Effect of concentration of Sennoside A on labeling yield
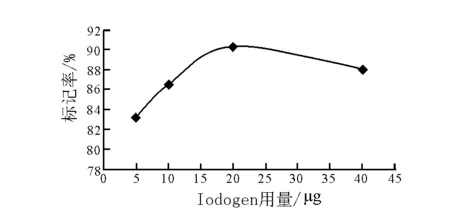
图6 Iodogen用量对标记率的影响Fig.6 Effect of Iodogen mass on labeling yield
3)Iodogen的用量对标记率的影响
Iodogen的用量对标记率的影响示于图6。其他条件不变,Iodogen用量为20 μg之前,标记率随着用量的增加而增高,在20 μg时达到90.3 %,之后随着氧化剂用量的增加而下降,分析原因可能是番泻苷A的标记过程首先是Iodogen氧化剂将Na131I溶液中的I-氧化形成大部分I+离子及少部分的高价态的碘酸根离子,然后I+通过亲电取代反应取代番泻苷A活性部位上的H+,得到131I标记番泻苷A。随着氧化剂用量的增加,被氧化的I-量增加,标记率上升,当氧化剂达到20 μg已经足够将所有的I-氧化成I+,这时再增加氧化剂用量可能会将I-氧化成高价态的碘酸根离子,导致实际参与反应的I+量减少,标记率随着氧化剂用量的增加而下降,因此在制备131I标记番泻苷A时,应该将氧化剂用量控制在20 μg。
3.2.2131I标记番泻苷A的体外稳定性
131I标记番泻苷A溶液的体外稳定性结果示于图7。室温条件下放置24 h,其放化纯度仍保持在90 %以上,48 h时放化纯度为89.9 %,说明131I标记番泻苷A体外稳定性较好。

图7 131I标记番泻苷A体外稳定性Fig.7 131I-Sennoside A’s vitro stability
3.3 131I标记番泻苷A在正常小鼠体内的分布
131I标记番泻苷A在正常小鼠体内的生物分布结果列于表1。由表1可知,在血液清除较快,给药4 h时,血液的放射性摄取为3.052 %ID/g,24 h时降为0.461 %ID/g,48 h为0.243 %ID/g;肾脏放射性摄取高,4 h时为4.656 %ID/g,24 h后为2.674 %ID/g,48 h时为1.597 %ID/g;药物在鼠体表面如肌肉、骨骼、毛皮等放射性摄取较少。注射后24 h,大多数器官及组织的放射性摄取小于1%ID/g,注射后48 h,标记物基本上从各器官清除。而金丝桃素在小鼠体内主要通过肝脏代谢,在肾脏的分布很少[11]。比较金丝桃素和番泻苷A的结构,金丝桃素属于脂溶性化合物,而番泻苷A由于多了两个糖苷键和两个羧基,水溶性较金丝桃素强,推测番泻苷A在小鼠体内主要是通过肾脏排泄。
3.4 131I标记番泻苷A在心肌梗死模型大鼠体内分布
131I标记番泻苷A在心肌梗死大鼠上的分布结果列于表2。注射标记物24 h后,坏死心肌的放射性摄取率为1.537%ID/g,正常心肌为0.129%ID/g,坏死心肌和正常心肌的放射性摄取率比为11.9。血液分布很少为0.096%ID/g,其他各脏器较低,结果表明,番泻苷A具有坏死心肌亲和性。但是肾脏为0.923%ID/g,这与正常小鼠体内分布结果一致,提示番泻苷A是水溶性化合物,经静脉注射后在大鼠体内的代谢主要通过肾脏。

表1 131I标记番泻苷A在正常小鼠体内的生物分布Table 1 Biodistribution of 131I-iodosennoside
表2 131I标记番泻苷A在心肌梗死大鼠体内的生物分布Table 2 Biodistribution of 131I-iodosennosideA in Rat model of myocardial ,n=6)
3.5 TTC染色和放射自显影
TTC试剂可以与正常心肌细胞中的脱氢酶反应而染成红色,坏死心肌细胞由于细胞膜破裂,脱氢酶被完全释放所以不被染色。心脏经过TTC染色后的红色区域代表正常心肌,而白色区域就是心肌梗死区域(如图8 A所示)。图8B放射自显影图像中,箭头所指的红色区域就是放射性核素即131I标记番泻苷A的分布区域,与其相对应的TTC染色图片进行比较后,可以发现,131I标记番泻苷A在白色心肌坏死区域选择性聚集,而在红色正常心肌区域几乎没有聚集,验证了131I标记番泻苷A对于坏死心肌的亲和性。
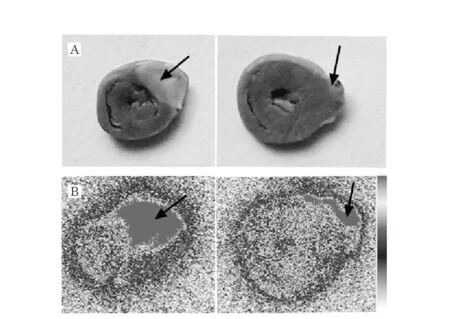
图8 心脏切片TTC染色图(A)和心脏切片磷屏自显影图片(B)Fig.8 Images of 2mm myocardial slices, after TTC staining (A); Autoradiograms of 2mm myocardial slices, correspond to TTC images (B)
4 结论
番泻苷A与梗死心肌特异性结合,能够在大鼠的坏死心肌区域靶向分布,除肾脏外,在正常器官清除较快,在心肌梗死诊断方面具有开发的前景。
[1]Marwick TH. The viable myocardium: epidemiology, detection, and clinical implications[J]. The Lancet, 1998, 351(9105): 815-819.
[2]Braunwald E and Kloner R. The stunned myocardium: prolonged, postischemic ventricular dysfunction[J]. Circulation, 1982, 66(6): 1 146-1 149.
[3]Rahimtoola SH. The hibernating myocardium[J]. American heart journal, 1989, 117(1): 211-221.
[4]Fishbein MC, Y-Rit J, Lando U, et al. The relationship of vascular injury and myocardial hemorrhage to necrosis after reperfusion[J]. Circulation, 1980, 62(6): 1 274-1 279.
[5]Heusch G and Schulz R. Characterization of hibernating and stunned myocardium[J]. European heart journal, 1997, 18(suppl D): 102-110.
[7]刘霞. 急性心肌梗死心电图的诊断名称与标准[J]. 临床心电学杂志, 2011(03): 164-166.
[6]Cianfrocca C, Pelliccia F, Pasceri V, et al. Strain rate analysis and levosimendan improve detection of myocardial viability by dobutamine echocardiography in patients with post-infarction left ventricular dysfunction: a pilot study[J]. Journal of the American Society of Echocardiography, 2008, 21(9): 1 068-1 074.
[8]Lauerma K, Niemi P, Hänninen H, et al. Multimodality MR Imaging Assessment of Myocardial Viability: Combination of First-Pass and Late Contrast Enhancement to Wall Motion Dynamics and Comparison with FDG PET-Initial Experience1[J]. Radiology, 2000, 217(3): 729-736.
[9]Marysael T, Bauwens M, Ni Y, et al. Pretargeting of necrotic tumors with biotinylated hypericin using123I-labeled avidin: evaluation of a two-step strategy[J]. Invest New Drugs, 2012, 30(6): 2 132-140.
[10]Ni Y, Huyghe D, Verbeke K, et al. First preclinical evaluation of mono-[123I] iodohypericin as a necrosis-avid tracer agent[J]. European journal of nuclear medicine and molecular imaging, 2006, 33(5): 595-601.
[11]Fonge H, Vunckx K, Wang H, et al. Non-invasive detection and quantification of acute myocardial infarction in rabbits using MONO-[123I] iodohypericin SPECT[J]. European heart journal, 2008, 29(2): 260-269.
[12]Bormans G, Huyghe D, Christiaen A, et al. Pr-eparation, analysis and biodistribution in mice of iodine-123 labelled derivatives of hypericin[J]. Journal of Labelled Compounds and Radiopharmaceuticals, 2004, 47(3): 191-198.

