点击化学法制备奥曲肽类似物18F-Ta-Gluc-TOCA及其生物学评价
温 凯,陈宝军,2,郭飞虎,2,梁积新,2,殷 胤,陈大明,崔海平
(1.原子高科股份有限公司,北京 102413;2.中国原子能科学研究院,同位素研究所,北京 102413)
生长抑素是由D细胞分泌的一种环状多肽类激素,是一种具有广泛生理学功能的内源性调节肽,对许多实体肿瘤及正常组织有抗增生作用,还可抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡[1-3]。奥曲肽是一种人工合成的生长抑素,体内作用时间可达2 h,作用较天然的生长抑素单一、持久,易被放射性核素标记。
奥曲肽作为一种重要的生长抑素类似物,与生长抑素受体有良好的亲和力,已经成为一种重要的肿瘤治疗药物,多种放射性核素标记的奥曲肽已经进入临床应用。18F标记奥曲肽类似物在国外已有一系列的合成方法报道,1994年,Guhlke等[4-5]成功完成了(2-18F-Fluoropropionyl-(D)phe1)- octreotide 的合成,该标记方法的优点为:酰化试剂活性高,空间位阻小,副反应少,但其合成时间较长,在肿瘤摄取较低。2003年,Wester等[6-7]合成了18F-FP-Gluc-TOCA,通过引入葡萄糖基明显改善了奥曲肽的亲水性和稳定性,但其合成时间大约需要3 h,放化产率为(25±5)%。2006年,Schirrmacher[8-10]制备了18F-SiFA-TATE,反应机理为同位素交换反应,最终的标记率较高,生物体内分布较好,但其在肝、肾摄取较高,体内稳定性不够理想。2010年,Laverman等[11-12]利用NOTA环螯合Al18F,利用此基团来标记一系列奥曲肽类似物。点击化学(click chemistry),其实质是指选用易得原料,通过可靠、高效而又具选择性的化学反应来实现碳杂原子连接,低成本、快速合成大量新化合物的一套强大且实用的合成方法[13]。目前,该技术已在众多研究领域得到迅速发展[14],并已有标记多肽方面研究的报道[15-18]。本实验采用点击化学的方法,在温和条件下和较短时间内完成标记[19-20],符合PET药物的制备要求。所用的奥曲肽类似物经过修饰,加入葡萄糖基,有利于增加奥曲肽的亲水性,更有利于肿瘤的吸收。
1 主要材料和仪器
1.1 实验材料
乙二醇双对甲苯磺酸(化合物1):东京化成工业株式会社;叠氮化钠、N,N-二甲基甲酰胺、乙酸乙酯、石油醚、硫酸铜、抗坏血酸钠、冰醋酸、氯化钠、乙醇、三氟乙酸、无水硫酸钠、无水硫酸镁、氟化钾、磷酸二氢钾、磷酸氢二钠、碳酸钾:国药集团化学试剂公司;乙腈:北京益利精细化学品有限公司;K2.2.2:北京派特生物技术有限公司;前体化合物Pr-Gluc-TOCA:杭州中肽有限公司协作制备,纯度95.1%。
实验动物采用Balb/C裸鼠,鼠龄为4~6周:北京华阜康生物技术有限公司;采用的癌细胞为AR42J细胞,大鼠胰腺外分泌细胞,癌细胞在含10%小牛血清的RPM1-1640培养基中,于CO2恒湿孵育箱中培养,常规传代:中国医学科学院肿瘤研究所提供。
1.2 实验仪器
Eclipse HP型回旋加速器(11 Mev):德国西门子公司;高效液相Agilent 1100:美国安捷伦公司;C18色谱柱,φ4.6 mm×250 mm:德国Merck公司;高效液相系统ProStar 320系统:美国Varian公司;C18色谱柱:4.6 mm×250 mm,美国Thermo公司;GABI型高效液相色谱放射性监控仪:Raytest公司;Varian Mercury-Plus 400型核磁共振仪:美国Varian公司;Applied biosystems QTRAP 2000型质谱仪:美国AB公司;CRC-15PET放射性活度计:美国Capintec公司; Sep Pak light C18 柱、Sep Pak light QMA柱:Waters公司;BHC-336定标器、FT-663闪烁探头:北京核仪器厂;MH2800A加热模块:Auto Science公司;水净化系统:法国Millipore公司;KQ5200超声波清洗器:昆山市超声仪器有限公司;旋涡混合器:北京北德科学器材有限公司;V-vials瓶,5 mL:美国Wheaton公司。
2 实验方法
2.1 18F-Ta-Gluc-TOCA的合成
2.1.12-叠氮对甲苯磺酸乙酯(化合物2)的制备
取化合物1 1.84 g(10 mmol)溶于16 mL的无水DMF中,分四批加入叠氮化钠0.32 g(10 mmol),反应混合物在常温下搅拌48 h;然后过滤除去固体残渣,滤液转移至100 mL水中,充分搅拌,使化合物1充分重结晶,用真空泵进行抽滤,得到化合物2的水和DMF混合溶液;再用30 mL乙酸乙酯萃取3次,萃取前加少量NaCl防止乳化,合并有机相后用20 mL饱和食盐水洗涤;有机相用无水硫酸钠和无水硫酸镁混合干燥2.5 h,减压蒸掉溶剂得粗产品约0.650 g,产率约26.9%。再以V(乙酸乙酯)∶V(石油醚)=1∶2.5为流动相,硅胶柱分离。采用核磁、质谱鉴定化合物2结构,通过HPLC来测定其化学纯度,色谱流动相A水(含0.1%三氟乙酸)和流动相B乙腈(含0.1%三氟乙酸);流速:1.0 mL/min;0 min,100%A;20 min,0%A;30 min,0%A;35 min,100%A。
2.1.22-18F叠氮乙烷(化合物3)的制备
18F-Ta-Gluc-TOCA合成路线示于图1。18F生产条件为:核反应18O(p,n)18F,采用1.5 mL H2O[18O]富氧水靶,在回旋加速器上用质子束流连续轰击15~30 min,流强50 μA,效率80%,得到18F-。取18F-约11.1×107Bq,注入到事先活化好的QMA柱(先用5 mL 10% K2CO3润洗,再用10 mL去离子水清洗,最后用20 mL空气排出柱上水分)上,用0.6 mL K2.2.2/ K2CO3溶液洗脱得到活的18F-KF。将上述18F-KF注入5 mL 的V-vials瓶中,在100 ℃加热模块上加热,通氮气吹干乙腈和水分,再加三次500 μL色谱纯乙腈吹干,保证反应体系无水,取出反应瓶冷却。
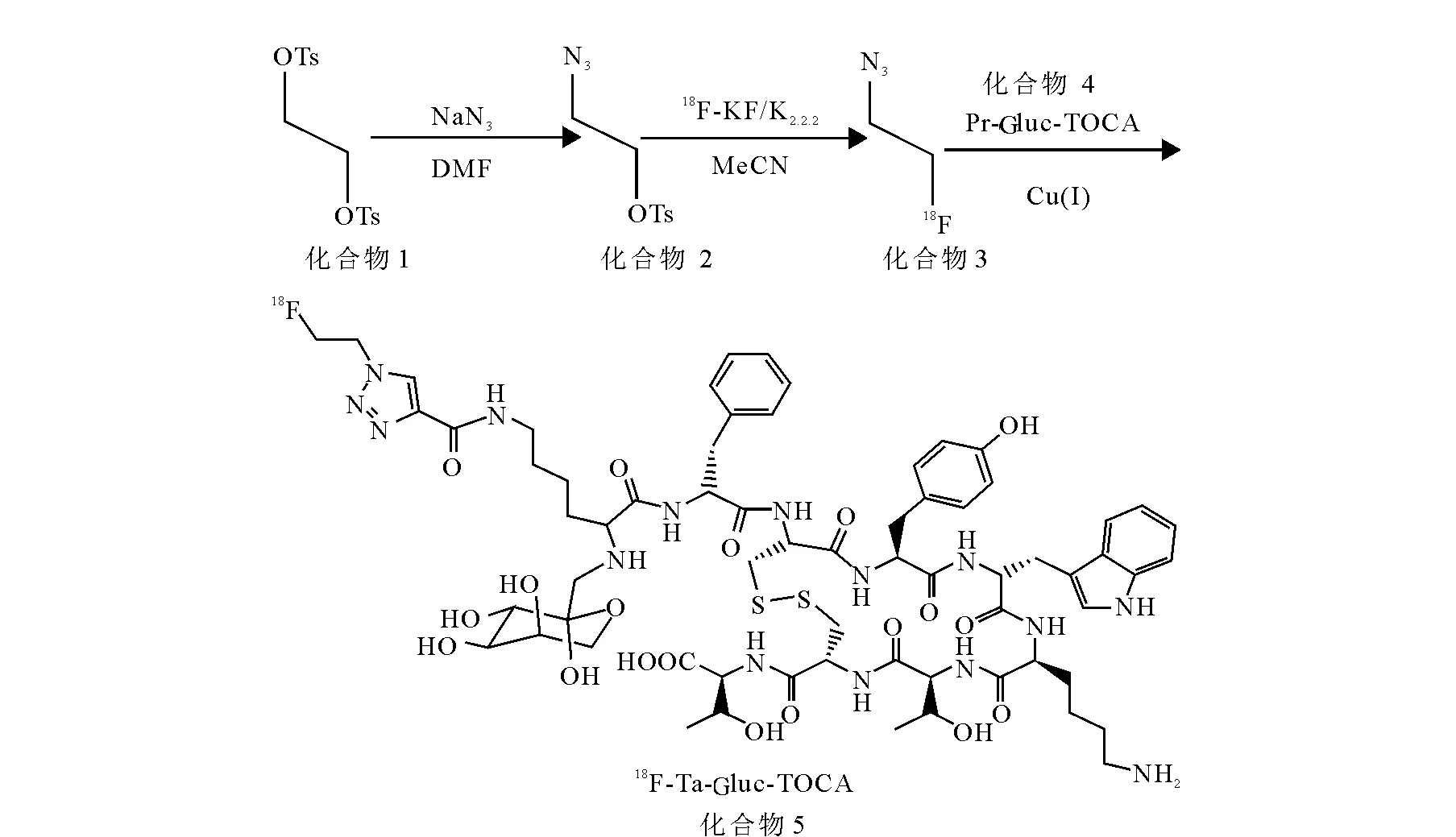
图1 18F-Ta-Gluc-TOCA合成路线Fig.1 Synthesis of 18F-Ta-Gluc-TOCA
向活化后含有18F-KF的反应瓶中,分三批加入2-叠氮对甲苯磺酸乙酯(化合物2)(0.125 mg,0.52 μmol)的250 μL无水乙腈的溶液,反应混合物加热到100 ℃,N2下吹干乙腈,再加300 μL无水乙腈复溶,密闭反应15 min后停止反应,冰水浴冷却到室温。
采用高效液相色谱放射性监控仪检测放化纯度。色谱流动相A为水(含0.1%三氟乙酸)和流动相B为乙腈(含0.1%三氟乙酸);流速:1.0 mL/min;0 min,95%A;3 min,95%A;10 min,10%A;15 min,25%A;20 min,95%A。
2.1.318F-Ta-Gluc-TOCA的制备
在含有2-氟叠氮乙烷(化合物3)的瓶中,氮气保护下,加入100 μL 0.10 mol/L pH 6.0 PBS溶液,加入25 μL 0.45 mol/L硫酸铜溶液和60 μL 3.0 mol/L抗坏血酸钠溶液,再加入250 μL Pr-Gluc-TOCA(化合物4,0.5 mg,0.36 μmol)的 PBS溶液,在室温下反应20 min。用Sep Pak Light C18柱分离纯化。18F-Ta-Gluc-TOCA检测方法同化合物3。
2.2 合成条件的选择
2.2.1化合物2投料量对标记率影响
化合物4用量保持0.5 mg,化合物2的投料量一个当量为0.091 mg,分别取2、1、0.25、0.125、0.091 mg化合物2和9.3×107Bq18F-,保持其他反应条件不变,分析对18F-Ta-Gluc-TOCA标记率的影响。
2.2.2pH 对标记率影响
分别以pH为4、5、6、7、8为反应环境,进行完整的合成实验,保持其他反应条件不变。
2.3 体外稳定性测定
取含18F-Ta-Gluc-TOCA的试剂约5.6×106Bq,置于1 mL 0.10 mol/L,pH 6的PBS中,置于37 ℃下,孵育30、60、90、120 min后,采用HPLC法测定其放化纯度,观察其体外稳定性。
2.4 脂水分配系数测定
取5.5×106Bq18F-Ta-Gluc-TOCA,将其加入到含1 mL正辛醇和1 mL 0.10 mol/L,pH 6的PBS两相溶剂中,密封涡旋,静置使两相恢复平衡。用移液器分别取出两相各500 μL,用γ计数器计数,重复三次,计算脂水分配系数。
2.5 正常小鼠体内生物分布
取正常小鼠16只,随机分成4组,每组4只,分别经尾静脉注射100 μL约5.6×106Bq18F-Ta-Gluc-TOCA的生理盐水溶液,分别于注射后15、30、60、120 min处死,取心、肝、脾、肺、肾、胃、小肠、肌肉、骨头、血等相应器官置于计数管底部,称重并测量计数。经衰变校正后计算各组织的每克组织放射性摄取率(%ID/g)。
2.6 荷瘤裸鼠体内分布实验
取荷AR42J瘤裸鼠8只,分成2组,每组4只,分别经尾静脉注射100 μL约5.6×106Bq18F-Ta-Gluc-TOCA的生理盐水溶液,分别于注射后60、120 min处死,取心、肝、脾、肺、肾、胃、小肠、肌肉、骨头、血、肿瘤等相应器官置于计数管底部,称重并测量计数。经衰变校正后计算每克组织放射性摄取率(%ID/g)。
3 结果与讨论
3.1 18F-Ta-Gluc-TOCA的合成
3.1.1化合物2的合成
2-叠氮对甲苯磺酸乙酯的HPLC图示于图2。化合物2性状为淡黄色油状物,共0.054 g,柱分离效率约8.5%。1H NMR(CDCl3,400 MHz)δ:7.82 (d, J = 8.0 Hz, 2H, C2H), 7.37 (d, J = 8.0 Hz, 2H, C3H), 4.16 (t, 2JHH= 5.2 Hz, 2H, SCH2), 3.48 (2JHH= 5.2 Hz, 2H, NCH2), 2.45(s, 3H, CH3); MS: 242.1(M+H), 259.1(M+NH4), 264.1(M+Na)。结果显示,化合物2的结构正确,相对分子质量241.2;保留时间为13.833 min纯度较高,大于97%,可以进行下一步实验。
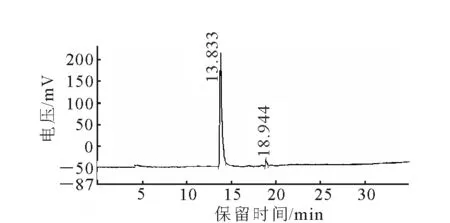
图2 2-叠氮对甲苯磺酸乙酯的HPLC图 Fig.2 HPLC chromatography of 2-azide-ethyl-p-toluenesulfonate
3.1.2化合物3的合成
2-18F叠氮乙烷的HPLC图示于图3。在反应开始后,化合物3很快就开始生成,化合物2不断减少,直到反应结束,化合物2基本完全反应,化合物3产率大于98%。

图3 2-氟叠氮乙烷的HPLC图Fig.3 HPLC chromatography of synthesizing 2-fluorine aziethane
3.1.318F-Ta-Gluc-TOC的合成
18F-Ta-Gluc-TOCA的HPLC图示于图4。合成18F-Ta-Gluc-TOCA实验主要分为两步,第一步合成化合物3,第二步合成18F-Ta-Gluc-TOC。化合物3的标记率为80%,第二步反应标记率相对较低,总标记率约为57%,需要进行分离纯化。经过对分离纯化条件的优化,最终选定使用Light C18柱进行分离纯化。分离纯化后18F-Ta-Gluc-TOCA放化纯度达到91%,校正后比活度为7.4×107Bq/mg。
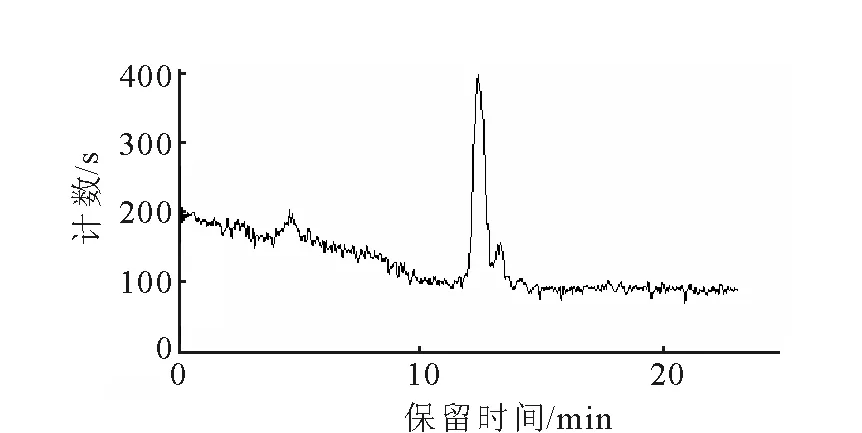
图4 18F-Ta-Gluc-TOCA的HPLC分析图 Fig.4 HPLC chromatography of 18F-Ta-Gluc-TOCA
3.2 合成条件选择
3.2.1化合物2投料量
当化合物2投料量为2、1、0.25、0.125、0.091 mg时,18F-Ta-Gluc-TOCA的标记率分别为78%、、80%、75%、78%、40%。当投料量为0.125 mg以上时,标记率基本保持在75%至80%之间,投料量过小,标记率会有明显下降,为了提高标记率,尽量减少化合物2的投料量,因此选择化合物2用量0.125 mg。
3.2.2pH影响
在pH4、5、6、7、8时,18F-Ta-Gluc-TOCA标记率分别为73%、75%、78%、80%、78%,标记率基本稳定。这也证实了点击反应对pH要求低的特点,为了维持多肽的活度,选取pH为6作为反应条件。
3.3 体外稳定性
18F-Ta-Gluc-TOCA体外稳定性结果示于图5。由图5可知,18F-Ta-Gluc-TOCA的体外稳定性较好。但是其稳定性随时间变化略有降低,这可能是由于18F与碳链的连接不稳定,有少量18F离子脱下。
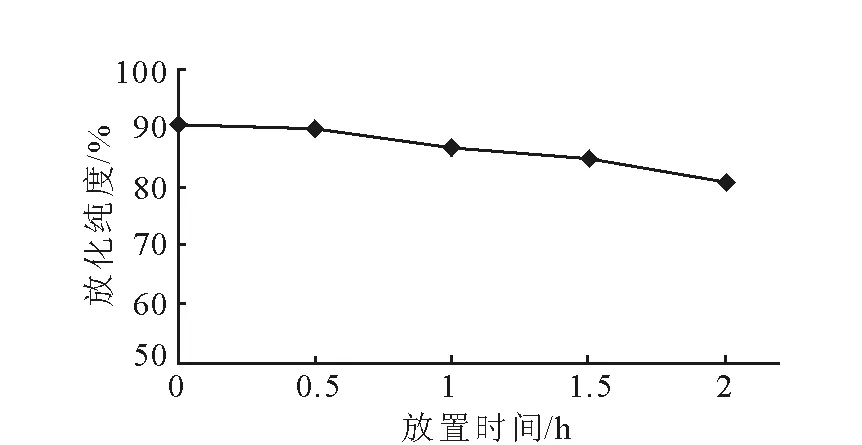
图5 18F-Ta-Gluc-TOCA的体外稳定性Fig.5 Stability of 18F-Ta-Gluc-TOCA in vitro
3.4 脂水分配系数
对18F-Ta-Gluc-TOCA进行亲脂性实验,测得其脂水分配系数为-0.43±0.05。说明18F-Ta-Gluc-TOCA的亲水性得到了一定的提高,但相对18F-FP-Gluc-TOCA仍然较低。由于丙炔酸和2-18F叠氮乙烷增加了碳链长度,也在一定程度上降低了其亲水性。
3.5 正常小鼠体内生物分布
18F-Ta-Gluc-TOCA在正常小鼠体内的生物分布结果列于表1。由表1可以看出,18F-Ta-Gluc-TOCA在正常小鼠体内肝吸收最强,15 min时为11.85%ID·g-1,肾吸收为其次,15 min时为4.12%ID·g-1肝与肾放射性摄取比(T/NT)约为2.9∶1;该药物主要通过肝脏代谢,其次通过肾代谢;在其他器官的摄取均较低,股骨有少量的摄取;各器官的摄取均随着时间不断下降,18F-Ta-Gluc-TOCA的血液清除较快。该药物的肝吸收高主要是由于18F-Ta-Gluc -TOCA的结构中加入了丙炔酸,同时在点击反应后又加入了2-18F-叠氮乙烷,导致其碳链较长,增加了其亲脂性,使其主要通过肝脏代谢;该药物在骨中有摄取主要是因为少量游离的18F-。
3.6 荷瘤裸鼠体内生物分布
18F-Ta-Gluc-TOCA在荷AR42J瘤裸鼠体内分布结果列于表2。由表2可以看出,18F-Ta-Gluc-TOCA在荷瘤裸鼠体内的分布基本与正常小鼠体内分布一致,在肝和肾有较高的摄取,在60 min时肝脏为3.28%ID·g-1,肾脏为2.41%ID·g-1,主要通过肝代谢,血液清除较快,在其他器官摄取较低。18F-Ta-Gluc-TOCA在肿瘤中的摄取较高,60 min时达到4.34%ID·g-1,在120 min时仍保持较高摄取。
18F-Ta-Gluc-TOCA在荷AR42J瘤裸鼠体内分布的T/NT结果列于表3。由表3可以看出,肿瘤与肝脏、肾脏两个主要的代谢器官的T/NT稍小;在120 min时的T/NT增大。T/NT随时间而增大主要是由于18F-Ta-Gluc-TOCA 在120 min时肿瘤中的摄取仍然较高,下降不明显,在组织或器官中的摄取均明显降低,说明18F-Ta-Gluc-TOCA在肿瘤内保留时间较长,在肿瘤中的高摄取使其有望用于生长抑素受体阳性肿瘤PET显像。
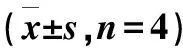
表1 18F-Ta-Gluc-TOCA的正常小鼠体内分布
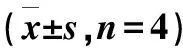
表2 18F-Ta-Gluc-TOCA的荷瘤裸鼠体内分布数据Table 2 Biodistribution of 18F-Ta-Gluc-TOCA in tumor bearing nude mice
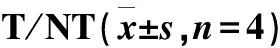
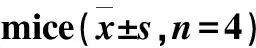
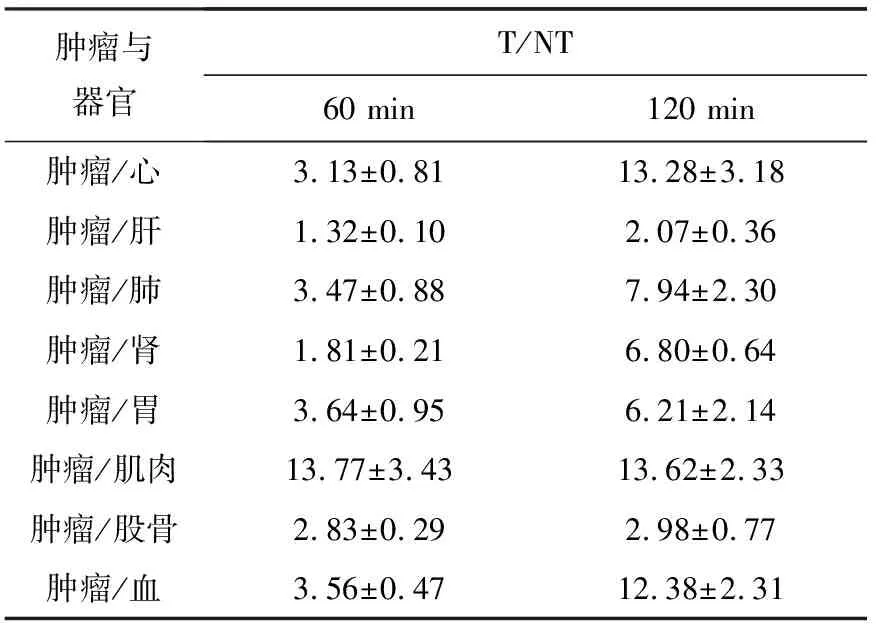
肿瘤与器官T/NT60 min120 min肿瘤/心3.13±0.8113.28±3.18肿瘤/肝1.32±0.102.07±0.36肿瘤/肺3.47±0.887.94±2.30肿瘤/肾1.81±0.216.80±0.64肿瘤/胃3.64±0.956.21±2.14肿瘤/肌肉13.77±3.4313.62±2.33肿瘤/股骨2.83±0.292.98±0.77肿瘤/血3.56±0.4712.38±2.31
4 结论
本研究采用点击化学法制备了18F标记的奥曲肽类似物18F-Ta-Gluc-TOCA放化纯度高,稳定性较好,亲水性得到了一定改善。18F-Ta-Gluc-TOCA在血液中清除较快;主要通过肝脏代谢,部分经肾脏代谢,在其他器官或组织摄取均较低;在肿瘤中摄取较高,而且在120 min时仍有较高的摄取,18F-Ta-Gluc-TOCA在肿瘤中的高摄取可以使其成为一种较好的显像剂。18F-Ta-Gluc-TOCA制剂在骨中有少量摄取,稳定性有待提高;由于点击化学反应以及引入的丙炔酸结构使其亲脂性进一步增加,18F-Ta-Gluc-TOCA肝脏摄取较高,在以后的研究中可以对奥曲肽结构进一步改进。
参考文献:
[1]涂久生, 吴佩, 夏祥厚,等. 生长抑素及其类似物治疗肿瘤的研究进展[J]. 中国临床药理学与治疗学, 2002, 7(1): 90-93.
Tu Jiusheng, Wu Pei, Xia Xianghou, et al. Progress in treatment of cancer by somatostatin and its resemblances[J]. Chinese Journal of Clinical Pharmacology and Therapeutics. 2002, 7(1): 90-93(in Chinese).
[2]王丽华, 汪勇先, 尹端沚. 生长抑素及其类似物的标记技术的发展[J]. 核技术, 2003, 26: 537-544.
Wang Lihua, Wang Yongxian, Yin Duanzhi. Application of somatostatin and their analogues in nuclear medicine[J]. Nuclear Technology, 2003,26: 537-544(in Chinese).
[3]武凤玉. 放射性核素标记奥曲肽肿瘤受体显像研究进展[J].国外医学肿瘤学分册,2005, 32(10): 760-763.
[4]Guhlke S, Wester HJ, Bruns C,et al. (2-[18F]fluoropropionyl-(d)phe1)- octreotide, a potential radiopharmaceutical for quantitative somatostatin receptor imaging with PET: Synthesis, radiolabeling, in vitro validation and biodistribution in mice[J]. Nuclear Medicine and Biology, 1994, 21: 819-825.
[5]Wester HJ, Brockmann J, Rosch F, et al. PET-Pharmacokinetics of18F-Octreotide: A Comparison with67Ga-DFO- and86Y-DTPA-Octreotide[J]. Nuclear Medicine & Biology, 1997, 24: 275-286.
[6]Wester HJ, Schottelius M, Scheidhauer K, et al. PET imaging of somatostatin receptors: design, synthesis and preclinical evaluation of a novel18F-labelled, carbohydrated analogue of octreotide[J]. European Journal of Nuclear Medicine and Molecular Imaging, 2003, 30: 117-122.
[7]Meisetschläger G, Poethko T, Stahl A, et al. Gluc-Lys([18F]FP)-TOCA PET in Patients with SSTR- Positive Tumors: Biodistribution and Diagnostic Evaluation Compared with [111In]DTPA- Octreotide[J]. The Journal of Nuclear Medcine, 2006, 47, 4: 566-573.
[8]Schirrmacher E, Wängler B, Cypryk M, et al. Synthesis of p-(Di-tert-butyl [18F]fluorosilyl) benzaldehyde ([18F]SiFA-A) with High Specific Activity by Isotopic Exchange: A Convenient Labeling Synthon for the18F-Labeling of N-amino-oxy Derivatized Peptides[J]. Bioconjugate Chem, 2007, 18: 2 085-2 089.
[9]Hohne A, Mu L, Honer M, et al. Synthesis,18F-Labeling, and in Vitro and in Vivo Studies of Bombesin Peptides Modified with Silicon-Based Building Blocks[J]. Bioconjugate Chem, 2008, 19: 1 871-1 879.
[10]Wängler C, Waser B, Alke A, et al. One-Step18F-Labeling of Carbohydrate-Conjugated Octreotate-Derivatives Containing a Silicon-Fluoride-Acceptor (SiFA): In Vitro and in Vivo Evaluation as Tumor Imaging Agents for Positron Emission Tomography(PET) [J]. Bioconjugate Chem, 2010, 21 (12): 2 289-2 296.
[11]McBride WJ, Sharkey RM, Karacay H. A Novel Method of18F Radiolabeling for PET[J]. Nucl Med, 2009, 50: 991-998.
[12]Laverman P, William J, Robert M, et al. A Novel Facile Method of Labeling Octreotide with18F-Fluorine[J]. Nucl Med, 2010, 51: 454-461.
[13]李娟, 段明, 张烈辉,等. 点击化学及其应用[J]. 化学进展, 2007, 19,(11): 1 754-1 759.
Li Juan, Duan Ming, Zhang Liehui, et al. Click Chemistry and Its Applications[J]. Progress in Chemistry, 2007, 19,(11): 1 754-1 759(in Chinese).
[14]罗璇, 林丹, 孙玉婷. 点击化学简介[J]. 化学教育, 2009, 10: 3-5.
Luo Xuan, Lin Dan, Sun Yuting. Introduction of Click Chemistry[J]. Chinese Journal of Chemical Education, 2009, 10: 3-5(in Chinese).
[15]Rostovtsev VV, Green LG, Fokin VV, and Sh-arpless K B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective “ligation” of azides and terminal alkynes[J].Angew Chem, Int. Ed, 2002, 41, 2 596-2 599.
[16]Marik J, Sutcliffe JL. Click for PET: rapid preparation of [18F]fluoropeptides using Cu(I) catalyzed 1,3-dipolar cycloaddition[J]. Tetrahedron Letter, 2006, 47(37):6 681-6 684.
[17]Glaser M, Arstad E. “Click Labeling” with 2-[18F]Fluoroethylazide for Positron Emission Tomography[J]. Bioconjugate Chem, 2007, 18: 989-993.
[18]Li Z, Wu Z, Chen K, et al. Click Chemistry for18F-Labeling of RGD Peptides and microPET Imaging of Tumor Integrin αvβ3Expression[J]. Bioconjugate Chem, 2007, 18: 1 987-1 994.
[19]Hartmuth CK, Sharpless KB. The growing impact of Click Chemistry on drug discovery[J].2003, 8: 1 128-1 137.
[20]许梅, 匡春香. 正电子放射性药物的点击合成[J]. 核技术, 2009, 32, 8: 626-631.
Xu Mei, Kuang Chunxiang. Click Synthesis of PET Radiophamceuticals[J]. Nuclear Technology, 2009, 32, 8: 626-631(in Chinese).
[21]Finn MG, Kolb HC, Fokin VV, et al. Click Chemistry--Definition and Aims[J]. Progress in Chemistry, 2008, 20(1): 1-4.
[22]Kolb HC, Finn MG, Sharpless KB. Click Chemistry: Diverse Chemical Function from a Few Good Reactions[J]. Angew Chem, Int. Ed, 2001, 40: 2 004-2 021.
[23]施玲丽, 郭飞虎, 王妮,等. 多肽的18F标记方法[J]. 核技术, 2008, 31(10): 772-779.
Shi Lingli, Guo Feihu, Wang Ni, et al. Fluorine-18 labeling methods for peptides[J]. Nuclear Technology, 2008, 31(10): 772-779(in Chinese).

