甲状旁腺素、降钙素和阿仑膦酸钠治疗绝经后妇女骨质疏松症的疗效比较
陈成旺,潘孝云,薛恩兴,温宏
(温州医科大学附属第二医院 骨科,浙江 温州 325027)
骨质疏松症已成为包括中国在内的许多国家的一个重大的医疗健康问题,是绝经后妇女椎体骨折及非椎体部位发生脆性骨折的主要原因,仅在美国每年就有150万次以上骨折是由骨质疏松所致[1],随着人口老龄化,中国的骨质疏松症患者,尤其是女性患者正在成为一个越来越庞大的群体。骨折是骨质疏松症最具破坏性的结局。50岁以上人群中,1/2的女性、1/8的男性在他们的一生当中都会出现骨质疏松性骨折。目前,有多种治疗和预防骨质疏松症的方法可供患者选择。以降钙素、阿仑膦酸钠为代表的以抗骨吸收来增加骨密度(bone mineral density,BMD)的药物已广泛应用于临床,是目前全球使用最广泛的骨质疏松症治疗药物之一。
目前,一种促进骨合成代谢的药物—重组人甲状旁腺素(rhPTH)越来越受到关注。研究表明,在使用rhPTH后,不仅BMD得到改善,骨合成代谢标记物之一—血清骨钙素水平明显升高,并且椎骨及非椎骨骨折发生率明显下降[2-3]。
本项研究目的在于比较甲状旁腺素皮下注射与鲑降钙素鼻喷给药及阿仑膦酸钠口服给药治疗中国大陆绝经后骨质疏松妇女的临床效果,包括腰椎BMD、全髋BMD、血清骨钙素的变化等。因为降钙素和阿仑膦酸钠在该患者人群中的疗效和耐受性已经非常明确,本方案不设计安慰剂对照。
1 对象和方法
1.1 研究对象 2011至2012年,共选取绝经3年以上的骨质疏松症患者110位,每位患者接受双能X线吸收仪(DXA,美国LUNAR公司生产)检查,标准为低于正常年轻女性BMD平均值2.5个标准差,并且影像学资料表明既往有过椎体或非椎体脆性骨折。排除标准:继发性骨质疏松;存在影响骨代谢的疾病;基线骨肉瘤危险性升高;活动性肾结石或尿路结石;明显的肝或肾功能损害;筛查前5年内有其他恶性肿瘤病史;参加研究前1年内使用过会影响骨代谢的任何药物(包括激素);在3个月内接受过雌激素、选择性雌激素受体调节剂治疗;研究开始前12个月内接受过二磷酸盐治疗;已知对甲状旁腺素或降钙素过敏者。
1.2 治疗 110位患者随机接受甲状旁腺素(商品名:特立帕肽)20μg/d腹部皮下注射(36例)或鲑降钙素(商品名:密盖息)200 IU/d鼻内给药(36例)或阿仑膦酸钠(商品名:福善美)70 mg每周固定时间口服一次(38例)治疗,治疗周期为24周。每位患者治疗期间每天补充500 mg钙元素及400 IU维生素D3(口服),补充剂可在一天中任何时间服用。本研究方案获得伦理委员会批准,患者在接受治疗前均知情同意。
共有100位患者最终完成治疗,其中甲状旁腺素组36例,降钙素组31例,阿仑膦酸钠组33例。平均年龄为68.5岁(55~80岁),平均为绝经后15年(5~30年)。在100位患者中有1位接受过卵巢切除术,2位接受过子宫切除术。
1.3 观察指标 所有患者在研究开始(基线)及研究结束时(终点)通过DXA进行脊柱及全髋BMD测量。患者在研究开始前需拍摄胸、腰椎侧位片,来评价椎骨是否畸形以及被测定椎体的骨折情况,其结果由专职放射科医师在不知晓具体分组的情况下做出。腰1~腰4椎体要求有连续3个椎体没有骨折、骨赘或畸形,否则会干扰腰椎BMD的测定。
治疗开始(基线)及治疗结束时(终点)进行血清骨钙素检测,选择在早上8~9点进行血样采集。采用酶联免疫法,使用罗氏公司Elecsys2010全自动免疫测定仪,试剂由罗氏公司提供。
记录可能发生的不良反应、血清钙离子浓度变化及生命体征情况。
患者的依从率低于研究药物的70%或高于130%,则被认为该患者属于不依从治疗。本研究中甲状旁腺素组依从率为100%,降钙素组为93.6%,阿仑膦酸钠组为92.1%。
1.4 统计学处理方法 使用SPSS20.0软件进行统计学比较。计量资料三组之间比较采用方差分析,组间各指标基线与终点的变化量比较采用LSD-t检验进行统计。P<0.05为差异有统计学意义。
表1 3组患者腰椎BMP、全髋BMD、血清骨钙素浓度情况(±s)
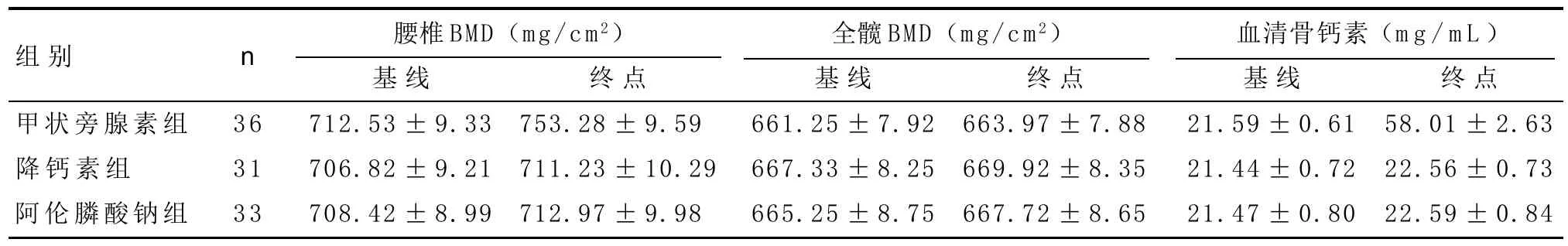
表1 3组患者腰椎BMP、全髋BMD、血清骨钙素浓度情况(±s)
组别甲状旁腺素组降钙素组阿伦膦酸钠组n 腰椎BMD(mg/cm2) 全髋BMD(mg/cm2) 血清骨钙素(mg/mL)36 31 33基线712.53±9.33 706.82±9.21 708.42±8.99终点753.28±9.590 711.23±10.29 712.97±9.980基线661.25±7.92 667.33±8.25 665.25±8.75终点663.97±7.88 669.92±8.35 667.72±8.65基线21.59±0.61 21.44±0.72 21.47±0.80终点58.01±2.63 22.56±0.73 22.59±0.84
表2 3组患者治疗前后各项指标的差值(±s)
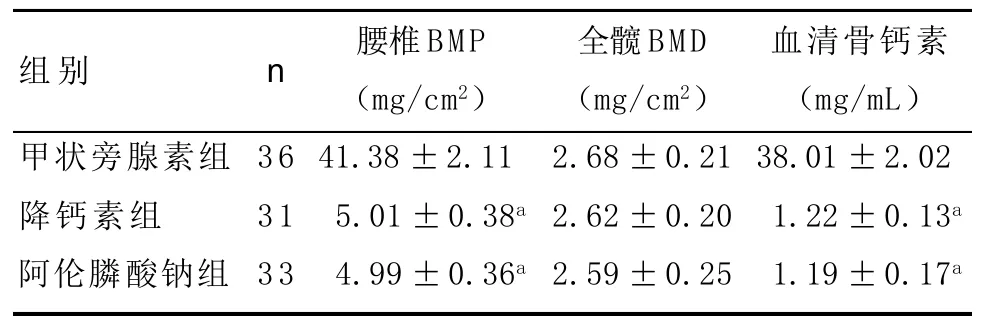
表2 3组患者治疗前后各项指标的差值(±s)
与甲状旁腺素组比:aP<0.01
组别甲状旁腺素组降钙素组阿伦膦酸钠组n 36 31 33腰椎BMP(mg/cm2)41.38±2.11a 45.01±0.38a 44.99±0.36a全髋BMD(mg/cm2)2.68±0.21 2.62±0.20 2.59±0.25血清骨钙素(mg/mL)38.01±2.02a 31.22±0.13a 31.19±0.17a
2 结果
各组腰椎BMD、全髋BMD及血清骨钙素数据如表1-2所示。治疗24周后腰椎BMD提高在甲状旁腺素组为(41.38±2.11)mg/cm2,明显高于降钙素组和阿仑膦酸钠组(P<0.001)。甲状旁腺素组血清骨钙素增加(38.01±2.02)ng/mL,明显高于降钙素组和阿仑膦酸钠组(P<0.001)。全髋BMD变化在三组之间差异无统计学意义(P>0.05)。
治疗期间未发生与药物相关的严重的心血管、消化、骨骼肌肉或神经系统不良反应。甲状旁腺素组有2例患者出现小腿肌肉痉挛现象,1例出现呕吐,随着治疗进行,症状逐渐缓解。降钙素组有1例患者出现呕吐,1例患者出现一过性眩晕,症状较轻且很快消失。治疗前后血清钙离子水平未发生明显变化。
3 讨论
降钙素、阿仑膦酸钠等抗骨吸收药物一直用于治疗骨质疏松症,据文献[4-5]报道,这类药物可降低骨折发生率;但是,治疗仅使BMD小幅增加,这提示已经失去的骨质,大部分没有有效恢复。特立帕肽是一种生物合成的人甲状旁腺激素(1-34)[rhPTH(1-34)],对骨形成具有合成代谢作用,能增加BMD,降低骨折发生率。Walsh等[6]研究发现,使用特立帕肽36周能明显降低75岁以上骨质疏松患者骨折发生率,并能改善由此引起的背痛,提高患者生活质量。Ohtori等[7]通过一项前瞻性研究发现,使用特立帕肽较二磷酸盐能更有效地提高绝经后妇女腰椎植骨融合的成功率。Hwang等[8]和Kung等[9]在2006年分别报道,皮下注射特立帕肽在提高BMD方面明显优于降钙素。国内学者李丹等[10]就特立帕肽和阿仑膦酸钠治疗骨质疏松症进行Meta分析,指出特立帕肽治疗后腰椎BMD升高幅度明显高于阿仑膦酸钠。
本研究比较特立帕肽和阿仑膦酸钠及降钙素治疗绝经后妇女骨质疏松症的临床疗效,结果证明,24周特立帕肽每天20μg皮下注射能显著提高患有骨质疏松症的绝经后妇女的腰椎BMD,其疗效明显高于常规的降钙素每天200 IU鼻内给药和每周口服阿仑膦酸钠70 mg。血清骨钙素是一项反映骨合成代谢的重要指标。本研究发现,甲状旁腺素组患者研究前后血清骨钙素水平明显升高,而降钙素和阿仑膦酸钠不能有效地提高血清降钙素水平。Glover等[11]在为期1个月的观察中发现,绝经后妇女通过使用特立帕肽能快速且明显提升这些患者体内骨形成标志物PINP(I型前胶原N末端前肽)、PICP(I型前胶原C末端前肽)和OC(血清骨钙蛋白)的水平。
本研究显示特立帕肽能明显提高腰椎BMD,这一结果与先前的研究结果是一致的。髋关节的成分中,皮质骨占的比例较大,在皮质骨骨膜下新的骨组织的矿物质沉积相对松质骨要缓慢一些,因此皮质骨的反应并不像由主要骨小梁组成的松质骨那样明显。甲状旁腺素可能需要更长的治疗时间才能反映出它在该区域的治疗效果[12-13]。
本研究中各组在治疗期间均未发生与药物相关的严重不良反应。
本研究存在一些不足之处。首先,样本量较小,24周的研究时限对于评价诸如药物长期安全性(骨质疏松症治疗是一个长期的过程)、骨折发生率改变和可能的髋部BMD的变化等来说过于短暂;我们只测定骨合成指标,而没有测定骨吸收指标,因此,一些降钙素和阿仑膦酸钠的实际效果不能得到观察。
特立帕肽较降钙素及阿仑膦酸钠能明显提高BMD,且有研究表明更大剂量的治疗可能会带来BMD更加明显地提高[12]。但BMD的增加量和骨折发生率降低的相关性还存在争议[14]。在骨合成促进剂和骨吸收抑制剂比较中增加的BMD量是否能有效地降低骨折发生率还是一个未知数。
总之,甲状旁腺素治疗中国绝经后妇女骨质疏松症疗效优于降钙素和阿仑膦酸钠,能明显提高腰椎BMD及血清骨钙素水平,且患者的耐受性良好,药物的使用比较安全。
[1] Gass M, Dawson-Hughes B. Preventing osteoporosis-related fractures: an overview[J]. Am J Med, 2006, 119 (4 Suppl 1):S3-S11.
[2] Hwang JS, Tu ST, Yang TS, et al. Teriparatide vs. calcitonin in the treatment of Asian postmenopausal women with established osteoporosis[J]. Osteoporos Int, 2006, 17(3): 373-378.
[3] Orwoll ES, Scheele WH, Paul S, et al. The effect of teriparatide[human parathyroid hormone (1-34)] therapy on bone density in men with osteoporosis[J]. J Bone Miner Res,2003, 18(1): 9-17.
[4] Black DM, Arden NK, Palermo L, et al. Prevalent verte
braldeformities predict hip fractures and new vertebral deformities but not wrist fractures. Study of Osteoporotic Fractures Research Group[J]. J Bone Miner Res, 1999, 14(5):821-828.
[5] Chesnut CH 3rd, Silverman S, Andriano K, et al. A randomized trial of nasal spray salmon calcitonin in postmenopausal women with established osteoporosis: the prevent recurrence of osteoporotic fractures study. PROOF Study Group[J]. Am J Med, 2000, 109(4): 267-276.
[6] Walsh JB, Lems WF, Karras D, et al. Effectiveness of Teriparatide in women over 75 years of age with severe osteoporosis: 36-month results from the European Forsteo Observational Study (EFOS)[J]. Calcif Tissue In, 2012, 90(5): 373-383.
[7] Ohtori S, Inoue G, Orita S, et al. Teriparatide accelerates lumbar posterolateral fusion in women with postmenopausal osteoporosis: prospective study[J]. Spine (Phila Pa 1976),2012, 37(23): E1464-1468.
[8] Hwang JS, Tu ST, Yang TS, et al. Teriparatide vs. calcitonin in the treatment of Asian postmenopausal women with established osteoporosis[J]. Osteoporos Int, 2006, 17(3): 373-378.
[9] Kung AW, Pasion EG, Sofiyan M, et al. A comparison of teriparatide and calcitonin therapy in postmenopausal Asian women with osteoporosis: a 6-month study[J]. Curr Med Res Opin, 2006, 22(5): 929-937.
[10] 李丹, 陈兴明, 乔凤娟, 等. 特立帕肽与阿仑膦酸盐对比治疗骨质疏松症有效性及安全性的Meta分析[J]. 中国骨质疏松杂志, 2011, 17(11): 997-1001.
[11]Glover SJ, Eastell R, McCloskey EV, et al. Rapid and robust response of biochemical markers of bone formation to teriparatide therapy[J]. Bone, 2009, 45(6): 1053-1058.
[12]Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis[J]. N Engl J Med, 2001, 344(19): 1434-1441.
[13] Crandall C. Parathyroid hormone for treatment of osteoporosis[J]. Arch Intern Med, 2002, 162: 2297-2309.
[14]Delmas PD, Seeman E. Changes in bone mineral density explain little of the reduction in vertebral or nonvertebral fracture risk with anti-resorptive therapy[J]. Bone, 2004,34(4): 599-604.

