运动对骨骼肌中内质网应激反应介导的细胞凋亡分子事件影响
李海鹏,孙 泊
(1.上海体育学院 运动科学学院,上海 200438;2.台州学院 体育科学学院,浙江 临海 317000;3.聊城大学 体育学院,山东聊城 252059)
新近研究发现,除了原有两条经典凋亡途径(①TNF-α/Fas 介导的外源性死亡受体途径和②线粒体介导的内源性损伤途径)以外,内质网介导的应激反应途径也参与了细胞凋亡过程[1]。对于骨骼肌而言,细胞凋亡不仅可以经由不同凋亡途径发生,而且在各条途径中还会涉及到诸多纷繁复杂的细胞凋亡分子事件(如Caspase 家族的级联激活事件)。尽管目前已有不少关于运动对骨骼肌细胞凋亡影响的研究,但是现有研究多围绕原有两条经典凋亡途径展开,而针对内质网应激反应(Endoplasmic Reticulum Stress,ERS)介导的信号转导途径中相关基因的研究少有报道[2],一定程度上限制了研究者对运动与骨骼肌细胞凋亡过程中各凋亡途径之间的关系以及运动诱导骨骼肌发生细胞凋亡机制等方面的认识[3-4]。鉴于此,本研究拟通过对小鼠分别进行8 周跑台、爬梯运动干预,观察运动对小鼠骨骼肌ERS 介导的细胞凋亡途径中钙调神经磷酸酶(calcineurin,CaN)活性以及相关基因(m-Calpain、Caspase-12 和Caspase-3)mRNA 表达的影响,为今后揭示运动与骨骼肌细胞凋亡各条凋亡途径之间的关系提供一些参考。
1 研究方法
1.1 实验动物与分组
3 月龄雄性SAMP8 小鼠24 只(体重:28.1 ±2.3 g),购自天津中医药大学第一附属医院实验动物中心(许可证编号:W-J 津实动质M 准字第006 号),购入后随机分为3 组:安静对照组(C 组)、跑台运动组(E 组)和爬梯运动组(R 组),每组各8 只,在SPF 条件下分笼饲养,以国家标准啮齿类饲料喂养,自由饮食、饮水。光照遵循明暗周期,温度范围20 ℃±2 ℃,相对湿度55%±5%。
1.2 运动方案
适应性饲养1 周后,E 组采用动物跑台进行有氧运动[5],具体运动方案为:第1 周15 m/min×15 min;第2 周为20 m/min×25 min;第3 周为25 m/min×25 min;第4 周为25 m/min×30 min;第5 ~8 周均为30 m/min×30 min,每天1 次,每周5 天,持续8 周。R 组采用负重爬梯进行抗阻运动,具体运动方案为:第1 周负重50%BW;第2 周负重50%BW;第3 周负重66%BW;第4 周负重83%BW;第5 ~7 周负重100%BW;第8 周负重83%BW,其中除第1 周训练安排为每天3组,每组3 次以外,第2 ~8 周均为每天3 次,每组4次。每次爬梯间隔时间为20 s,每组间隔时间为2 min,训练隔天1 次,持续8 周。所有训练时间选择在暗周期(18:00 ~20:00)进行。
1.3 实验方法
1.3.1 实验取材
末次运动后24 h ~48 h,小鼠断头处死,迅速取完整后肢腓肠肌并分成两份,一份用于CaN 活性检测,另一份锡箔纸包裹并标记后迅速置于液氮中,后移至-80℃超低温冰箱保存。
1.3.2 DNA ladder 检测
细胞凋亡采用DNA ladder 试剂盒(购自江苏碧云天生物技术研究所)进行检测,检测步骤参照试剂盒说明书进行,通过凝胶电泳观察有无梯状条带。
1.3.3 CaN 活性检测
CaN 活性的检测参照南京建成生物技术研究所提供的CaN 试剂盒说明书进行,主要用于反映细胞中Ca2+浓度的变化。
1.3.4 总RNA 的提取、逆转录及Real-time PCR 扩增
骨骼肌总RNA 的提取及RNA 完整性与纯度的检测参照文献[6]进行,经检验总RNA 的完整性与纯度均较好。然后,取RNA 2 μl 以Oligo(dT)15(50 pmol/μl)为随机引物RNA 逆转录合成cDNA。Real-time PCR扩增引物由Pubmed 数据库进行目的基因全序列查找,采用Primer Express 3.0 引物设计软件由上海捷瑞生物公司合成,引物序列及相关信息见表1。
Realtime PCR 反应体系为20 μL,其中SYBR Premix(TOYOBO 公司)10 μL,正、反向引物(10 μM)各1 μL,模板4 μL,然后用无RNase 水补足。反应条件为95 ℃,3 min 预变性;扩增阶段为95 ℃,20 s,Tm℃,20 s,72 ℃,20 s(收集荧光),45 个循环;产物特异性检测阶段95 ℃,1 min;Tm ℃,20 s;缓慢升温(收集荧光)至95 ℃,10 s。经仪器自动分析,各基因融解曲线均为单峰,表明扩增产物特异性较高。以β-actin为内参基因,各目的基因的相对量Relative Expression(RE)按照2-ΔΔCt计算求得。

表1 各基因引物序列及相关信息
1.4 数据处理
由SPSS for windows15.0 统计软件包运用单因素方差分析进行数据处理。所得数据以¯x± s 表示,差异显著性水平定义为P〈0.05。
2 研究结果
2.1 细胞凋亡的初步检测
经2%琼脂糖凝胶电泳检测,C 组、E 组和R 组均未见阶梯状DNA Ladder,可以初步推断在各组小鼠骨骼肌均未呈现明显的细胞凋亡特征(图略)。
2.2 运动对小鼠骨骼肌中CaN 活性的影响
与C 组相比,E 组和R 组小鼠骨骼肌中CaN 活性均显著升高(P〈0.05)(见表2)。

表2 运动对小鼠骨骼肌中CaN 活性的影响
2.3 运动对ERS 凋亡途径中相关基因mRNA 表达的影响
与C 组相比,E 组和R 组小鼠骨骼肌中m-Calpain 与Caspase-12 mRNA 水平均分别显著升高(P〈0.05),但R 组小鼠骨骼肌中Caspase-3 mRNA 水平较C 组呈显著下降(P〈0.05),而E 组小鼠骨骼肌中Caspase-3 mRNA 水平却未见显著性变化(P〉0.05)(见表3)。

表3 运动对ERS 途径中相关基因mRNA 表达的影响
3 分析与讨论
内质网是细胞内Ca2+储备的主要场所。已有研究表明,运动应激能够引起内质网Ca2+离子通道状态的改变,从而破坏内质网腔内的钙稳态,通过造成胞内钙的失衡,干扰蛋白质的正常合成、翻译与折叠过程,并促使内质网内未折叠蛋白和错误折叠蛋白生成增多超过阈值,最终产生内质网应激反应(ERS)。李焕春等人曾提出,ERS 不仅是细胞抵抗应激的重要机制,更是应激细胞发生损伤的重要原因。适度的内质网应激利于细胞生理机能的发挥,然而当应激强度过高时,细胞会通过启动各种信号机制引发细胞凋亡[7]。符民桂等研究者认为,一般而言,内质网与细胞凋亡的关系主要表现在两个方面:一个是对Ca2+的调控,另一个就是内质网应激反应[8]。当然在ERS 诱导的细胞凋亡途径中Ca2+也仍然发挥着重要的媒介作用,在受Ca2+信号调节的钙调神经磷酸酶(CaN)、钙蛋白酶(m-Calpain)、Caspase-12 以及Caspase-3 等分别构成了ERS 介导凋亡的下游凋亡分子事件,运动应激对这些分子事件的影响一定程度上反映了运动与细胞凋亡之间的关系(如图1)。
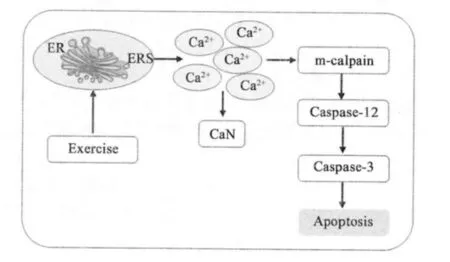
图1 内质网应激反应介导的细胞凋亡示意图
李爱玲等人的研究指出,CaN 是迄今发现的唯一受Ca2+/钙调素(CaM)调节的丝/苏氨酸蛋白磷酸酶,是细胞信号传递中的效应酶和调节酶,在骨骼肌等组织细胞中作为Ca2+信号下游的一种效应分子参与多种受Ca2+信号调节的细胞事件,CaN 的激活往往意味着[Ca2+]的升高[9]。本实验结果显示,与C 组相比,E组和R 组小鼠骨骼肌中CaN 的活性均显著性升高(P〈0.05),表明无论是有氧运动还是抗阻运动都可能造成内质网中Ca2+过度升高进而诱导内质网应激反应,使得Ca2+从内质网中被释放入细胞质激活CaN。此外,钙蛋白酶(Calpain)是一种Ca2+依赖性的半胱氨酸蛋白酶,其非组织特异性Calpain 主要有μ-Calpain和m-Calpain 两种形式,二者除活化时需要的Ca2+不同以外,生化和催化的性质几乎完全相同。Saido 等人的研究认为,由于细胞内Ca2+的波动在微摩尔(μmol)浓度水平以下,所以μ-Calpain 很可能在正常生理条件下发挥功能,而m-Calpain 则主要在生理异常甚至病理情况(如细胞内钙超载条件)下才能激活[10],因此,本实验主要针对小鼠骨骼肌中m-Calpain 进行了检测,结果发现E 组和R 组小鼠骨骼肌中m-Calpain mRNA 表达均较C 组显著升高(P〈0.05),意味着两种形式的运动均能够在引发内质网应激反应释放Ca2+的同时促进内质网附近的m-Calpain 的表达。
Xu 等研究认为,m-Calpain 表达的上调只是ERS介导的凋亡途径中的一个中间信号事件,当m-Calpain 被激活后,它将继续作用于其底物(如Bax、Bid、Caspase-12)而导致细胞凋亡,其中在后续凋亡过程中起重要作用的是定位于内质网外膜的Caspase-12,它在死亡受体或线粒体凋亡途径中始终处于失活状态,Caspase-12 表达的增加将意味着运动应激诱发的凋亡信号能够通过ERS 途径来引发凋亡[11]。本实验结果显示,与C 组相比,E 组和R 组小鼠骨骼肌中Caspase-12 mRNA 表达均显著升高(P〈0.05),表明m-Calpain 被激活后确实将凋亡信号传递至ERS介导的凋亡途径中特异凋亡因子-Caspase-12。那么如果再经由Caspase-12 引发凋亡主效应因子—Caspase-3 的表达上调,就会导致蛋白降解诱发细胞凋亡。
然而出乎意料的是,与C 组相比,E 组和R 组小鼠骨骼肌中Caspase-3 mRNA 表达均未呈现出促凋亡的上调趋势,尤其在R 组Caspase-3 mRNA 表达反而有所下降,且具有显著性差异(P〈0.05),而E 组Caspase-3 mRNA 表达则未见任何显著性变化(P〉0.05)。无论E 组还是R 组之所以未能呈现出预期的上调表达,究其原因可能在于Caspase-3 是多条凋亡通路的交叉点,由另外两条凋亡途径中的某一条途径或者两条途径同时所引发的细胞凋亡在Caspase-3这一交叉点上发生了效应迥异的分子事件,而ERS 介导的细胞凋亡在Caspase-3 基因的最终表现上由于其促凋亡效应被抵消等原因使得Caspase-3 在整体效应上有所保留,最终呈现一定的凋亡隐性表征。
4 结语
综上所述,虽然运动应激能够引发小鼠骨骼肌内质网产生应激反应,但是并未能够将由应激反应引发的凋亡作用最终级联放大在Caspase-3 上得以显性表征,导致骨骼肌细胞凋亡的必然发生,甚至对于抗阻运动而言,反而表现出一定的抑制凋亡趋势。此外,在运动与骨骼肌细胞凋亡各凋亡途径的关系中,内质网介导的应激反应途径较之于原有两条经典凋亡途径在致凋亡的作用上可能存在一定的弱势效应。尽管如此,相信随着今后相关研究的逐步深入,ERS 介导的凋亡途径仍将为我们提供一个独特的视角来了解运动与骨骼肌细胞凋亡的关系。
[1]Tabas I,Ron D.Integrating the mechanisms of apoptosis induced by endoplasmic reticulum stress[J].Nat Cell Biol.2011,13(3):184-190.
[2]Quadrilatero J,Bombardier E,Norris SM,et al.Prolonged moderate-intensity aerobic exercise does not alter apoptotic signaling and DNA fragmentation in human skeletal muscle[J].Am J Physiol Endocrinol Metab.2010,298(3):E534-547.
[3]Carraro U,Franceschi C.Apoptosis of skeletal and cardiac muscles and physical exercise[J].Aging(Milano).1997; 9(1-2):19-34.
[4]Phaneuf S,Leeuwenburgh C.Apoptosis and exercise[J].Med Sci Sports Exerc.2001,33(3):393-396.
[5]李海鹏,杨东升,王立丰,等.跑台运动对Sarcopenia 小鼠Caspase 依赖与非依赖凋亡基因mRNA 表达的影响[J].中国运动医学杂志,2011,30(7):625-629.
[6]李海鹏,王立丰,关尚一,等.Sarcopenia 关联的线粒体介导的细胞凋亡信号通路的增龄性变化及爬梯运动对其的影响[J].体育科学,2010,30(7):56-61.
[7]李焕春,肖国强.内质网应激和热休克与运动[J].体育学刊,2009,16(1):109-112.
[8]符民桂,唐朝枢.钙调神经磷酸酶的研究进展[J].生物化学与生物物理进展,2000,27(2):157-161.
[9]李爱玲,修瑞娟.钙联蛋白调控内质网应激诱导的细胞凋亡[J].基础医学与临床,2011,31(3):335-338.
[10]Saido TC,Sorimachi H,Suzuki K.Calpain: new perspectives in molecular diversity and physiological-pathological involvement[J].FASEB J.1994,8(11):814-822.
[11]Xu C,Bailly-Maitre B,Reed JC.Endoplasmic reticulum stress:cell life and death decisions[J].J Clin Invest.2005,115(10):2656-2664.

