检验氢氧化钠溶液明显变质的最佳方法——一道化学试题引起的教学反思
章永军
(苏州工业园区星海实验中学 江苏 苏州 215021)
一、问题的提出
在一节复习课上和学生讨论了这样一道题目:现有一瓶因长期露置在空气中而变质的氢氧化钠溶液。
(1)如何用实验方法证明该氢氧化钠已经变质? 简要叙述实验方法和现象,写出有关化学方程式。
(2)如何除去该氢氧化钠溶液中的杂质? 简要说明实验方法和现象,并写出有关化学方程式。
在回答第一小问题时, 主要总结了以下三种方法。方法一:取样品,加入稀盐酸或稀硫酸,如果看到有气泡,则氢氧化钠已变质;方法二:取样品,滴加氢氧化钙溶液,如果产生沉淀,则已变质;方法三:取样品,滴加氯化钡溶液或氯化钙溶液,如果产生沉淀,则已变质。
二、对以上结论进行反思,事实果真如此?
笔者进行了如下实验:首先取刚开封的氢氧化钠固体,用蒸馏水配成8%的氢氧化钠溶液。
实验1.取样品滴加氯化钡溶液,无沉淀生成,说明该氢氧化钠基本不变质。 另取样品,滴加氯化钙溶液,有大量的白色沉淀生成(原因:2NaOH+CaCl2=Ca(OH)2↓+2NaCl),这说明用氯化钙溶液无法检验出氢氧化钠溶液中的碳酸钠。
实验2.取上述8%的氢氧化钠溶液,滴加饱和石灰水,也产生白色沉淀。 氢氧化钙溶液和氢氧化钠溶液不发生化学反应,那么白色沉淀是什么呢? 通过查阅相关资料得到,根据同离子效应,氢氧化钙在氢氧化钠溶液里溶解度很小,也会析出得到氢氧化钙沉淀。 此实验说明用饱和石灰水也无法证明氢氧化钠溶液里的碳酸钠。
实验3.仍取上述配好的氢氧化钠溶液,加入碳酸钠溶液,再滴加5%的氯化钡溶液,有大量的白色沉淀生成。说明:用5%氯化钡溶液可以检验氢氧化钠中的碳酸钠。
实验4.再取上述8%的氢氧化钠溶液,滴入1-2 滴酚酞试剂,滴加稀盐酸至红色消失,基本无气泡产生。 再从刚开封的试剂瓶中取出氢氧化钠固体,直接滴加稀盐酸,产生大量的气泡。 这说明,该气泡应该不是二氧化碳气体,那怎么会有气泡产生呢? 原因分析:氢氧化钠固体和稀盐酸反应放出大量的热,使少量的稀盐酸温度迅速升高,短时间内达到沸腾,所以产生了“气泡”的假象。 所以:用稀盐酸直接滴加到氢氧化钠固体中,也不能证明氢氧化钠固体中是否含有碳酸钠。
实验5.同样取上述8%的氢氧化钠溶液加入一定量的碳酸钠溶液,逐滴加入稀盐酸至过量,开始气泡不明显,后来有大量的气泡产生。 可见用稀盐酸来检验氢氧化钠溶液里的碳酸钠时, 应该先将氢氧化钠配成溶液,再滴加过量稀盐酸或稀硫酸。
三、检验氢氧化钠溶液已明显变质的各试剂的浓度范围
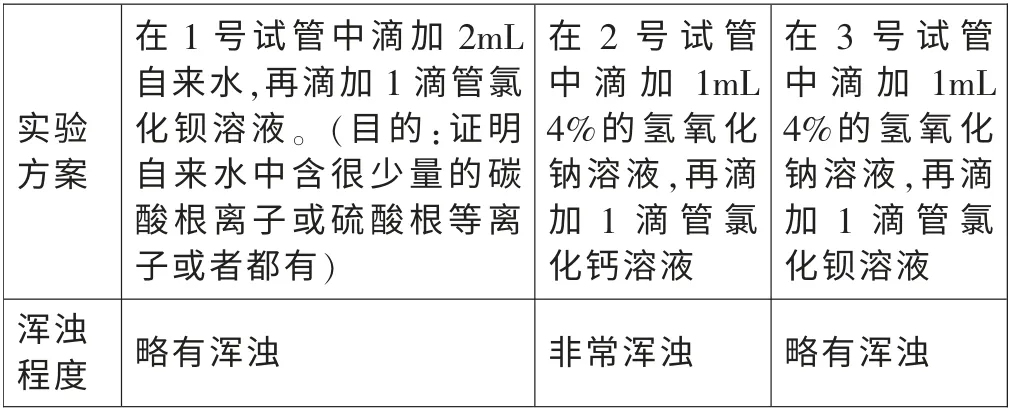
实验1: 在室温下配制溶质质量分数均为10%的氯化钡溶液和氯化钙溶液。 分别滴加到质量分数约为4%的氢氧化钠溶液和自来水中。 实验记录如下表:
?
通过实验1 分析, 氯化钡溶液滴入到新配制的4%的氢氧化钠溶液,略有浑浊,说明该氢氧化钠溶液中含极少量的碳酸根离子(其浑浊程度和自来水相当)。 氯化钙溶液滴入到新配制的4%的氢氧化钠溶液,非常浑浊。室温下,Ksp(CaCO3)=8.7×10-9,Ksp(BaCO3)=8.1×10-9[1]两者相差不大,但是沉淀却相差很多,这说明2 号试管中的沉淀主要不是碳酸钙,而是氢氧化钙。 该实验进一步说明, 氯化钙溶液和4%的氢氧化钠溶液反应有氢氧化钙沉淀生成。 也就是说用氯化钙去检验氢氧化钠溶液是否变质是不可靠的。
实验2: 将10%的氯化钙溶液分别滴加到不同浓度的氢氧化钠溶液中,实验记录如下:

?
通过实验2 分析,用10%氯化钙溶液来区别氢氧化钠溶液是否变质时,只有当氢氧化钠质量分数小于0.5%才适合。
实验3:将饱和的石灰水分别滴加到,溶质质量分数约为4%和8%的氢氧化钠溶液中,实验记录如下:

?
通过实验3 分析,用饱和的石灰水检验氢氧化钠是否变质时,只有在氢氧化钠质量分数小于4%时,才比较适合。
四、实验结论
结论1:用稀盐酸来检验氢氧化钠是否明显变质时,最好是将氢氧化钠配成溶液,然后加稀盐酸,如观察到有明显的气泡,可说明氢氧化钠已经明显变质。
结论2: 用质量分数为10%左右的氯化钙溶液来检验氢氧化钠是否明显变质时,只有将溶液配成极稀的溶液(如果原溶液是4%的氢氧化钠溶液和水的体积比在1∶10 左右),然后滴加氯化钙溶液,如果有明显的沉淀生成,说明氢氧化钠已经变质。
结论3: 用质量分数为10%左右的氯化钡溶液来检验氢氧化钠是否明显变质时,只有当原氢氧化钠溶液溶质质量分数小于4%,然后滴加氯化钡溶液,如有明显的沉淀生成,说明氢氧化钠已经变质。
结论4: 用饱和石灰水来检验氢氧化钠是否明显变质时,只有当原氢氧化钠溶液溶质质量分数小于4%,然后滴加饱和石灰水,如有明显的沉淀生成,说明氢氧化钠已经变质。 同样用饱和石灰水来除去氢氧化钠溶液中的杂质,也要在很稀的溶液中进行。
五、教学应用
如果在教学中,该探究实验和学生一起探讨明显难度太大,不利于初中生的学习和理解。 所以在教学中要让学生知道,刚生产的氢氧化钠本身都含有少量的碳酸盐和其他杂质,在长期存放的过程中也难免有变质的情况。 所以在检验氢氧化钠是否明显变质时,先把氢氧化钠配成溶液用稀盐酸来检验,观察是否有明显气泡是最可靠的方法。
[1] 北京师范大学无机化学教研室等编.无机化学(上册)[M].北京:高等教育出版社,1997
[2] 中学化学国家课程标准研制组.义务教育课程标准实验教科书[M].上海:上海教育出版社,2010:204
[3] 万信华.关于NaOH 变质情况的探究[J].教育学论,2010,(21):196

