镁燃烧实验在质量守恒定律教学中的设计
王大华
(陕西平利县长安初级中学 陕西 平利 725509)
一、问题提出
人教版九年级化学(上)第五单元课题1质量守恒定律[实验5-2]取一根用砂纸打磨干净的长镁条和一个石棉网,将它们一起放在托盘天平上称量,记录所称的质量。在石棉网上方将镁条点燃,观察反应现象。将镁条燃烧后的产物与石棉网一起放在托盘天平上称量,比较反应前后的质量。
该实验可行吗?镁条燃烧后的产物与石棉网的总质量会比反应前的质量多吗?
实验验证:取适量的镁条连同蒸发皿和镊子一起放在电子天平 (本实验采用精确量为0.001g电子天平)上称量,记录所称的质量。在蒸发皿的上方将镁条点燃,发现有大量白烟生成。同时镊子前端有白色固体附着。蒸发皿收集到镁条燃烧后的产物与镊子一起放在电子天平上称量,比较反应前后的质量。记录实验数据如下:
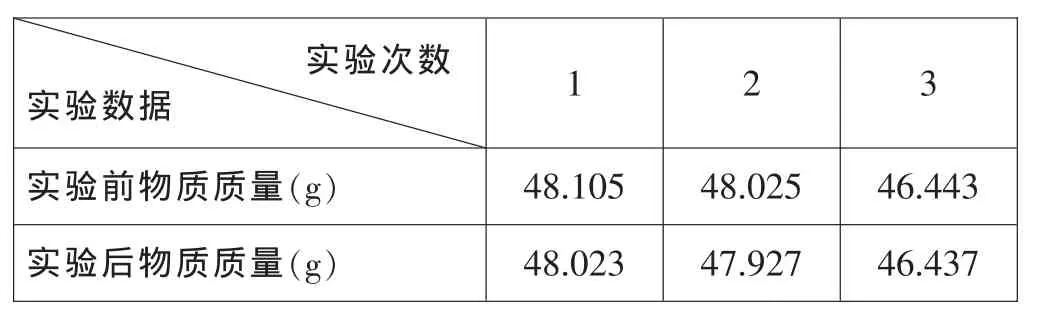
实验次数实验数据1 2 3实验前物质质量(g) 48.105 48.025 46.443实验后物质质量(g) 48.023 47.927 46.437
从实验数据来看,实验后物质总质量比反应前物质总质量减少。为什么反应后物质质量反而比反应前的少呢?从实验现象看镁燃烧有大量白烟生成。白烟的成分是什么?镁燃烧时所产生的白色烟雾,那不是氧化镁,也与氧化镁无关。它的产生原因是:当镁在有限的空气中燃烧时,除了生成氧化镁外,同进还生成一定数量的氮化镁,反应式为3Mg+N2=点燃Mg3N2。由于氮化镁易升华,是典型离子化合物。如果空气湿度较大,氮化镁会与水蒸气发生强烈的水解反应:Mg3N2+6H2O=3Mg (OH)2+2NH3。氢氧化镁和氨气散逸悬浮在气流中,大量逸出的白烟就是新生成的氢氧化镁。另外镁在氧气中燃烧温度很高,镁的熔点648.8℃,沸点1107℃,导致一部分镁沸腾并同时与氧气氮气反应分别生成氧化镁和氮化镁。镁条燃烧产生大量白烟不仅含有氢氧化镁还有氧化镁小颗粒。燃烧后得到的残留物必然少于理论产值。那么如何设计实验来验证反应后生成物的质量增多呢?
二、实验改进目的
质量守恒定律是化学基本定律,是教材重点内容。教材中设计镁在空气中燃烧实验,目的是让学生形成认知冲突,更全面地理解质量守恒定律。实验准确可信性就非常重要。为此,我对实验作了一定的改进,该实验便于教师演示,效果明显。
三、实验器材选取
镁在空气中燃烧时能够放出大量的热和产生很高的温度,使生产的氧化镁在高温下因灼热发出强烈的白光,对教师和学生视力有一定的危害。所以实验用量不宜过大。采用精确度高的电子天平(精确精确量为0.001g)只需取用0.005g左右的镁就有明显的效果。实验符合人性化要求。
本实验用到的电子天平最大量程仅为100g,采用150mL的塑料瓶代替集气瓶收集生成物。用镊子替代坩埚钳。
玻璃片替代石棉网是防止燃烧生成物溢出。在玻璃片上放置铜片以防止玻璃片炸裂。
四、实验步骤
1.取一定量的镁条连同玻璃片、铜片、塑料瓶和镊子一起放在电子天平上称量,记录所称的质量。
2.在酒精灯上将镁条点燃,塑料瓶罩在镁条上方(如下左图)。发现白烟填充到塑料瓶的中部时,迅速把燃烧的镁条放在放置在玻璃片上的铜片上,同时罩上塑料瓶。镁条燃烧,瓶中充满大量白烟(如下右图)。反应后的物质连同玻璃片、铜片、塑料瓶和镊子,一起放在电子天平上称量,分时间段记录质量。

3.分别取不同质量的镁条重复上述实验。实验数据分别填入下表:

实验后(镁条熄灭后)(g)1min 2min 3min 4min 5min第一次 89.013 88.987-88.887 88.935 88.993 89.017 89.022 89.023第二次 89.019 88.994-88.908 88.910 89.004 89.033 89.038 89.038第三次 89.012 88.984-88.884 88.900 88.990 89.019 89.021 89.021记录 实验前(g) 实验中(g)(熄灭前 30s)实验
从图表中可以发现,实验开始一段时间(即熄灭前30s),物质总质量在不断减少。这是由于燃烧释放大量的热导致部分镁沸腾变成气体,并与空气中气体发生反应生成氧化镁和氮化镁 (氮化镁同时分解生成氢氧化镁)以固体小颗粒形式分散到瓶中。实验后一段时间(3min以前)质量逐渐增大,由于反应生成的氧化镁和氢氧化镁悬浮于瓶中,随着时间的延长逐渐沉积在玻璃板上。致使天平示数不断升高。3min后天平示数明显大于反应前质量。待白烟消失,氧化镁和氢氧化镁全部沉积在玻璃片上,天平示数不再变化。整个实验现象非常明显,而且电子天平再现了整个反应过程质量动态变化。实验结果更具说服力。
[1] 课程教材研究所.义务教育课程标准实验教科书·化学(上)[M].北京:人民教育出版社,2006
[2] 金卫红.镁燃烧实验现象解析[J].杭州教育学院学报,2000,(7)

