抗生素菌渣理化特性
贡丽鹏,郭 斌,任爱玲,刘仁平,宋汉宁
(河北科技大学环境科学与工程学院,河北石家庄 050018)
抗生素菌渣理化特性
贡丽鹏,郭 斌,任爱玲,刘仁平,宋汉宁
(河北科技大学环境科学与工程学院,河北石家庄 050018)
以制药厂发酵土霉素、青霉素菌渣为研究对象,利用元素分析仪、原子吸收分光光度计、高效液相色谱仪以及差热-热重分析仪、氧弹热量计和傅里叶红外光谱仪分别对2种菌渣的理化特性进行分析。分析结果表明:菌渣中C,O元素含量较高,质量分数分别达到40%和30%以上,无机成分、重金属含量及多环芳烃含量均较低;菌渣中主要官能团为O—H和C—C,为蛋白质、纤维素等有机物质的特征官能团;菌渣的热解过程可分为3个阶段,第二阶段是热解的主要阶段,为挥发分的析出阶段,另外,土霉素菌渣和青霉素菌渣的热值分别为16.894MJ/kg和17.641MJ/kg。
抗生素;土霉素菌渣;青霉素菌渣;理化特性
菌渣是抗生素生产过程中产生的固体废物,其主要成分包括菌丝体、剩余培养基、发酵代谢产物和少量残留抗生素[1]。过去,大量的抗生素菌渣经干燥后被加工成动物饲料或者饲料添加剂使用,但由于抗生素菌渣做饲料容易引起动物的耐药性,并且由于未做安全性试验,存在各种安全隐患,因此于2002年被列入《禁止在饲料和动物饮用水中使用的药物品种目录》。由于抗生素菌渣产生量大、含水率高,处理费用高,有处理资质的单位数量少且处理能力有限,按照危险废物处理方式进行焚烧或填埋处置受到了限制,菌渣的处理问题日益突出[2]。
近年来,对于抗生素菌渣资源化利用的研究很少,李士坤等研究了从青霉素菌丝体中提取纯化核糖核酸的工艺条件[3]。华北制药集团将HB菌渣和青霉素菌渣混合后,采用微生物发酵技术,使菌渣中残留的HB及青霉素失活,并最终生产为有机肥料[4]。河北科技大学郭斌课题组以青霉素菌丝体为基本原料,确定了化学活化法制备菌丝体活性炭的工艺条件,具有良好的环境效益和社会效益[5-6]。但总体上来讲,菌渣的利用技术还不够成熟,且对其综合利用的技术研究甚少,甚至理化特性的研究也很少,因此,研究抗生素菌渣的理化特性,对于合理资源化利用抗生素菌渣具有重要意义。笔者选用石家庄市某制药厂土霉素、青霉素菌渣为研究对象,测试其物理特性及化学成分,以便为实现抗生素菌渣的综合利用和合理处置提供理论依据。
1 实 验
1.1 实验原料
抗生素菌渣是微生物制药发酵工艺中,过滤提取发酵滤液后剩余的滤渣。抗生素生产工艺及菌渣产生过程如图1所示。
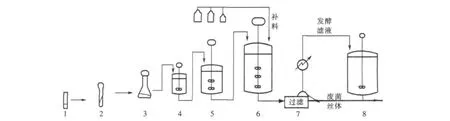
图1 抗生素发酵工序Fig.1 Process of antibiotics fermentation
实验选用样品取自石家庄市某制药厂抗生素生产工艺正常运行时过滤后的菌渣,从菌渣堆中以四分法的方式取样,取回的湿菌渣放于烘箱,在105℃条件下干燥24h,然后经研磨后使其全部通过200目(75 μm)标准筛,后置于玻璃干燥器中备用。
1.2 实验方法
抗生素菌渣的工业分析依据国家标准(以下简称为国标)《煤的工业分析方法》(GB/T 212—2008)进行分析,元素分析采用荷兰帕纳科公司生产的Vario EL CUBE元素分析仪。重金属Hg,Cr,Cd,Pb,Zn的含量根据国标GB/T 15555—1995采用原子吸收分光光度法测定;Ni采用丁二酮肟分光光度法测定;As采用二乙基二硫代氨基甲酸银分光光度法测定。无机成分采用国标《粘土化学分析方法》(GB/T 16399—1996)进行测定。
多环芳烃采用美国产Agilent-1100型高效液相色谱仪进行测定,分析中采用荧光检测器进行检测。色谱条件为色谱柱:Agilent 250mm×4.6mm,反相,C18柱;柱温:30℃;流动相:甲醇/水;流动相流速:1mL/min;梯度淋洗。
差热-热重(TG-DT)分析采用日本岛津公司生产的DTG-60H差热-热重分析仪(thermogravimetric differential thermal analysis,TG-DTA),在氮气氛围下进行分析(氮气流量为40mL/min,升温速率为10℃/min,测试温度范围为室温至1 400℃)。热值采用XRY-1B氧弹热量计进行测定,仪器热容量为12 000 J/℃左右。仪器采用恒温式测量模式,氧气钢瓶压力要求在5MPa以上,减压阀输出压力为2.8~3.0 MPa,充氧时间不少于15s。
官能团的测定采用美国热电公司生产的Nicolet 6700型傅里叶红外光谱仪,波数范围为400~4 000cm-1,仪器选配的漫反射附件为椭面会聚系统漫反射装置。谱图测试条件:常规透射吸收时分辨率为4cm-1,扫描次数为32次。
2 结果与讨论
2.1 化学特性分析
抗生素菌渣的化学特性分析对其资源化利用有重要意义,表1是依据GB/T 212—2008进行的菌渣工业分析和采用Vario EL CUBE元素分析仪测得的元素分析的结果,表2是菌渣无机成分化学分析结果。由此可以看出:
1)土霉素菌渣中挥发分含量(以下各成分含量均以质量分数表示)最高,可达65.92%,水分含量较低,为5.07%,其余的为灰分(11.49%)和固定碳(17.52%),青霉素菌渣中挥发分含量(71.17%)和水分含量(12.65%)均高于土霉素菌渣中的相应含量,而灰分(6.42%)和固定碳(9.76%)的含量明显较低。菌渣中挥发分含量高主要是因为含有大量的有机培养基、代谢产物和一部分菌丝体。
2)2种菌渣中C和O含量都较高,质量分数分别达到40%和30%以上,这是由于菌渣中含有大量有机物的缘故还含有少量的H,N,S[7]。
3)菌渣中含有一定量的无机成分,含量相对较低,这主要来自于菌渣中含有剩余的培养基。
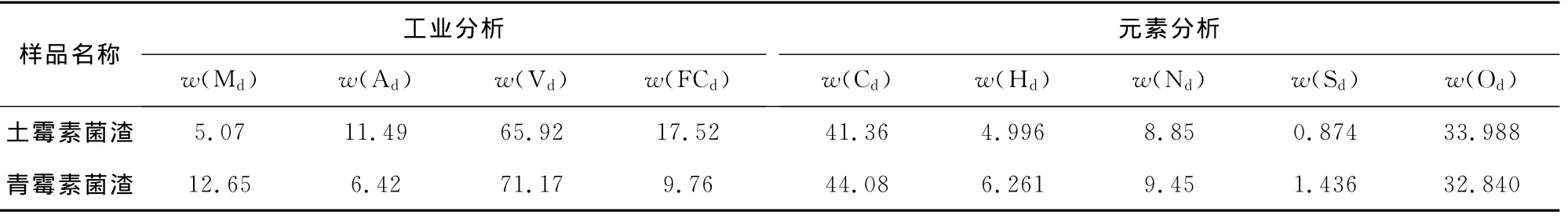
表1 菌渣工业分析和元素分析Tab.1 Proximate and ultimate analysis of bacterial residue %

表2 菌渣无机成分质量分数Tab.2 Inorganic components of bacterial residue %
2.2 重金属含量测定
抗生素菌渣中含有重金属,重金属在菌渣的存放和处置过程中会以金属离子的形式进入土壤和地下水。因此,测定菌渣中重金属离子的含量是有必要的,若含量高于相关标准,就必须加以去除,防止形成二次污染。表3为土霉素菌渣和青霉素菌渣中重金属含量测定结果。
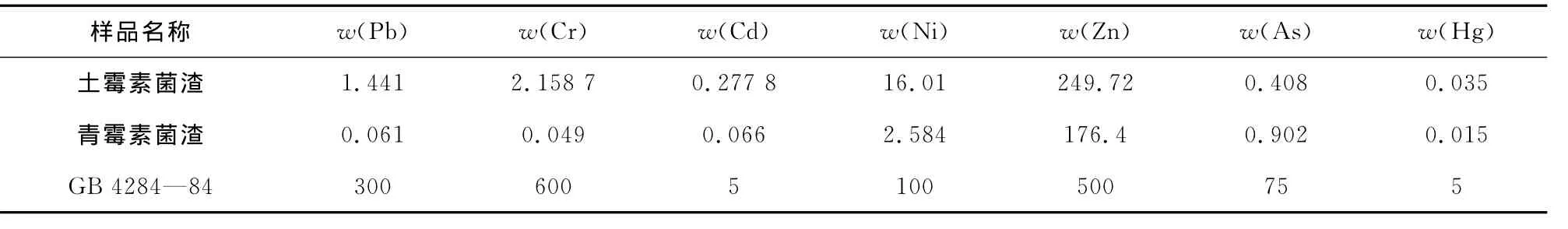
表3 菌渣重金属质量分数Tab.3 Content of heavy metals in bacterial residue mg/kg
由表3可知,土霉素菌渣中重金属含量由高到低依次为Zn,Ni,Cr,Pb,As,Cd,Hg;青霉素菌渣中重金属含量除As以外,其他元素含量都低于土霉素中相应重金属的含量。按照中国《城镇污水处理厂污染物排放标准》(GB 18918—2002)规定的污泥农用时(在酸性土壤上)污染物的控制标准限值,2种菌渣中重金属含量均远远小于规定限值。
2.3 多环芳烃分析
多环芳烃(PAHs)是指2个以上苯环以稠环形式相连的半挥发性有机污染物,具有致癌、致畸、致突变等毒性,在环境介质中持久存在,且易于在生物体内富集,对人体健康威胁很大,因此,其引起的环境和生态污染的持久性问题已受到广泛关注。抗生素菌渣中PAHs主要通过某些细菌、藻类和植物的生物合成产物而得到,如果得不到有效隔离控制,释放出来后会通过多种途径进入到土壤和水体等环境介质中去。因此,在对土霉素菌渣的安全使用或处置时,测定其中的多环芳烃是很有必要的。15种PAHs作为优先控制污染物,其测定结果如表4所示。
由表4可见,菌渣中含有14~15类多环芳烃,其中土霉素菌渣中PAHs含量相对较低,其总含量为607.24μg/kg,而青霉素菌渣中PAHs总含量为844.64μg/kg,在这些PAHs中苯并[a]蒽、苯并[b]荧蒽、苯并[k]荧蒽、二苯并[a,h]蒽属于致癌物质,苯并[a]芘为致突变物质,它们的相对含量相对较低(质量分数<0.1%),低于国家危险固体废物鉴别标准(GB 5085.6—2007)中规定的多环芳烃的物质含量。
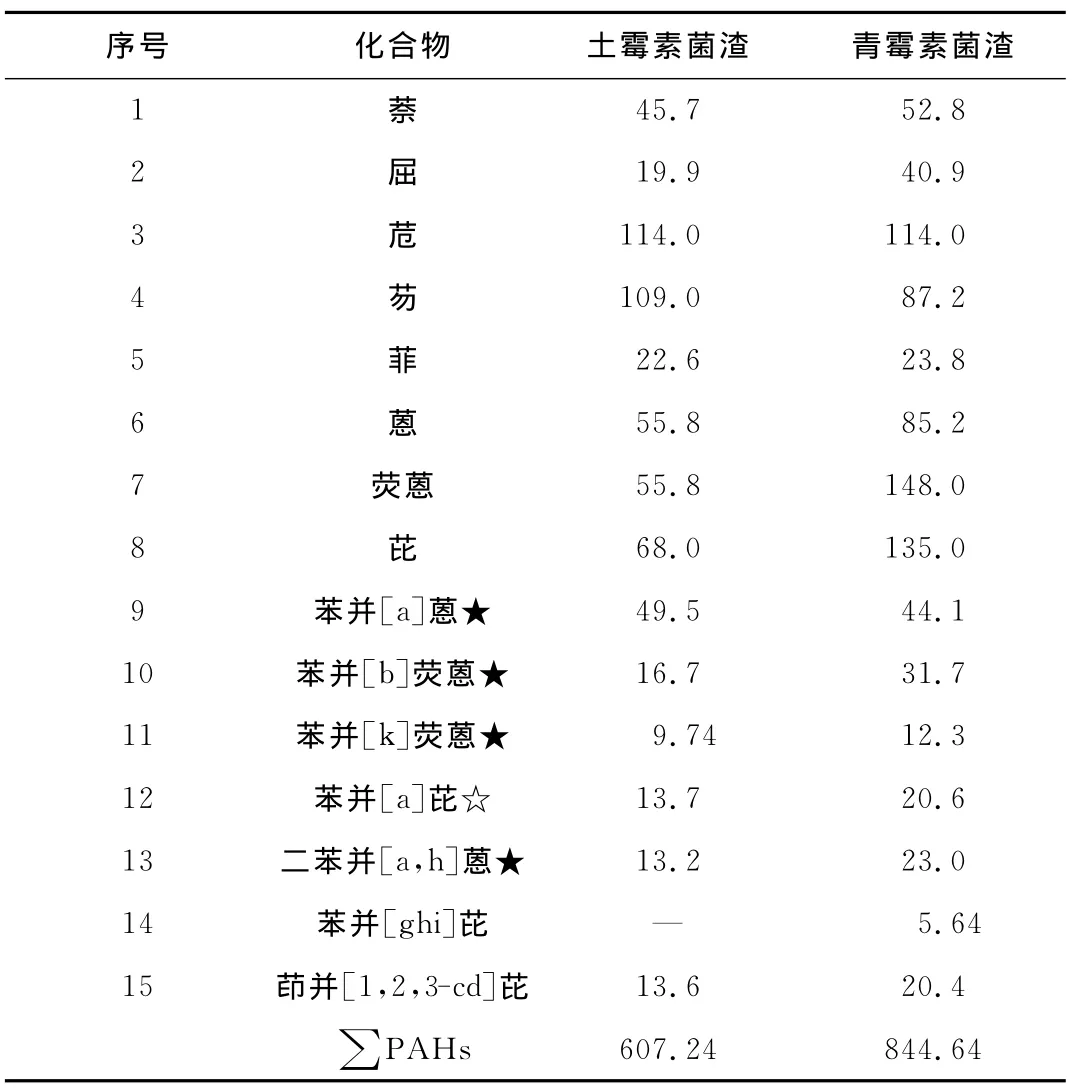
表4 菌渣中多环芳烃的含量Tab.4 Result of polyaromatic hydrocarbon content μg/kg
2.4 X射线光电子能谱分析
笔者对2种抗生素菌渣进行X射线光电子能谱分析(以下简称能谱分析),确定其中元素种类以及含量,为用菌渣热解后产生的热解焦炭做活性炭提供科学有利的数据支持(见图2)。

图2 土霉素菌渣和青霉素菌渣X射线光电子能谱分析图Fig.2 Electron spectroscopy of terramycin bacterial residue and penicillin bacterial residue
图2a)为土霉素菌渣能谱分析,由能谱分析显示,其中主要元素为C和O,还有少量的Ca,P。其质量分数见表5,其中C,O质量分数分别为46.88%和40.46%;图2b)为青霉素菌渣能谱分析,显示菌渣中含有C,O,Al,Ca和Si,而C,O元素质量分数较高,分别为50.39%和38.25%。能谱分析结果与元素分析结果相比均偏高,但基本吻合,这主要与扫描范围有关[8]。

表5 X射线光电子能谱分析结果Tab.5 X-ray photoelectron spectroscopy analysis %
2.5 傅里叶红外光谱分析
傅里叶红外(fourier-transform infrared,FTIR)分析是一种微区分析技术,其测试样品不受晶质和非晶质限制,依据对红外光谱图上吸收带的分析,可从中了解土霉素菌渣中有机质的化学结构及其变化[9]。
图3a)为土霉素菌渣的傅里叶红外光谱图[10],由图显示:在波数为3 426cm-1处出现宽而较强的吸收峰,为糖类、脂类分子中的O—H伸缩振动产生的吸收峰;在2 900cm-1先后出现2个吸收峰,分别为饱和碳氢化合物中甲基和亚甲基的C—H伸缩振动吸收峰;在波数为2 089cm-1处为C≡C的伸缩振动;在1 617 cm-1出现强吸收峰,主要是由于C ═C的伸缩振动,1 449cm-1处峰较弱,为C—CH3不对称弯曲振动峰,脂肪胺的C—N伸缩振动,其位置主要取决于氢键缔和的程度,一般在1 220~1 030cm-1处有一较弱的峰;779cm-1处为芳环 ═C—H面外弯曲振动;波数517cm-1为—S—S—[11-12]。
图3b)为青霉素菌渣傅里叶红外光谱图。在3 400cm-1处出现强吸收峰,为O—H伸缩振动产生的特征吸收峰;2 850cm-1处的吸收峰代表C—H伸缩振动吸收峰;1 654cm-1处出现窄而强的吸收峰为菌渣中烯烃化合物C ═C的伸缩振动产生的吸收峰;1 000cm-1左右有一较强吸收峰为脂肪胺C—N伸缩振动。
由以上分析可知菌渣中主要含有饱和烷烃及糖类、脂类化合物。

图3 土霉素菌渣和青霉素菌渣的傅里叶红外光谱图Fig.3 FTIR analysis of terramycin bacterial residue and penicillin bacterial residue
2.6 菌渣的热解特性
抗生素菌渣的热解过程包含了诸多发生在颗粒表面的复杂的多相物理化学过程。对于抗生素菌渣的处理目前还没有更好的办法,填埋处理含水率高、运输困难;焚烧容易产生二次污染。所以热解法处理抗生素菌渣成为比较合适的资源化利用方法,本文研究菌渣的热解特性为抗生素菌渣的热解处理提供理论支持。图4为菌渣样品在20℃/min升温速率下的失重(TG)和微分失重(DTG)曲线。
从图4a)可以看出,在升温速率一定的情况下,随着温度的升高,菌渣的热解大致可分为水分析出、挥发分析出和炭化3个阶段。第1阶段为水分析出阶段,这一阶段发生微量的失重,失重率约为7.6%,温度为40~220℃,在温度较低时失去游离水,而在较高温度时则是失去分子中的结晶水。第2个阶段为挥发分析出阶段,温度为220~800℃,该阶段是热解过程的主要阶段,失重率达到75%,此阶段又可细分为2个阶段,即低温热解阶段和高温热解阶段。在低温热解阶段,当温度为325℃时,DTG曲线上的波峰代表蛋白质和可溶性多糖的热解,在500~750℃时内先后出现3个肩状峰,主要代表细胞壁、纤维素等不溶性多糖的热解,从DTG曲线可以看出低温范围内挥发分热解析出速率明显高于高温热解[13-14]。第3个阶段是800~1 000℃的炭化阶段,随着剩余物的缓慢分解,最后剩下无机灰分和固定碳。
青霉素菌渣与土霉素菌渣热解特性的不同之处在于热解的第2阶段和第3阶段,第2阶段温度为220~500℃,失重很明显,失重率约为60%,在310℃处DTG曲线出现峰值,而且整个过程只出现一次峰值,这一阶段主要是大量蛋白质的热解,因为蛋白质热解温度较低。第3阶段温度为500~1 000℃,这一阶段挥发分热解很缓慢,失重率约为20%,相对应的DTG也没出现峰值,主要为低温难热解物质(如纤维素等)的热解,最后剩下的为灰分和固定碳。造成这种现象的原因为青霉素菌渣中蛋白质含量高于土霉素菌渣中的含量,且含量相对较高,所以在较低、较窄温度范围内发生热解,之后其他难热解成分继续热解。
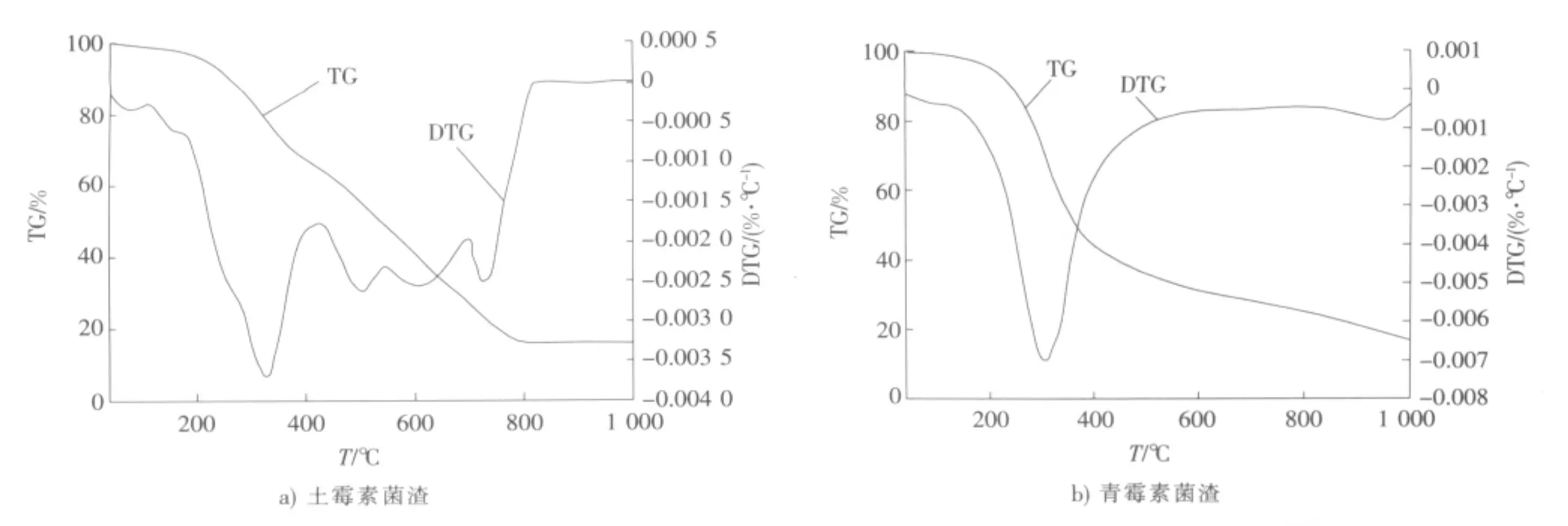
图4 土霉素菌渣和青霉素菌渣在20℃/min升温速率下的TG和DTG曲线Fig.4 TG and DTG curves at heating rate of 20℃/min of terramycin bacterial residue and penicillin bacterial residue
2.7 热值分析
抗生素菌渣作为一种资源,不能直接燃烧处理,否则会形成二次污染。菌渣可以通过热解处理,产物为热解焦炭,测定菌渣的热值与热解焦炭的热值作对比。土霉素菌渣、青霉素菌渣热值分析结果如表6所示。
由表6可以看出,土霉素菌渣、青霉素菌渣的氧弹发热量分别为16.894MJ/kg和17.641 MJ/kg,高于高位发热量[15]。主要是因为氧弹发热量是在有过剩氧气的条件下,弹筒内燃烧产物为二氧化碳、硫酸、硝酸、呈液态的水和固态的灰渣,而高位发热量是样品在空气中燃烧时,其中的硫只生成二氧化硫,氮则成为游离氮逸出,稀硫酸和稀硝酸在形成过程中要生成热,从氧弹发热量中减去上述2种稀酸的生成热后的热量就是菌渣的高位发热量。高位发热量高于低位发热量,原因是样品在空气中燃烧与在氧弹中燃烧的另一个不同点是,在空气中燃烧时,菌渣中的全部水分(包括菌渣中原有的和燃烧后生成的水)都呈水蒸气状态而排出,而在氧弹中燃烧时,水蒸气则凝集成液态水,保留在弹筒内。菌渣的高位发热量减去水的蒸发热就是菌渣的低位发热量[16]。

表6 菌渣热值分析结果Tab.6 Calorific value of bacterial residue MJ/kg
3 结 论
1)根据能谱分析及元素分析结果得出,菌渣中C和O含量较高,工业分析得出2种菌渣中大部分物质为挥发分,质量分数都达到65%以上,水分含量较低,其主要官能团为C—O和C—C。
2)菌渣的热解过程分为水分析出、挥发分析出和炭化3个阶段,其中第2阶段为热解的主要阶段,土霉素菌渣热解温度为220~800℃,为所有挥发分的热解,失重率达到75%,青霉素菌渣热解温度为220~500℃,为蛋白质的热解,失重约为60%。
3)菌渣中7种重金属及多环芳烃含量均较低,均低于国家相关标准。
[1] 成建华,张文莉.抗生素菌渣处理工艺设计[J].医药工程设计杂志(Pharmaceutical Engineering Design),2003,24(2):31-34.
[2] 周保华,高 勤,王洪华,等.青霉素、土霉素菌渣研究利用现状及特性分析[J].河北工业科技(Hebei Journal of Industrial Science and Technology),2011,28(5):291-294.
[3] 李士坤,谭天伟.从青霉菌丝体中提取核糖核酸的研究[J].北京化工大学学报(自然科学版)(Journal of Beijing University of Chemical Technology(Natural Science Edition)),2005,32(6):23-26.
[4] 梁 栋,王 民.菌渣生产有机肥技术通过鉴定[J].中国乡镇企业技术市场(China Township Enterises Technical Market),2004(10):48.
[5] 刘波文,周保华,郭 斌.青霉素菌丝体处理及制备活性炭的研究[A].中国环境科学学会学术年会论文集[C].北京:[s.n.],2009.618-623.
[6] GUO B,ZHOU B H,LIU B W,et al.Studies on characteristics of mycelium from biopharmaceutical industry[A].Bioinformatics and Biomedical Engineering(iCBBE)[C].[S.l.]:[s.n.],2010.1-4.
[7] 焦其帅,胡永琪,陈瑞珍,等.氯化锌活化法制备棉花秸秆活性炭的研究[J].河北工业科技(Hebei Journal of Industrial Science and Technology),2010,27(4):232-235.
[8] BAER D R,ENGELHARD M H.XPS analysis of nanostructured materials and biological surfaces[J].Journal of Electron Spectroscopy and Related Phenomena,2010(178-179):415-432.
[9] 李庆钊,林柏泉,赵长遂,等.基于傅里叶红外光谱的高温煤焦表面化学结构特性分析[J].中国电机工程学报(Proceedings of the CSEE),2011,31(32):46-52.
[10] 谢晶曦,常俊标,王绪明.红外光谱在有机化学和药物化学中的应用[M].北京:科学出版社,2001.
[11] ARYEE A N A,VOORT F R V D,SIMPSON B K.FTIR determination of free fatty acids in fish oils intended for biodiesel production[J].Process Biochemistry,2009,44(4):401-405.
[12] ERTAS M,ALMA M H.Pyrolysis of laurel(LaurusnobilisL.)extraction residues in a fixed-bed reactor:Characterization of bio-oil and bio-char[J].Journal of Analytical and Applied Pyrolysis,2010,88(1):22-29.
[13] 刘树炜,吴创之,赵増立.海藻热解动力学特性研究[J].能源工程(Energy Engineering),2008(1):11-15.
[14] 赵 辉,闫华晓,张萌萌,等.海洋生物质的热解特性与动力学研究[J].生物技术通报(Biotechnology Bulletin),2010(4):135-140.
[15] 矫常命,何 芳.玉米秸秆热解液体产物热值的测定[J].山东理工大学学报(自然科学版)(Journal of Shandong University of Technology(Natural Science Edition)),2006,20(2):11-13.
[16] 檀双英,易德礼,赵志根.煤发热量含义及其相互关系[J].标准化报道(Reporting of Standardization),2000,21(4):15-16.
Physical and chemical properties of antibiotics bacterial residue
GONG Li-peng,GUO Bin,REN Ai-ling,LIU Ren-ping,SONG Han-ning
(College of Environmental Science and Engineering,Hebei University of Science and Technology,Shijiazhuang Hebei 050018,China)
This paper is to characterize terramycin and penicillin bacterial residues from the microbial fermentation process in the pharmaceutical industry.Element analyzer instrument,atomic absorption spectrophotometer(AAS),high performance liquid chromatography(HPLC)analysis,DTG-60Hinstrument,XRY-1Boxygen bomb calorimeter and Fourier transform infrared spectrometer(FTIR)are employed to identify the two samples in order to investigate the physical and chemical characteristics.The results show that the bacterial residues contain characteristically high carbon and oxygen levels,which are more than 40% and 30%,respectively.The concentrations of inorganic components,seven heavy metals(Pb,Cr,Cd,Zn,As,Ni and Hg)and polycyclic aromatic hydrocarbons(PAHs)are low.The main functional group are O—H and C—C,which are the characteristic functional groups of protein,cellulose and other organic substances.The pyrolysis process of terramycin and penicillin bacterial residues has three stages,and most of the organic materials are decomposed at the second stage.Additionally,the calorific values of terramycin and penicillin bacterial residues are 16 894kJ/kg and 17 641kJ/kg,respectively.
antibiotics;terramycin bacterial residue;penicillin bacterial residue;physical and chemical properties
X705
A
1008-1542(2012)02-0190-07
2011-08-29;责任编辑:王海云
国家环保部环保公益性行业科研专项(2011467004)
贡丽鹏(1985-),男,河北鹿泉人,硕士研究生,主要从事大气污染控制和固体废物资源化方面的研究。
郭 斌教授。E-mail:gbin69@163.com

