时间、固液比、pH值、离子强度、腐殖酸等因素对钴离子在凹凸棒石上吸附的影响
池亚玲,陈元涛,*,邵大冬,张 炜,刘 霞,徐江波,赵文华
1.青海师范大学 化学系,青海 西宁 810008;2.中国科学院 等离子体物理研究所,安徽 合肥 230031
近年来环境污染问题已成为世人最关注的问题之一。60Co(Ⅱ)在科学研究领域应用广泛,主要应用于核反应堆、工业、医疗、食品等行业,大量的钴存在于核反应堆排放的废水中,对环境和人类健康造成的危害非常大。60Co(Ⅱ)半衰期5.271a,发射能量很高(1.173、1.333MeV)的γ射线,属于高毒性放射性核素;如大量摄入或遭受大剂量外照射,能导致脱发,会严重损害人体血液内的细胞组织,造成白细胞减少,引起血液系统疾病,如再生性障碍贫血症,严重的会使人患上白血病(血癌),甚至死亡[1-3]。因此分离提取钴具有重要的意义。
化学污染物在环境中的吸附行为与其所处的环境条件密切相关。譬如这些污染物与土壤及矿物表面相互作用形成沉淀等,显著影响了它们在环境中的扩散和迁移行为。黏土是自然界中普遍存在的天然矿物,其层间存在永久电荷,且有相对大的比表面积。因此,环境污染物,尤其是金属离子类环境污染物与粘土表面的吸附或交换作用一直是科研人员关注的焦点[4]。
凹凸棒石(attapulgite)又名坡缕石或坡缕缟石(palygorskite),是指以凹凸棒石(attapulgite)为主要组分的一种粘土矿物,是一种层链状结构的含水富镁铝硅酸盐粘土矿物,其理想分子式为:(Mg,Al,Fe)5Si8O20(HO)2(OH2)4·4H2O,其晶体结构由硅氧四面体和镁氧八面体交错排列形成。独特的纳米棒状晶体结构(晶体颗粒直径约为40nm)和发育的微孔孔道、独特的链层状结构赋予了其许多特殊的物理化学性能,具有离子交换、物理吸附、承载微量元素和黏膜保护等特性。
本工作拟选择凹凸棒石作为吸附剂,研究其对60Co(Ⅱ)的吸附性能。研究内容有:(1)研究时间和固液比对吸附的影响;(2)研究pH值及离子强度对吸附的影响;(3)研究腐殖酸对吸附的影响;(4)研究电解质离子对吸附的影响。
1 实验部分
1.1 试剂
凹凸棒石(甘肃),60Co(Ⅱ)的标准储备液(购买于中国原子能科学研究院),FA(甘肃土壤提取),HNO3、NaCl、NaOH、KNO3、NaNO3、LiNO3、HAc、NaAc、二甲酚橙均为市售分析纯,实验用水为二次蒸馏水。
1.2 仪器
AL204型电光分析天平(感量0.000 1g)、pH-3B型精密pH计,上海梅特勒-托利多仪器有限公司;微量连续可调移液器,北京青云航空仪表有限公司;SZ-2型自动双重纯水蒸馏器,上海沪西分析仪器有限公司;ZD-2型调速多用振荡器,江苏金坛市金城国胜实验仪器厂;LG10-2.4A型高速离心机,北京医用离心机厂;722型分光光度计,上海光谱仪器有限公司。
1.3 实验方法
依次向聚乙烯离心管中加入一定量的凹凸棒石吸附剂悬浮液和一定离子强度的电解质溶液平衡24h,然后加入含一定浓度的60Co(Ⅱ)离子溶液,用微量的HNO3或NaOH调节体系的pH值至所需值。然后将混合均匀的悬浮液,室温下在振荡器上振荡48h,在8 000r/min下 离 心15min,取一定体积的上清液,用分光光度法测定上清液中60Co(Ⅱ)的浓度。所有实验数据都是2次实验的平均值,数据误差约为5%。
凹凸棒石对60Co(Ⅱ)的吸附百分数(Y)和分配系数(Kd)分别用公式(1)、(2)计算。

式中:c0代表60Co(Ⅱ)离子的初始浓度,mol/L;ce代表离心后上清液中60Co(Ⅱ)离子的浓度,mol/L;m代表吸附质凹凸棒石的质量,g;V代表溶液的体积,mL。

图1 时间对凹凸棒石吸附60 Co(Ⅱ)的影响Fig.1 Effect of contact time on the sorption of Co(Ⅱ)on attapulgite pH=6.8±0.1,T=293.15K,c0(NaNO3)=0.01mol/L,m/V=0.6g/L,c0(Co(Ⅱ))=1.02×10-4 mol/L
2 结果与讨论
2.1 时间对凹凸棒石吸附60Co(Ⅱ)的影响
图1表示60Co(Ⅱ)在凹凸棒石上的吸附百分数随接触时间变化的关系。实验条件为pH=6.8±0.1,离子强度为0.01mol/L NaNO3。从图1可知,在开始的4h内,60Co(Ⅱ)在凹凸棒石上的吸附百分数随时间的增加吸附增加,吸附约5h后,吸附百分数随时间改变基本不变,此时可以认为吸附达到平衡。如此短的吸附平衡时间也说明了60Co(Ⅱ)在凹凸棒石上的吸附主要是化学吸附而不是物理吸附[5-6]。因此,以下实验选择接触时间至少20h,以使吸附达到完全平衡。
同时在图1上表示了60Co(Ⅱ)在凹凸棒石上吸附的动力学研究。准二级动力学方程的线性表达式如下:

式中:qt、qe分别为t时刻及平衡时凹凸棒石对钴的吸 附 量,mg/g;k′,准二级反应速率常数,g/(mg·h);t为振荡时间,h。通过t/qt对t作图,得到一条直线,通过直线的斜率和截距求得k′=0.18g/(mg·h),qe=5.04mg/g。线性相关系数(r2=0.99)非常接近1,说明了60Co(Ⅱ)在凹凸棒石上的吸附符合准二级动力学模型。
2.2 pH值及离子强度对凹凸棒石吸附60Co(Ⅱ)的影响
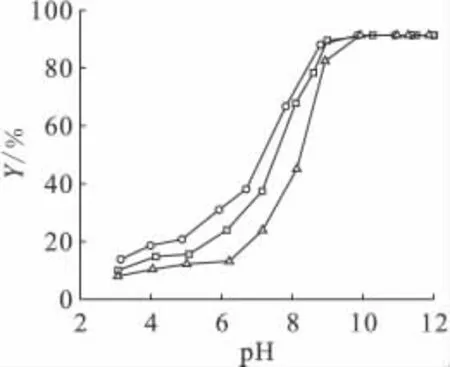
图2 pH值及离子强度对凹凸棒石吸附60 Co(Ⅱ)的影响Fig.2 Effect of ionic strength and pH on 60 Co(Ⅱ)sorption to attapulgite T=293.15K,m/V=0.6g/L,c0(Co(Ⅱ))=1.02×10-4 mol/L c0(NaNO3),mol/L:○——0.001,□——0.01,△——0.1
溶液pH值是影响重金属吸附的最重要因素之一。在离子强度分别为0.001、0.01、0.1mol/L NaNO3下,凹凸棒石吸附60Co(Ⅱ)随pH值的变化示于图2。从图2可以看出,60Co(Ⅱ)吸附受到体系pH值的强烈影响。在pH<6的范围内,60Co(Ⅱ)的吸附率随pH值的增大缓慢提高;在pH=7~9的范围内,60Co(Ⅱ)的吸附率随pH值的增大急剧提高;在pH>9时,60Co(Ⅱ)的吸附随pH值的增大保持高吸附率不变。究其机理,60Co(Ⅱ)在凹凸棒石上的吸附依赖于其晶体结构和表面的化学性质。凹凸棒石的表面存在2种吸附位,即≡XOH(弱位)和≡YOH(强位)[7],凹凸棒石的表面官能团在液相体系中可能以2种方式与质子相互作用:(1)当pH值较低时,体系中H+浓度较高,凹凸棒石表面的活性基团被质子化,以形态占主导,质子化基团与带正电荷的Co2+存在静电力,H+会与Co2+竞争吸附位点;(2)当pH=7~9时吸附率陡升,这是因为≡YO-和≡XO-两种形态同时存在。由于60Co(Ⅱ)和凹凸棒石之间的表面络合作用得到加强,因此吸附率也随之提高。Tewari等[8-9]研究了60Co(Ⅱ)在氧化物Fe3O4、Al2O3、MnO2、TiO2和ZiO2上的吸附,发现在体系pH=5~8时,吸附率显著增加。因而Co(Ⅱ)在氧化物和凹凸棒石上的吸附具有相似的吸附现象。在该pH值范围内,60Co(Ⅱ)在凹凸棒石上的吸附强烈地依赖于体系的pH值,同时也说明了此pH值范围内的吸附机理主要是表面络合[10]。
2.3 固液比对凹凸棒石吸附60Co(Ⅱ)的影响
固液比也会明显影响凹凸棒石对60Co(Ⅱ)的吸附。图3是60Co(Ⅱ)在凹凸棒石上的吸附随固液比变化而变化的趋势。溶液中60Co(Ⅱ)的去除率随溶液中凹凸棒石浓度的增加而增加。由于体系中吸附剂浓度的增大,其总比表面积和官能团也随之增加,因此为60Co(Ⅱ)生成表面络合物提供了更多有效的吸附位。

图3 固液比对凹凸棒石吸附60 Co(Ⅱ)吸附的影响Fig.3 Sorption of 60 Co(Ⅱ)on attapulgite as a function of solid-to-liquid ratio pH=6.8±0.1,T=293.15K,c0(NaNO3)=0.01mol/L,m/V=0.6g/L,c0(Co(Ⅱ))=1.02×10-4 mol/L
60Co(Ⅱ)在凹凸棒石上的分配系数Kd随固体浓度变化趋势也显示在图3中。从图3可以看出,分配系数Kd几乎不受吸附剂浓度的影响,这是因为分配系数Kd是代表其吸附能力的一个指标,而一般不受吸附剂浓度的影响。
2.4 富啡酸FA对凹凸棒石吸附60Co(Ⅱ)的影响
富啡酸是广泛存在于水体中的大分子天然有机物,其表面包含大量的活性基团,这就使得富啡酸表面带有较多的负电荷,因而与水中的重金属离子可能发生一系列反应。水体中的富啡酸类有机物与重金属离子的络合反应使重金属离子容易保持溶解状态,易于发生迁移并有利于有机体吸收。由于富啡酸对重金属离子的存在形式有着重要的影响,因此有必要研究富啡酸对重金属离子去除的影响。
在FA存在和不存在情况下,60Co(Ⅱ)在凹凸棒石上的吸附百分数与pH值关系示于图4。pH<7时,FA对60Co(Ⅱ)吸附的影响不明显,在高pH值下FA减弱了对60Co(Ⅱ)吸附。这是由于在低酸度下FA以球面形态存在于溶液中,或者被吸附在固体颗粒上[11],这种球形结构使得大量的官能团不能与金属离子形成络合物。在高pH值下,FA表面充满了负电荷,此时凹凸棒石的表面也由于pH值的增加导致表面负电荷浓度增加,从而使得FA在凹凸棒石表面的吸附由于静电排斥作用而有所减弱,进而使得这部分被排斥的FA以FA-Co(Ⅱ)化合物的形式存在于溶液中,从而导致了Co(Ⅱ)在凹凸棒石上的吸附减弱[12-13]。

图4 腐殖酸FA对凹凸棒石吸附60 Co(Ⅱ)的影响Fig.4 Effect of FA on 60 Co(Ⅱ)sorption to attapulgite as a function of pH T=293.15K,c0(NaNO3)=0.01mol/L,m/V=0.6g/L,c0(Co(Ⅱ))=1.02×10-4 mol/L
2.5 电解质离子对凹凸棒石吸附60Co(Ⅱ)的影响
在离子强度分别为0.01mol/L NaClO4、0.01mol/L NaNO3和0.01mol/L NaCl时,60Co(Ⅱ)在凹凸棒石上的吸附百分数随凹凸棒石浓度的变化关系示于图5。由图5可知,在3种电解质中60Co(Ⅱ)的吸附效果这种现象可能是因为以下几个原因:(1)Cl-和与60Co(Ⅱ)具有很强的配位作用,形成可溶性的配合物等[14-15],而的 配 位能力比较弱,几乎不能与Co2+形成配合物;(2)Cl-较和更容易吸附到凹凸棒石的表面,并且Cl-吸附在凹凸棒石表面,改变了凹凸棒石的性质,降低了其对Co2+的吸附[16];(3)3种离子在凹凸棒石表面上的吸附能力顺序为阴离子的存在改变了凹凸棒石表面的电荷状态,随无机酸根离子半径减小R(Cl-)),阴离子或无机酸根离子降低或占据了更多表面吸附位。多种原因作用的结果导致60Co(Ⅱ)的吸附百分数随阴离子种类的不同而变化[17-18]。

图5 阴离子对凹凸棒石吸附60 Co(Ⅱ)的影响Fig.5 Effect of foreign anions on 60 Co(Ⅱ)sorption to attapulgite as a function of pH T=293.15K,c0(NaNO3)=0.01mol/L,m/V=0.6g/L,c0(Co(Ⅱ))=1.02×10-4 mol/L

图6 阳离子对凹凸棒石吸附60 Co(Ⅱ)的影响Fig.6 Effect of foreign cations on 60 Co(Ⅱ)sorption to attapulgite as a function of pH T=293.15K,c0(NaNO3)=0.01mol/L,m/V=0.6g/L,c0(Co(Ⅱ))=1.02×10-4 mol/L
一般来说,单价碱离子对二价金属的吸附影响比较小[11]。图6为离子强度分别为0.01mol/L LiCl、0.01mol/L NaCl和0.01mol/L KCl时60Co(Ⅱ)在凹凸棒石上的吸附百分数随吸附剂凹凸棒石浓度变化的关系。由图6可知,在低酸碱度范围内,不同阳离子对60Co(Ⅱ)在凹凸棒石上的吸附影响较小。当pH<7时,同一pH值下60Co(Ⅱ)吸附量在K+离子体系中最小,在Li+离子体系中最大,这一顺序和其水合离子半径的大小顺序一致:R(K+)=0.232nm,R(Na+)=0.27nm和R(Li+)=0.34nm[19]。这说明阳离子能够改变凹凸棒石的表面性质从而影响凹凸棒石对60Co(Ⅱ)的吸附能力。Esmadi和Simm[19]报道过Li+/Na+/K+三种离子对Co(Ⅱ)在无定形Fe(OH)3上和Th(Ⅳ)在TiO2上吸附的影响,也得到了相似的结论。
3 结 论
本工作对60Co(Ⅱ)在凹凸棒石上的吸附性能进行了研究,考察了平衡时间、pH值及离子强度、固液比、富啡酸(FA)、电解质因素对凹凸棒石吸附性能的影响。根据实验结果和讨论可以得出下列结论:
(1)60Co(Ⅱ)在凹凸棒石上的吸附率受到体系pH值的强烈影响,吸附率随pH值的增大而增大,到一定程度后,吸附率保持稳定而不随pH值变化;
(2)低pH值下,离子强度对60Co(Ⅱ)在凹凸棒石上的吸附影响比较大,高pH值下,离子强度对60Co(Ⅱ)在凹凸棒石上的吸附影响不大;
(3)富啡酸(FA)是天然腐殖物质,低pH值下,对重金属离子60Co(Ⅱ)在凹凸棒石上的吸附影响不大,高pH值下其有抑制作用;
(4)60Co(Ⅱ)在凹凸棒石上的吸附,低pH值时受电解质的影响大,高pH值受电解质的影响小。
[1]Leggett R W.The Biokinetics of Inorganic Cobalt in the Human Body[J].Sci Total Environ,2008,389:259-269.
[2]Nordberg G.Assessment of Risks in Occupational Cobalt Exposures[J].Sci Total Environ,1994,150:201-207.
[3]Sabbioni E,Mosconi G,Minoia C,et al.The European Congress on Cobalt and Hard Metal Disease.Conclusions,Highlights and Need of Future Studies[J].Sci Total Environ,1994,150:263-270.
[4]Jenne E A.Adsorption of Metals by Geomedia[J].San Diego:Academic Press,1998,147:371-382.
[5]Fan Q H,Shao D D,Lu Y,et al.Effect of pH,Ionic Strength,Temperature and Humic Substances on the Sorption of Ni(Ⅱ)to Na-Attapulgite[J].Chem Eng J,2009,150:188-195.
[6]Hu J,Shao D D,Chen C L,et al.Plasma-Induced Grafting of Cyclodextrin Onto Multiwall Carbon Nanotube/Iron Oxides for Adsorbent Application[J].Phys Chem B,2010,114:6 779-6 785.
[7]邵大冬,许笛,王所伟,等.pH值和离子强度对放射性核素镍在MX-80黏土上的吸附影响和模型研究[J].中国科学B:化学,2008,38:1 025-1 034.
[8]Tewari P H,Campbell A B,Lee W.Adsorption of Co2+by Oxides From Aqueous Solution[J].Can Chem,1972,50:1 642-1 648.
[9]Tewari P H,Lee W.Adsorption of Co(Ⅱ)at the Oxide-Water Interface[J].Colloid Interface Sci,1975,52:77-78.
[10]周文斌,刘晓东等译.缓冲/回填材料——内蒙古高庙子膨润土性能研究[M].北京:原子能出版社,2007:33-34.
[11]Chen C L,Wang X K,Jiang H,et al.Direct Observation of Macromolecular Structures of Humic Acid by AFM and SEM[J].Colloids Surf A,2007,302:121-125.
[12]Zhao D L,Yang X,Zhang H,et al.Effect of Environmental Conditions on Pb(Ⅱ)Adsorption onβ-MnO2[J].Chem Eng,2010,164:49-55.
[13]Sheng G D,Li J X,Shao D D,et al.Adsorption of Copper(Ⅱ)on Multiwalled Carbon Nanotubes in the Absence and Presence of Humic or Fulvic Acids[J].Hazard Mater,2010,178:333-340.
[14]Bradbury M H,Baeyens B.Sorption of Eu on Naand Ca-Montmorillonites:Experimental Investigations and Modelling With Cation Exchange and Surface Complexation[J].Geochim Cosmochim Acta,2002,66:2 325-2 334.
[15]Jiménez-Reyes M,Solache-Ríos M,Rojas-Hernández A.Stability Constant of the EuCl2+Complex in Several Ionic Strength Media[J].Solut Chem,2002,31:131-138.
[16]Bourikas K,Hiemstra T,Van Riemsdijk W H.Ion Pair Formation and Primary Charging Behavior of Titanium Oxide[J].Langmuir,2001,17:749-756.
[17]Fan Q H,Shao D D,Hu J,et al.Comparison of Ni2+Sorption to Bare and ACT-Graft Attapulgites:Effect of pH,Temperature and Foreign Ions[J].Surf Sci,2008,602:778-785.
[18]Wan Y,Liu C.The Effect of Humic Acid on the Adsorption of REE on Kaolin[J].Colloids Surf A,2006,290:112-117.
[19]Esmadi F,Simm J.Adsorption of Cobalt(Ⅱ)by Amorphous Ferric Hydroxide[J].Colloids Surf A,1995,104:265-270.

