放射性核素63Ni(Ⅱ)在膨润土上的吸附
陈 亮,于少明,*,胡 君
1.合肥工业大学 化工学院,安徽 合肥 230009;
2.中国科学院 等离子体物理研究所,安徽 合肥 230031
近年来,有关放射性污染物处理的问题成为世人高度关注的问题之一。环境中放射性污染物主要来自核电以及核能应用中产生的核废物,除此之外还有一部分放射性废物来源于应用放射性同位素的工厂、医院以及研究机构所产生的废液[1]。63Ni(Ⅱ)是 核电站放射性废物的一种组成部分,且是常用的β射线源,主要用于气相色谱仪的电子捕获器、火灾报警器、测厚仪及电子管的发射极等方面[2],具有较长的半衰期(96.0a)。如不能采取及时有效的处理,将会对环境以及人类健康产生较大的影响。
膨润土通常是与众多矿物相伴生的一种非金属矿物,主要组成为蒙脱石,其化学式为Al2O3·4SiO2·3H2O[3]。蒙脱石特殊的结构性质决定了膨润土的基本性能,它是由2个硅氧四面体片层和1个插入其间的铝(镁)氧(羟基)八面体片层组成的2∶1型层状粘土矿物,属于单斜晶系[4]。膨润土这种特殊的结构使其具备良好的吸附性、悬浮性、分散性、可膨胀性和离子交换性能,从而被广泛用于冶金、农业、石化、机械、医药、钻井、建筑、环境等相关领域[5]。国内外有对膨润土吸附重金属离子及放射性核素的相关报道,如王所伟等[6]研究了Th(Ⅳ)在膨润土上的吸附行为,吸附过程符合Langmuir模型;Hu等[7]研究了胡敏酸对Eu(Ⅲ)在膨润土上的吸附影响,胡敏酸在pH>3时,对吸附起到抑制作用。
虽然膨润土被广泛用于吸附金属离子和有机污染物的研究,但是对其处理含63Ni(Ⅱ)等放射性废物方面的报道还很少见。本工作拟对膨润土进行表征和分析,并研究不同的实验条件对63Ni(Ⅱ)在膨润土上吸附的影响,以探讨膨润土对63Ni(Ⅱ)的吸附机理。
1 实验部分
1.1 试剂
实验所用的膨润土来源于安徽黄山,采用自然沉降法提纯[8],105℃干燥至恒重,过200目筛,其化学组成列于表1。
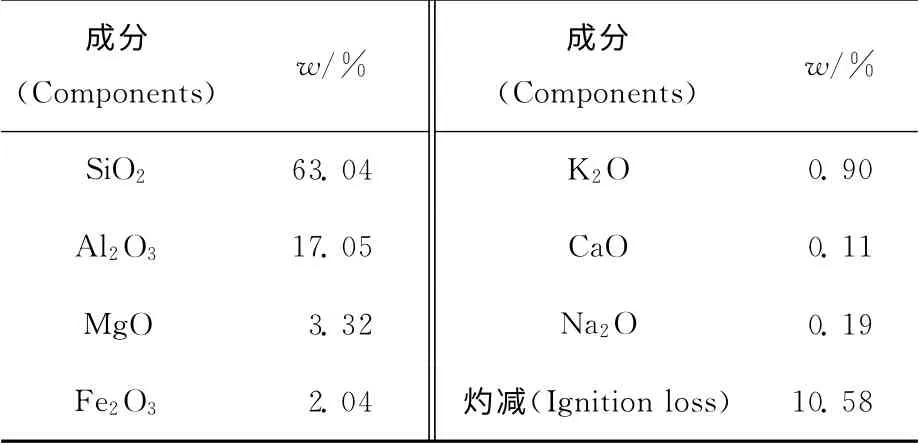
表1 黄山膨润土化学组成Table 1 Chemical composition of Huangshan bentonite
实验所用腐殖酸取自甘肃省华家镇的土壤,放射性示踪剂63Ni-NiCl2来自中国同位素公司,其余试剂均为市购,分析纯,且所有试剂均用去离子水配制。
1.2 主要仪器和设备
pH-3B型精密pH计,上海雷磁创益仪器仪表有限公司;AL204型电子分析天平,感量0.000 1g,梅特勒-托利多仪器(上海)有限公司;ZD-2型调速多用振荡器,江苏金坛市金城国胜实验仪器厂;LG10-2.4A型高速离心机,北京医用离心机厂;微量连续可调移液器,北京青云卓立精密设备有限公司;Packard3100TR/AB型液体闪烁计数器,美国PerkinElmer公司;D/max-γB型X射线衍射仪,日本理学电机公司;VECTOR-22型傅立叶变换红外光谱仪,瑞士BRUKER公司;JSM-6490LV型场发射扫描电子显微镜,日本电子公司。
1.3 实验方法
1.3.1 吸附实验 向聚乙烯离心管中加入一定量的膨润土悬浮液与设定离子强度电解质溶液预平衡24h,然后加入设定浓度的Ni(Ⅱ)和放射性63Ni-NiCl2示踪溶液,用微量NaOH或HCl溶液调节体系的pH值至所需值。然后将离心管在振荡器上恒温振荡24h后,于8 000r/min下离心20min分离固液相,用Packard 3100TR/AB型液体闪烁计数器测量上清液中63Ni-NiCl2的放射性计数。实验中假定稳定Ni(Ⅱ)与63Ni-NiCl2放射性示踪剂混合均匀,并且二者在膨润土上具有相同的吸附行为。
1.3.2 数据处理 基于上述假设,Ni(Ⅱ)在膨润土上的吸附率(Y)根据公式Y=100%×(Ctot-CL)/Ctot计算。式中CL是上清液中测得的63Ni-NiCl2放射性计数,Ctot是Ni(Ⅱ)储备液中初始63Ni-NiCl2的放射性计数。其中经实验验证,管壁吸附影响可忽略不计。所有的实验数据取自3次实验的平均值,相对误差小于5%。
2 结果和讨论
2.1 膨润土的表征
图1给出了膨润土的X射线衍射图。从图1可以看出,膨润土中的主要物相为蒙脱石,其次为石英。

图1 膨润土的XRD图谱Fig.1 XRD pattern of bentonite
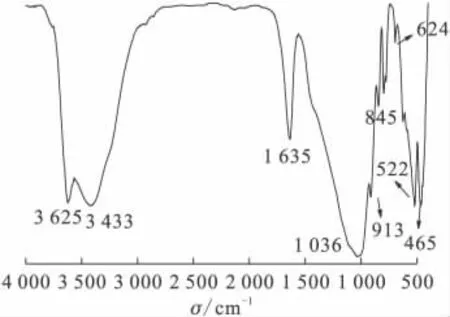
图2 膨润土的FTIR光谱图Fig.2 FTIR spectra of bentonite
图2是膨润土的FTIR谱图。如图2所示,在3 625、3 433cm-1处的吸收峰分别是蒙脱石晶格上的结构羟基伸缩振动峰与膨润土中吸附水所对应的伸缩振动吸收峰[4]。1 635cm-1处的吸收峰归因于水分子的弯曲振动。在1 036cm-1附近存在强吸收峰对应的是Si—O伸缩振动吸收峰,而在913、845cm-1附近存在的吸收峰分别对应Al—Al—OH和Al—Mg—OH的弯曲振动吸收峰。624cm-1处的吸收峰对应的是成对的Al—O和Si—O的外层吸收峰。522、467cm-1附近存在的吸收峰分别对应Al—O—Si和Si—O—Si的弯曲振动吸收峰。
图3给出了膨润土的SEM图。从图3可以明显看到典型的膨润土片层结构。
2.2 吸附时间的影响
图4是吸附时间对膨润土吸附Ni(Ⅱ)的影响。由图4可见,Ni(Ⅱ)在7h内即可达到吸附平衡,由此可见吸附速率较大。以下实验吸附时间均采取24h,以保证吸附达到完全平衡。如此快速地达到平衡,说明Ni(Ⅱ)在膨润土上的吸附主要是化学吸附而不是物理吸附[9]。
本实验用拟二级动力学模型来进行实验数据拟合。其模型表达式为[4]:

图3 膨润土的SEM图Fig.3 SEM image of bentonite
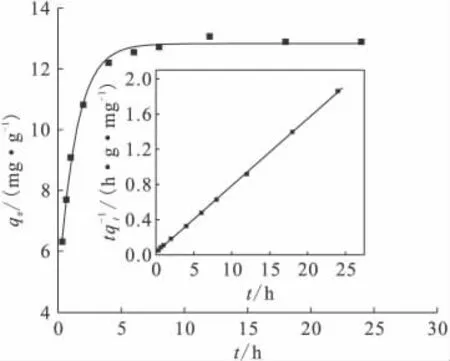
图4 吸附时间对膨润土吸附Ni(Ⅱ)的影响Fig.4 Effect of contact time on the sorption of Ni(Ⅱ)onto bentonite
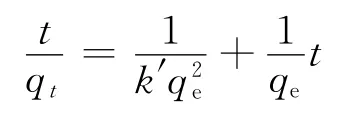
式中,qt、qe分别代表t时刻以及吸附平衡时的吸附Ni(Ⅱ)的量;k′为拟二级速率常数。Ni(Ⅱ)在膨润土上的吸附动力学拟合曲线示于图4。通过对t/qt和t作图,得到的线性相关系数r2=0.999,表明Ni(Ⅱ)在膨润土上的吸附过程符合拟二级动力学方程,通过直线的斜率和截距可以算得吸附速率常数k′以及平衡吸附量qe分别为0.211 2g/(mg·h)和13.18mg/g。
2.3 吸附剂浓度的影响
图5表示膨润土浓度对Ni(Ⅱ)吸附的影响。由图5可见,Ni(Ⅱ)在膨润土上的吸附率随着膨润土浓度的增大而增大,而吸附量却随着膨润土浓度的增大而降低。
吸附率增大是由于随着吸附剂浓度的增加,有效吸附位总量增加,提供更多的表面吸附位与Ni(Ⅱ)形成络合物[10]。吸附量的降低可以解释为随着膨润土浓度增加,平均吸附到单位吸附剂颗粒上的Ni(Ⅱ)量降低。此外,增大吸附剂的浓度,相应地增加了膨润土颗粒之间的相互作用,导致膨润土上的有效吸附位的利用率降低,导致对Ni(Ⅱ)的吸附量降低[11]。
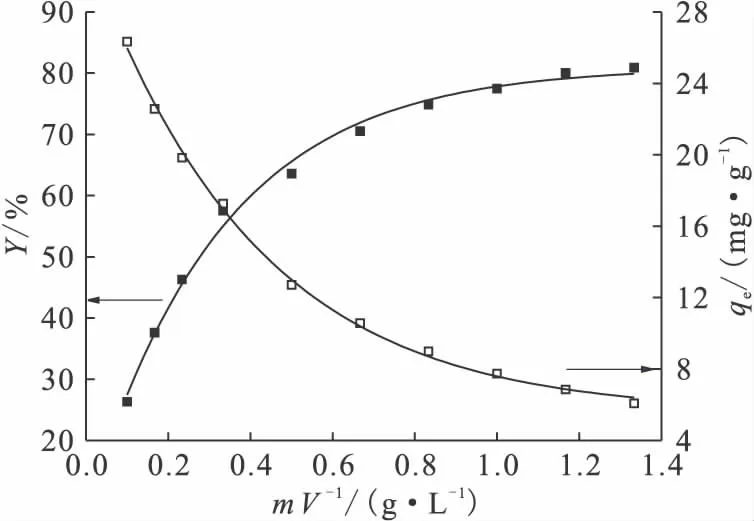
图5 膨润土浓度对Ni(Ⅱ)吸附的影响Fig.5 Effect of solid content on the sorption of Ni(Ⅱ)on bentonite
2.4 pH值和离子强度的影响
图6表示在0.001、0.01、0.1mol/L NaNO3溶液中pH值对Ni(Ⅱ)在膨润土上吸附的影响。以离子强度为0.01mol/L NaNO3的体系为例,可把Ni(Ⅱ)在膨润土上的吸附划分为3个阶段:(1)pH=3.0~6.0,Ni(Ⅱ)的吸附百分数缓慢地从10%增加到30%;(2)pH=6.0~8.0,Ni(Ⅱ)的吸附百分数迅速地增至98%左右;(3)当pH>8.0后,吸附率基本不变。
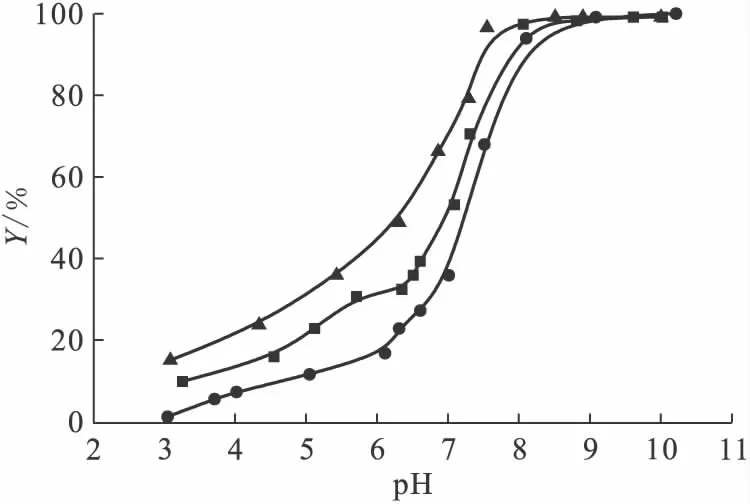
图6 pH值和离子强度对膨润土上Ni(Ⅱ)吸附的影响Fig.6 Effect of pH and ionic strength on the sorption of Ni(Ⅱ)on bentonite
上述的3个不同阶段是由于不同阶段膨润土表面生成的不同络合物而引起的。根据Ni(Ⅱ)的水解常数(lg K1=-9.9、lg K2=-19、lg K3=-30和lg K4=-27.7)[12]作出Ni(Ⅱ)的形态分布图(图7)。不同的pH值下,Ni(Ⅱ)有Ni(OH)2、Ni(OH)+、Ni2+、Ni(OH)-3以及等不同的存在形态。在低pH值时,溶液中Ni(Ⅱ)以Ni(OH)+和Ni2+的形态存在(即均带正电荷),而此时的膨润土表面因发生质子化反应也带正电荷,故吸附质与吸附剂之间存在静电排斥作用,从而导致低pH值时Ni(Ⅱ)的吸附率很低。在第二阶段随着pH值增大,吸附剂表面会发生去质子化反应导致表面电荷变成负值,随之Ni(Ⅱ)和负电荷的吸附剂表面发生静电吸附,从而使吸附率显著的提高。为了弄清楚第二阶段发生的吸附突跃是否由表面沉淀引起,本工作对Ni(Ⅱ)的沉淀pH值进行了计算。计算过程及结果为:已知Ni(OH)2的水解常数是2.0×10-15,Ni(Ⅱ)的初始质量浓度是10mg/L,通过计算可得出当溶液pH≈8.5时,才能形成Ni(OH)2(s)沉淀。然而由图6可以看出,在pH≈8.0时,吸附基本上达到完全。因此,第二阶段的吸附突跃不是由沉淀反应引起的。然而,随着第三阶段的pH值继续增大,通过水解作用,会形成Ni(OH)2沉淀以及Ni(OH)-3、等络合物。从图6还可以发现,在pH<8.0时,离子强度对Ni(Ⅱ)在膨润土上吸附影响较大;而当pH>8.0时,观察不到明显的影响。综上所述,在pH<8.0时,Ni(Ⅱ)在膨润土上吸附的主要机理是外层络合以及离子交换;在高pH值时,主要机理是内层络合或者表面沉淀。
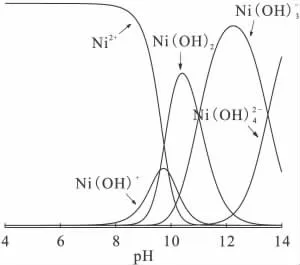
图7 Ni(Ⅱ)的形态分布图Fig.7 Relative proportion of 63 Ni(Ⅱ)species as a function of pH
2.5 FA对吸附的影响
图8表示的是FA的存在对Ni(Ⅱ)在膨润土上吸附的影响。由图8可知,在pH<7时,FA促进了Ni(Ⅱ)在吸附剂上的吸附;在pH>7时,FA抑制了吸附剂对Ni(Ⅱ)的吸附。
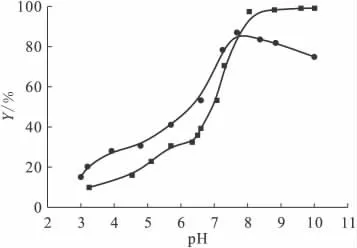
图8 不同pH值下FA对Ni(Ⅱ)在膨润土上的吸附影响Fig.8 Effect of pH on Ni(Ⅱ)sorption on bentonite in the presence and absence of FA
由于Ni(Ⅱ)与FA的络合比Ni(Ⅱ)与膨润土的络合更为牢固[1],形成“FA-Ni(Ⅱ)”的自由能比“膨润土-Ni(Ⅱ)”的自由能要小。此外,低pH值下FA带负电很容易被带正电的膨润土表面所吸附[13]。因此,pH<7时FA的存在应对Ni(Ⅱ)的吸附起到促进作用。随着pH值不断升高,膨润土表面逐渐转变为负电荷,使得同样带负电的FA很难被吸附到膨润土表面,而是大部分留在溶液中。这就导致与FA络合的Ni(Ⅱ)溶解于溶液中,从而降低了其在膨润土表面的吸附率。
2.6 阳离子的影响
Li+、Na+和K+阳离子对膨润土吸附Ni(Ⅱ)的影响示于图9。由图9可知,阳离子对Ni(Ⅱ)在膨润土上的吸附影响明显。酸性条件下,相同pH值时的Ni(Ⅱ)吸附率大小随不同阳离子变化的顺序为:Li+>Na+>K+,这表明溶液中的共存阳离子会改变膨润土的表面性质,从而导致其对Ni(Ⅱ)的吸附能力产生影响。这与它们的水合离子半径的大小密切相关:R(Li+)=0.34nm、R(Na+)=0.276nm以及R(K+)=0.232nm[14]。Ni(Ⅱ)在膨润土上的吸附可以看成是Ni(Ⅱ)与Li+/Na+/K+在膨润土表面发生竞争吸附,水合离子半径越小越容易被吸附到吸附剂表面,从而对Ni(Ⅱ)的吸附产生较大影响。由图9亦得,在pH>8.0时,阳离子对膨润土吸附Ni(Ⅱ)没有明显的影响,从而可以进一步说明在高pH值时,吸附主要机理是内层络合而并非离子交换。
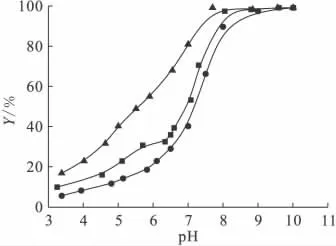
图9 阳离子对膨润土吸附Ni(Ⅱ)的影响Fig.9 Influence of foreign cations on the sorption of Ni(Ⅱ)on bentonite
3 结 论
(1)膨润土对63Ni(Ⅱ)的吸附可快速达到吸附平衡,吸附动力学符合拟二级动力学模型,说明膨润土对63Ni(Ⅱ)的吸附主要是化学吸附。
(2)膨润土对63Ni(Ⅱ)的吸附受pH和离子强度影响较大,在低pH时,由于吸附剂表面发生质子化反应,与金属离子发生静电排斥,该阶段的吸附率增长缓慢;离子交换和外层络合是该阶段的主要机理。随着pH逐渐增大,吸附剂表面发生去质子化反应,与吸附质之间发生静电吸附,吸附率迅速提高;最后,随着pH增大,吸附率保持一个较高值不变;内层络合或者表面沉淀是此阶段的主要机理。
(3)共存电解质阳离子对吸附有明显影响,影响顺序为:K+>Na+>Li+,这跟金属离子的水合离子半径的大小有关。腐殖酸在pH<7时促进63Ni(Ⅱ)在膨润土上的吸附;在pH>7时对吸附起抑制作用。
[1]谭小丽.放射性核素与重金属离子在氧化物上的吸附及机理研究[D].合肥:中国科学院合肥物质科学研究院,2009.
[2]许书河,张锦荣.大面积63Ni低能β放射源的研制[J].原子能科学技术,1996,30(5):410-413.
[3]于少明,杨保俊,单承湘.膨润土综合利用新工艺[J].矿冶工程,2000,20(1):38-40.
[4]王所伟.高庙子膨润土对Pb(Ⅱ)和Th(Ⅳ)的吸附行为研究[D].淄博:山东理工大学,2009.
[5]姜桂兰,张培萍.膨润土加工与应用[M].北京:化学工业出版社,2005.
[6]王所伟,李家星,陈 磊,等.Th(Ⅳ)在高庙子膨润土上的吸附行为[J].核化学与放射化学,2010,33(2):107-110.
[7]Hu J,Xie Z,He B,et al.Sorption of Eu(Ⅲ)on GMZ Bentonite in the Absence/Presence of Humic Acid Studied by Batch and XAFS Techniques[J].Sci China Chem,2010,53:1-9.
[8]单承湘,于少明,杨保俊.膨润土提纯方法研究[J].合肥工业大学学报(自然科学版),1997,20(2):30-33.
[9]Fan Q H,Shao D D,Wu W S,et al.Effect of pH,Ionic Strength,Temperature and Humic Substances on the Sorption of Ni(Ⅱ)to Na-Attapulgite[J].Chem Eng J,2009,150:188-195.
[10]Zhao D L,Yang X,Zhang H,et al.Effect of Environmental Conditions on Pb(Ⅱ)Adsorption onβ-MnO2[J].Chem Eng J,2010,164:49-55.
[11]Zhang H,Chen L,Zhang D C,et al.Impact of Environmental Conditions on the Adsorption Behavior of Radionuclide63Ni(Ⅱ)onγ-Al2O3[J].Colloids Surf A,2011,380:16-24.
[12]Sheng G D,Yang S T,Sheng J,et al.Influence of Solution Chemistry on the Removal of Ni(Ⅱ)From Aqueous Solution to Titanate Nanotubes[J].Chem Eng J,2011,168:178-182.
[13]张晖,张丽鹏,于先进,等.放射性核素60Co(Ⅱ)在伊利石上的吸附行为[J].核化学与放射化学,2011,33(3):168-172.
[14]Hu B W,Cheng W,Zhang H,et al.Solution Chemistry Effects on Sorption Behavior of Radionuclide63Ni(Ⅱ)in Illite-Water Suspension[J].J Nucl Mater,2010,406:263-270.

