手性伯胺催化Biginelli反应合成手性嘧啶酮化合物的影响因素研究
周 伟,赵金刚,林 晶,徐燕霞,刘 珺,赵淑娟,谢 恬
(杭州师范大学生物医药与健康研究中心,浙江 杭州 311121)
手性伯胺催化Biginelli反应合成手性嘧啶酮化合物的影响因素研究
周 伟,赵金刚,林 晶,徐燕霞,刘 珺,赵淑娟,谢 恬
(杭州师范大学生物医药与健康研究中心,浙江 杭州 311121)
手性嘧啶酮类化合物具有重要的药理活性应用.采用手性伯胺与金属盐的复合催化体系催化Biginelli反应,可以得到高立体选择性的手性嘧啶酮化合物.通过对各种反应条件的考察,结果表明,在NbCl5与QN-NH2的协同催化作用下得到较为理想的e.e.值(69%)和产率(74%).
手性嘧啶酮化合物;Biginelli反应;金属;手性伯胺催化剂
0 引 言
1893年,意大利化学家Pietro Biginelli首次报道了由尿素或硫脲、醛和β-酮酯三组分“一锅煮法”合成了3,4-二氢嘧啶-2(1H)-酮衍生物(DHPM),这就是著名的Biginelli反应[1].该反应为合成多官能团的二氢嘧啶酮(DHPM)及其衍生杂环化合物提供了一种操作便捷的合成方法[2],因此Biginelli反应对有机化学和药物化学都有着深远的意义.近年来的研究表明,DHPM及其手性衍生物具有重要的药用价值和药理活性,如作为钙通道阻滞剂、抗高血压药、脂肪酸转运抑制剂和有丝分裂的驱动蛋白抑制剂[3-8],并在抗病毒、抗肿瘤、抗菌性能、杀菌和杀霉等领域有广阔的应用[9].
Biginelli反应的研究引起了人们的极大重视,除了其反应机理外,人们更多地将研究重点放在了对该反应条件的改进以及多样性产物的合成之上.各种各样的催化剂和促进剂不断地被应用于此反应中,以β-酮酸酯、芳香醛和尿素/硫脲为代表的3种反应原料都有了很大范围的扩展,已得到大量多官能化的DHPM衍生物.在过去的10年里,许多新的催化剂应用于Biginelli反应、类Biginelli反应或DHPM及其衍生物的合成[10-11],但大部分只得到消旋的DHPM产物,所以不对称催化合成Biginelli反应仍然是一个长期的挑战.临床医学研究结果表明,在大多数情况下,DHPM化合物只有一个对映体构型是具有生物活性的,而另一构型则对人体有损害或则没有明显作用[12].因此,成功制备DHPM单一构型化合物具有非常重要的医用价值.
由于Biginelli反应机理的特殊性及其影响因素的多样性,所以我们对手性伯胺催化合成DHPM过程
中各种影响因素予以考察,以期能进一步了解不对称催化过程中不同因素对产物e.e.值及产率的影响.
1 实验部分
1.1 仪器与试剂
1H NMR和13C NMR仪器为Advance(Brucker)400NMR型核磁共振仪,以CDCl3为溶剂进行测定的,并分别加入内标溶剂.IR谱图通过FTIR(Nicolot 5700)分析测定.e.e.值的测定使用 Waters 2695 HPLC和2996UV检测器,手性柱为日本大赛璐手性色谱柱.
快速柱层析选用(200~300目)硅胶.薄层色谱用F254薄层板和并在紫外线可见光下观察.合成实验所用试剂均为分析纯等级,均从国内公司购买或本实验室合成,除特别说明外均直接使用.需处理溶剂按文献方法进行干燥重蒸处理,HPLC测试所用试剂均为色谱纯.
1.2 DHPM合成的与表征
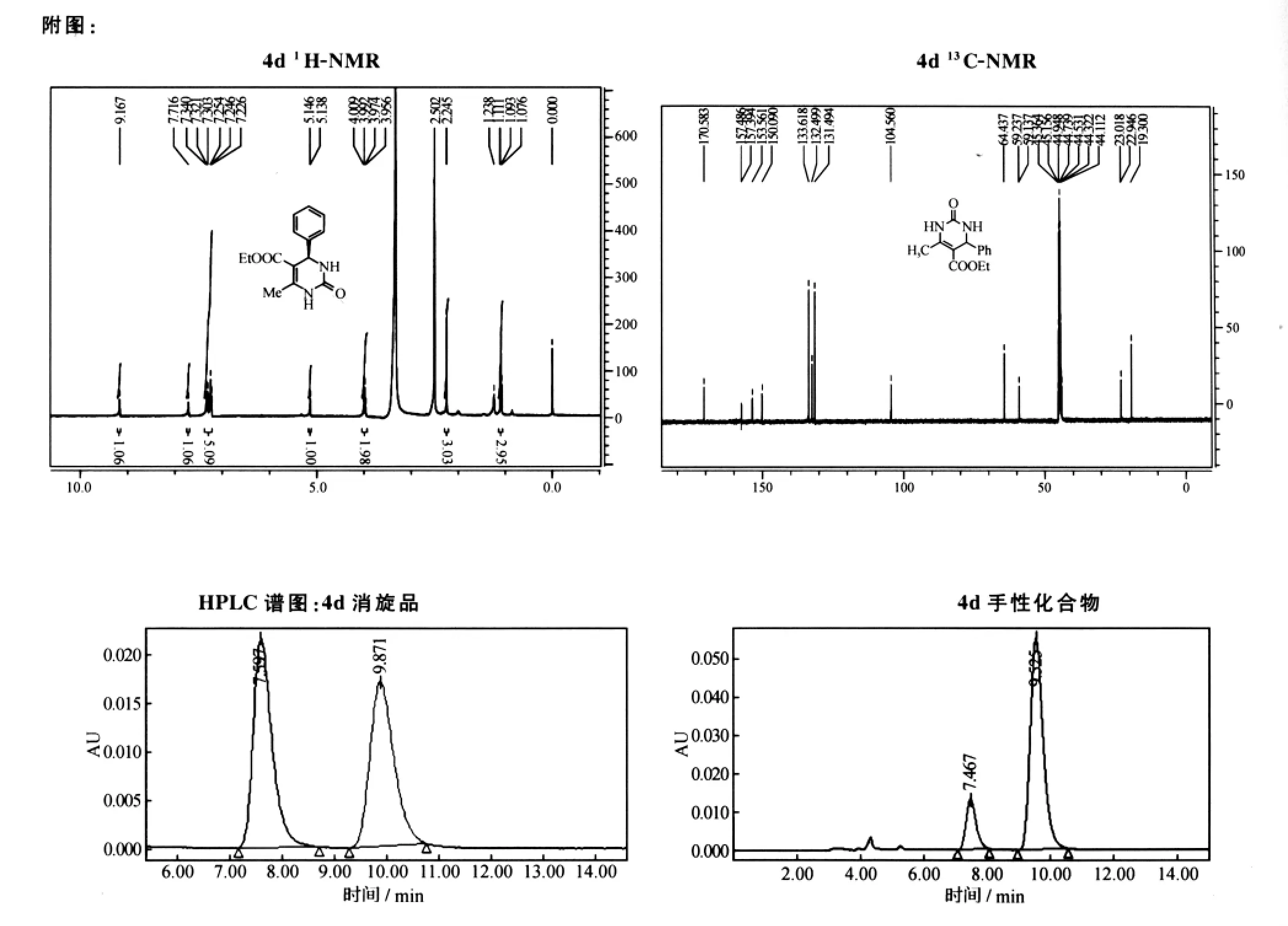
将催化剂加入到含有1mmol醛、1.2mmol尿素及5mmol乙酰乙酸乙酯的1mL溶剂中进行反应(图1).反应情况通过TLC点板检测,反应结束后柱分离得产物,经NMR及GC-MS分析得到所需DHPM产物,产物e.e.值由HPLC测得(见附图).
1H-NMR(400MHz,DMSO):δ=9.17(s,1H);7.72(s,1H );7.34~7.23(m,5H);5.14(d,J=3.2Hz,1H);3.98(dd,J=6.8Hz,7.2Hz,2H);2.25(s,3H);1.09 (t,J=7.2Hz,3H);13C-NMR(100MHz,DMSO):δ =170.58,157.49,157.39,153.56,150.09,133.62,132.50,131.49,104.56,64.44,59.24,59.14,23.02,22.95,19.30;HPLC (Daicel Chirapak OD-H,hexane/isopropanol=80∶20,flow rate 0.5mL/min):tminor=7.47min,tmajor=9.52min.
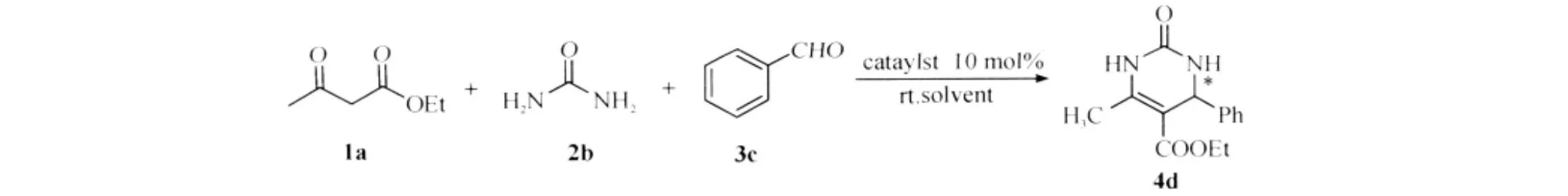
图1 Biginelli反应Fig.1 Biginelli reaction
2 结果与讨论
2.1 溶剂的影响
以手性伯胺双金属催化体系为模板反应,评价溶剂对Biginelli反应的影响.如表1、图2所示.
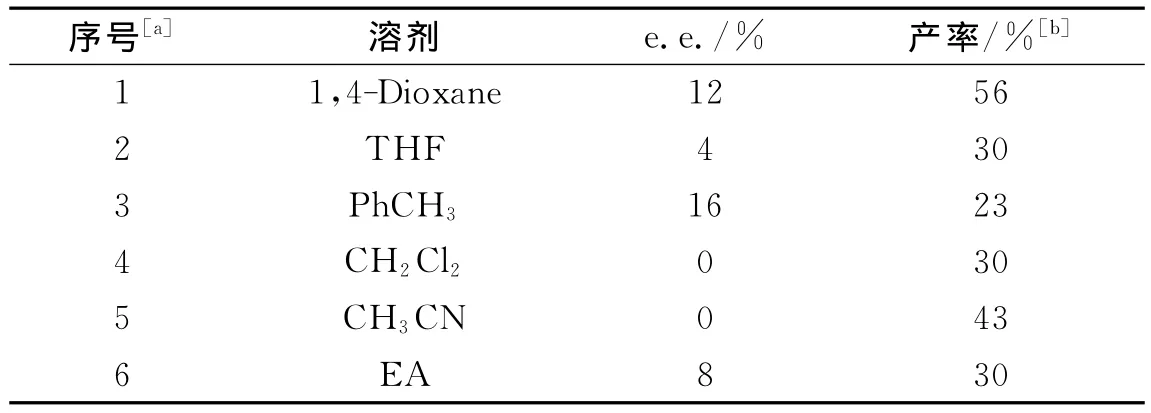
表1 溶剂对于Biginelli反应的影响Tab.1 The influence of solvents in Biginelli reaction
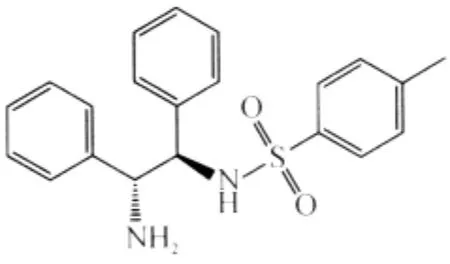
图2 (R,R)-Ts-DPEN结构式Fig.2 The structure of(R,R)-Ts-DPEN
从表1可以看出,无论是产率还是e.e.值,Biginelli反应存在明显的溶剂效应.在该反应体系中,1,4-Dioxane(表1序号1)是进行Biginelli反应最好的溶剂,虽然产物e.e.值不高,并且比在PhCH3(表1序号3)中略低,但是其产率是最高的,远高于在PhCH3中的产率.而在CH2Cl2和CH3CN中只能得到消旋产物.综合以上因素,我们选择1,4-Dioxane作为该反应的溶剂进行下一步实验.
2.2 金属的影响
在此以(R,R)-Ts-DPEN为手性伯胺催化剂,以1,4-Dioxan为溶剂,考察各种金属对该催化体系的影响(表2).
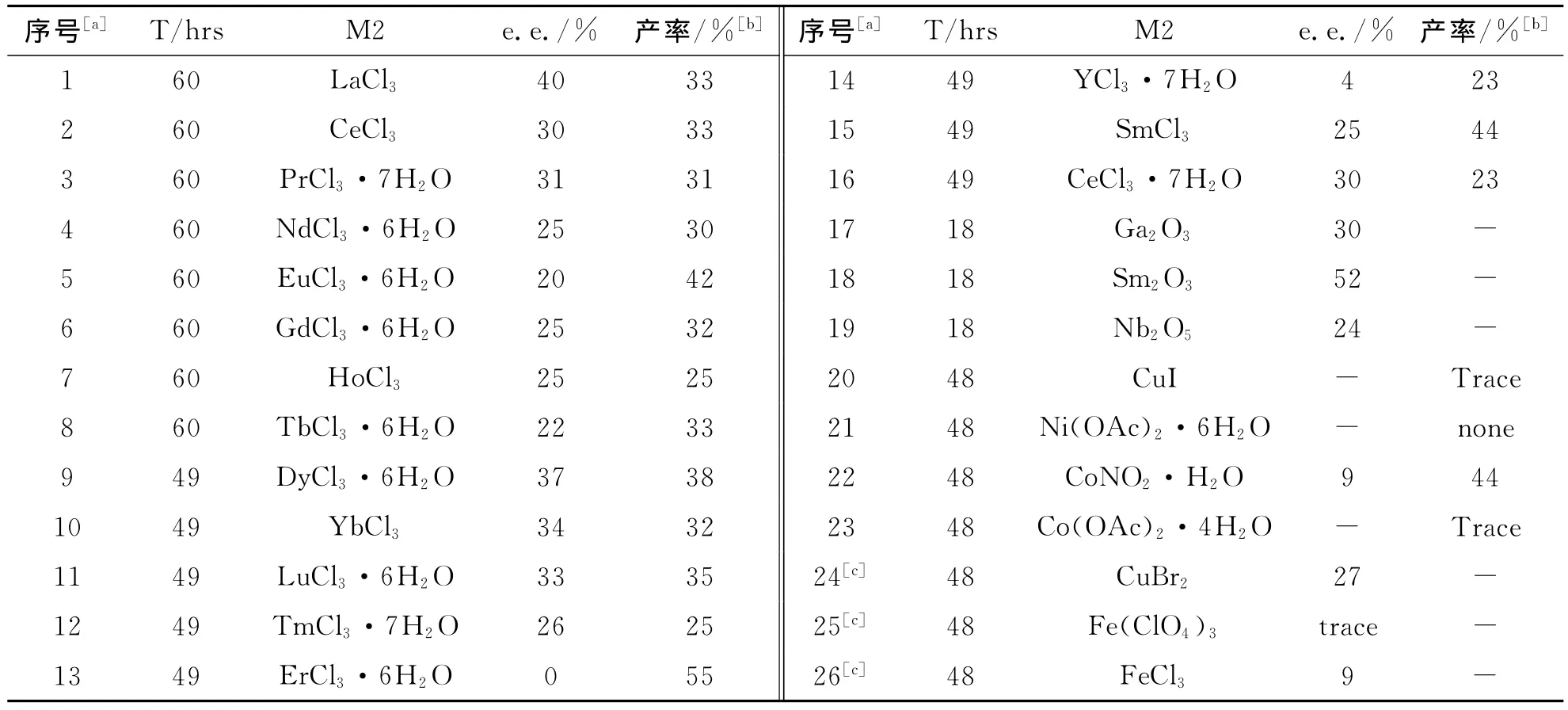
表2 双金属体系中金属对反应的影响Tab.2 The influence of dual metal system
实验结果表明,双金属体系中稀土金属氯化物(Er、Y除外)对Biginelli反应的影响基本一致(e.e.值为22%~40%).但对于稀土金属氧化物而言,差别则很大,Sm2O3可达52%e.e..于是我们以Sm2O3为金属催化剂1,考察其他金属的影响,但是实验结果并不理想,有些金属复合之后不反应或只进行痕量反应,e.e.值也不高并且反应重复性不理想(表2中序号24~26).故可推断Nb是该反应最好的助催化剂.
2.3 温度的影响
基于该反应的产率比较低,考虑在保证e.e.值不受影响的前提下,适当提高反应温度,加快反应速度,进一步提高产率,于是我们进行了表3所示的一组实验.
实验结果表明,随着温度的升高产率有所提高,但是产物的e.e.值却急剧降低,几乎接近消旋.这符合了不对称合成的一般规律:随着温度的升高,产物的e.e.值下降.
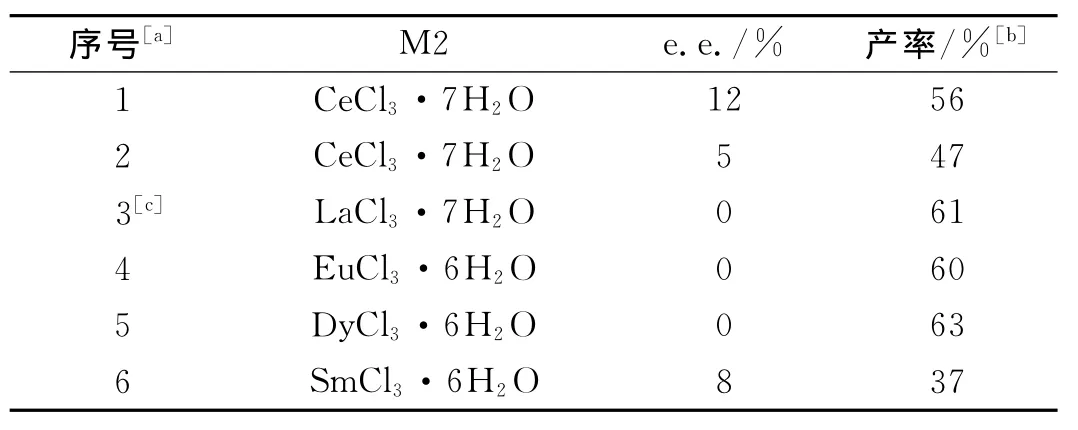
表3 温度的影响Tab.3 The influence of temperature
2.4 酸的影响
从表4实验结果可以看出,该反应可能经历了亚胺中间体的过渡态,酸能够促进该反应中间体的转移,所以酸的加入将该反应的产率提高到64%,但对于产物e.e.值则没有明显的影响(表4序号3).
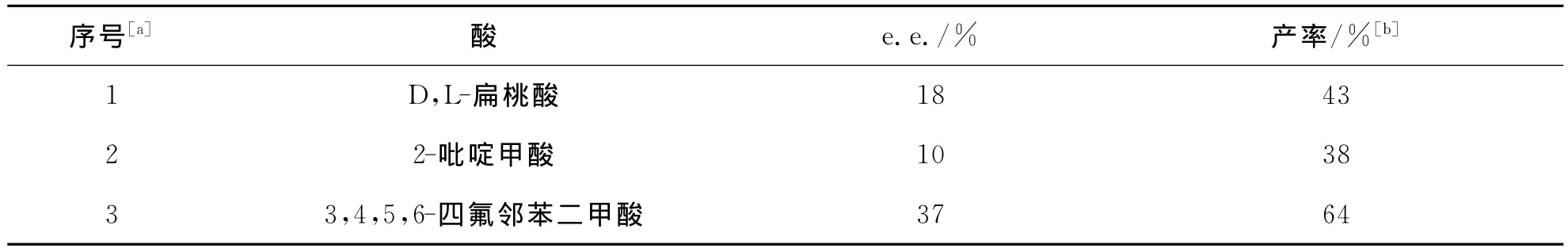
表4 酸的影响Tab.4 The influence of acid
2.5 双配体中氨基酸的影响
通过研究结果得知,质子酸能够提高反应产物收率,那么如果采用氨基酸这类带有手性模板的质子酸与已知反应体系复合,是否能够提高反应的产率并且进一步提高其e.e.值呢?为此,进行了一系列实验考察氨基酸在该体系中的作用,实验结果如表5所示.
表5实验结果表明,产物的e.e.值在21%~38%,低于(R,R)-Ts-DPEN做催化剂时产物的e.e.值,但是产率可以提高至77%(表5序号7).由此推断氨基酸在该反应中体现出的是纯粹的酸的作用,即促进中间体的转移以提高反应产率,其手性模板的效应并没有体现出来.
2.6 投料方式的影响
综合以上实验结果得知,NbCl5复合CeCl3是比较好的双金属催化剂.因此,我们研究了NbCl5与CeCl3的投料次序对产物e.e.值的影响.
表6实验结果表明,两种金属分批次投料(表6序号1、2)比一次性投料(表6序号3)产物的e.e.值高10%.
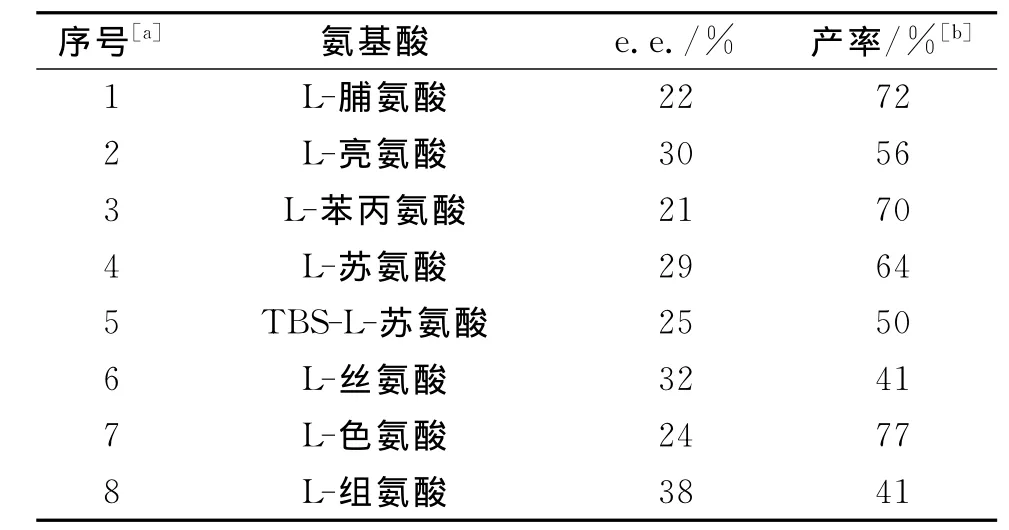
表5 氨基酸的影响Tab.5 The influence of amino acids
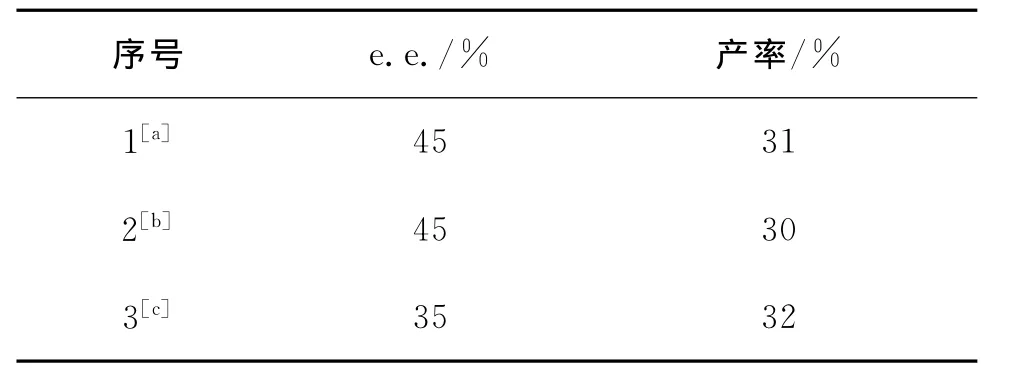
表6 投料方式的影响Tab.6 The influence of feeding-composting ways
2.7 催化剂的评价
基于以上的实验结果,进一步考察了不同的手性含氮配体(图3)对该反应的影响,实验结果如表7、表8所示.
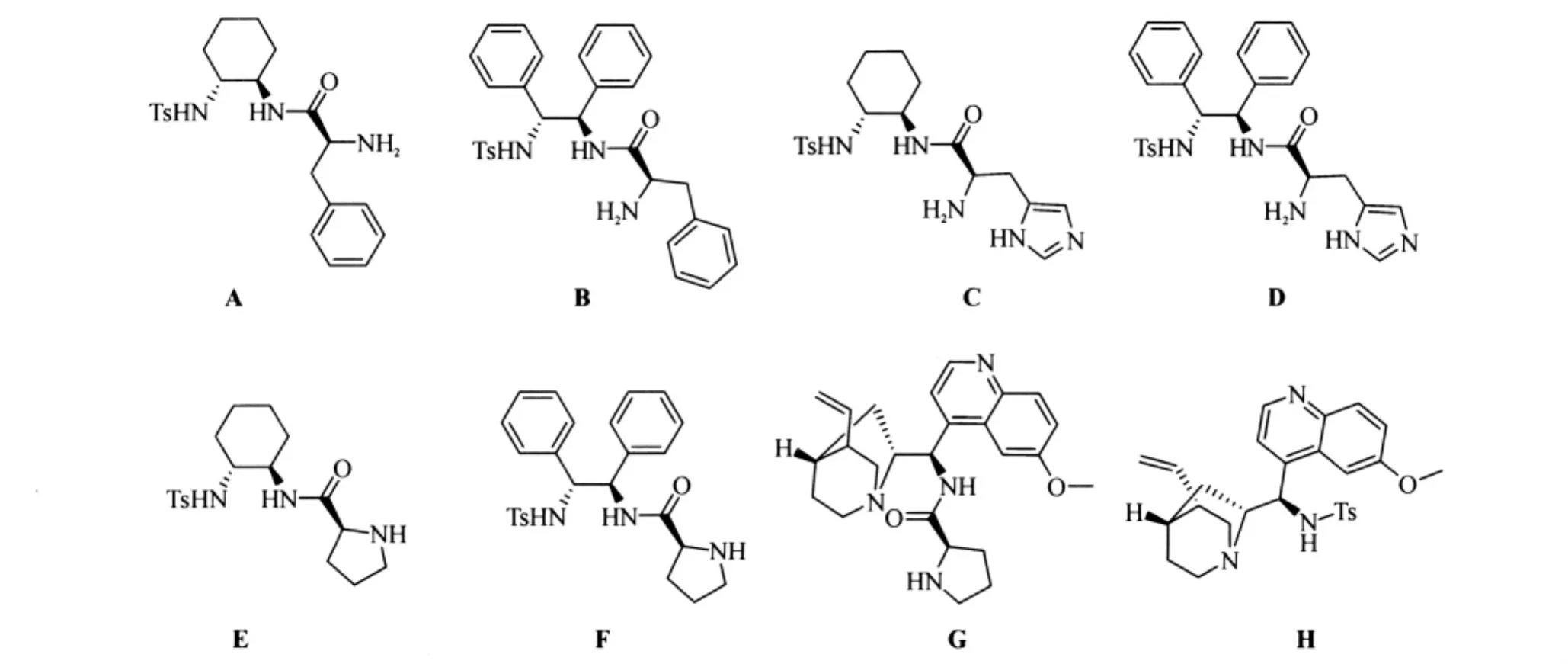
图3 实验所用催化剂Fig.3 The catalysts uses in the experiment
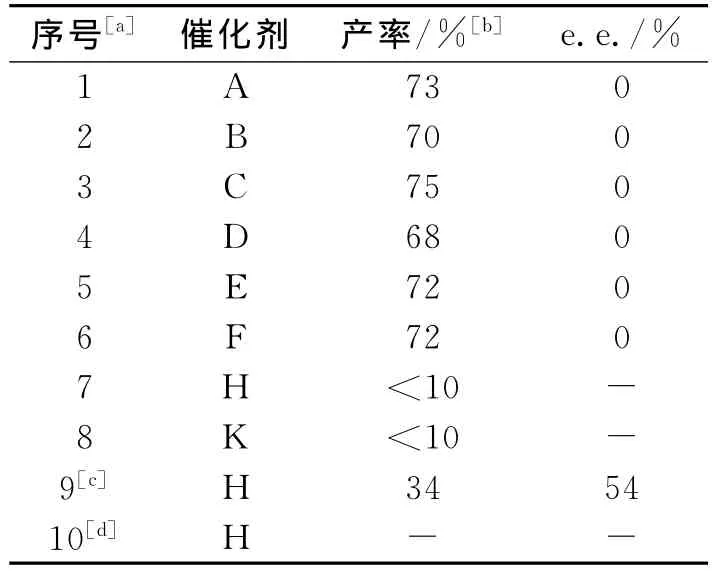
表7 催化剂的评价Tab.7 The influence of catalyst
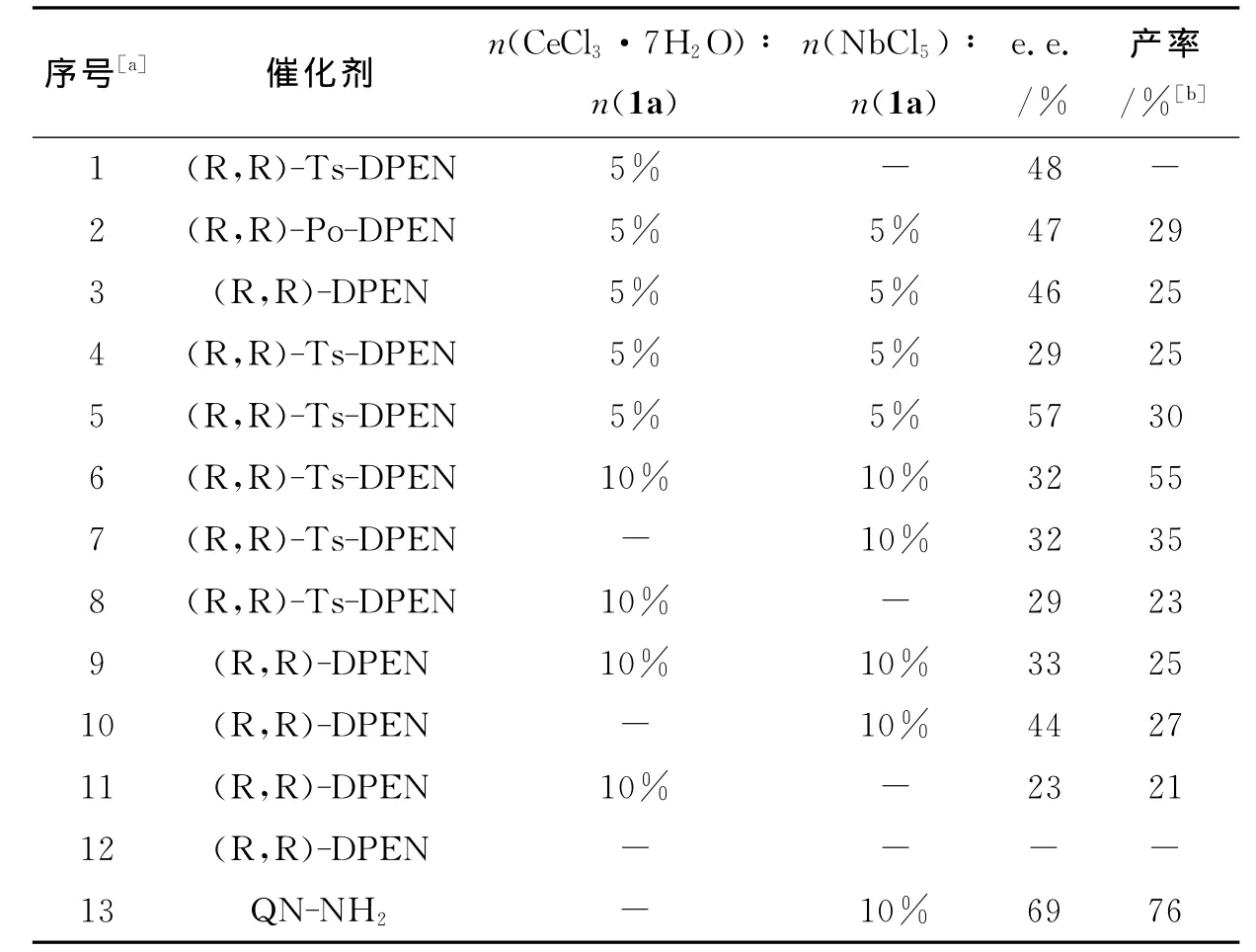
表8 复合催化体系的评价Tab.8 The influence of catalysts
以上大量实验结果表明,不同的催化剂对于该反应具有不同的影响.在所使用的催化剂中,伯胺具有明显的优势,能得到中等e.e.值的产物,而仲胺类催化剂却基本上得到了消旋的产物.其中伯胺催化剂中以QN-NH2为最佳催化剂,在目前实验中取得了最好结果,e.e.值为69%,产率为76%(表8序号13).
2.8 QN-NH2体系中双金属的影响
表9实验结果表明,各种金属氧化物与QN-NH2、NbCl5复合催化该反应时,并没有提高产物的e.e.值,由此推断,金属氧化物与NbCl5的双金属复合体系的催化中心并不能活化该反应,不能提高其立体选择性.
2.9 QN-NH2 体系中碱的影响
表10实验结果表明,各种胺及离子液体对于该反应有明显的抑制作用,无论是产率还是e.e.值都有明显的降低.尤其是加入有机胺类(表10序号5~8),该反应几乎无法进行.
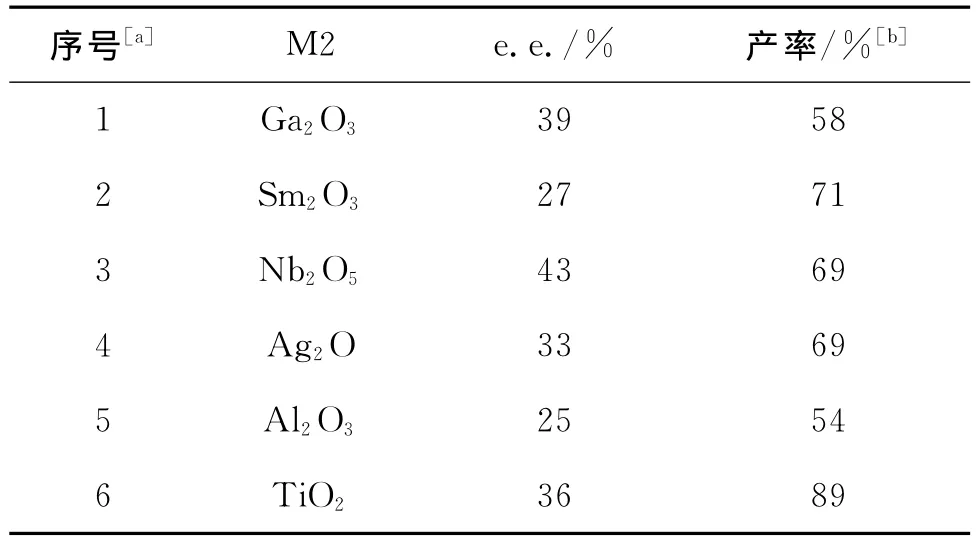
表9 QN-NH2体系中双金属的影响Tab.9 The influence of dual metal in QN-NH2system
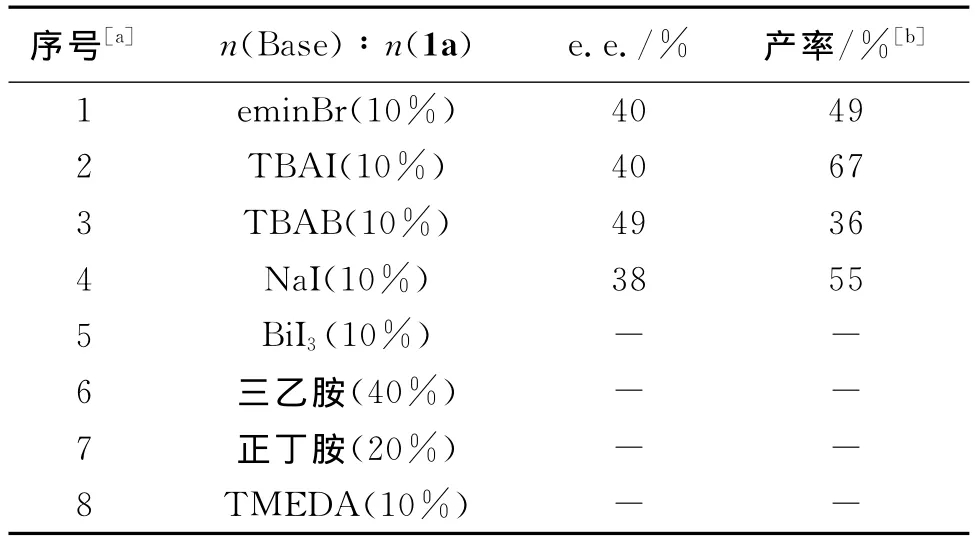
表10 QN-NH2体系中碱的影响Tab.10 The influence of base in QN-NH2system
3 结 论
经大量实验研究表明,在手性伯胺催化Biginelli反应合成手性嘧啶酮类化合物的研究中,QN-NH2以其独特的结构及官能团优势,得到了该体系最好的反应结果(e.e.值为69%,产率为76%).该反应的最佳催化条件为:QN-NH2与NbCl5用量的摩尔分数为10%和10%,在1,4-二氧六环中反应48h.
[1]Biginelli P.Aldureides of ethylic acetoacetate and ethylic oxalacetate[J].Gaz Chim Ital,1893,23:360-416.
[2]Dondoni A,Massi A.Design and synthesis of new classes of heterocyclic c-glycoconjugates and carbon-linked sugar and heterocyclic amino acids by asymmetric multicomponent reactions(AMCRs)[J].Acc Chem Res,2006,39(7):451-463.
[3]Aron Z D,Overman L E.The tethered Biginelli condensation in natural product synthesis[J].Chem Commun,2004(3):253-265.
[4]Kappe C O.Recent advances in the Biginelli dihydropyrimidine synthesis.New tricks from an old dog[J].Acc Chem Res,2000,33(12):879-888.
[5]Atwal K S,Rovnyak G C,O'Reilly B C,et al.Substituted 1,4-dihydropyrimidines.3.Synthesis of selectively functionalized 2-hetero-1,4-dihyd-ropyrimidines[J].J Org Chem,1989,54:5898-5907.
[6]Kappe C O,Fabian W M F,Semones M A.Synthesis and reactions of Biginelli compounds.6.Conformational analysis of 4-aryl-dihydropyrimidine calcium channel modulators.A comparison of Ab initio,semiempirical and x-ray crystallographic studies[J].Tetrahedron,1997,53(8):2803-2816.
[7]Kappe C O.Biologically active dihydropyrimidones of the Biginelli-type-a literature survey[J].Eur J Med Chem,2000,35(12):1043-1052.
[8]Blackburn C,Guan B,Brown J,et al.Identification and characterization of 4-aryl-3,4-dihydropyrimidin-2(1H)-ones as inhibitors of the fatty acid transporter FATP4[J].Bioorg Med Chem Lett,2006,16(13):3504-3509.
[9]Brands M,Endermann R,Gahlmann R,et al.Dihydropyrimidinones-a new class of anti-Staphylococcal antibiotics[J].Bioorg Med Chem Lett,2003,13(2):241-245.
[10]Jindal R,Bajaj S.Recent applications of microwaves in synthesis of bioactive heterocyclic compounds[J].Curr Org Chem,2008,12(10):836-849.
[11]Saini A,Kumar S,Sandhu J S.Biginelli reaction[J].J Indian Chem Soc,2007,84:959-970.
[12]Kappe C O,Stadler A.The Biginelli dihydropyrimidinone synthesis[J].Org React,2004,63:1-116.
The Influencing Factors on the Synthesis of Chiral Pyrimidine Sulfo-Benzophenone Compounds Catalyzed by Chiral Primary Amine-Based Organocatalyst in Biginelli Reaction
ZHOU Wei,ZHAO Jin-gang,LIN Jing,XU Yan-xia,LIU Jun,ZHAO Shu-juan,Xie Tian
(Center for Biomedicine and Health,Hangzhou Normal University,Hangzhou 311121,China)
Chiral pyrimidine ketone compounds have important pharmacological activities and broad applications in many fields.Chiral pyrimidine sulfo-benzophenone compounds with high enantioselectivity were obtained by the Biginelli reaction,which was catalyzed by chiral primary amine and metal salt.The results show that e.e.can be up to 69%and yield can be up to 76%under the influence of synergistic catalysis of NbCl5and QN-NH2.
chiral pyrimidine sulfo-benzophenone compounds;Biginelli reaction;metal;chiral primary amine-based organocatalysts
O626.41
A
1674-232X(2012)04-0352-07
11.3969/j.issn.1674-232X.2012.04.013
2011-12-29
杭州市重大科技专门项目(20092113A03).
周 伟(1981—),女,助理研究员,博士,主要从事不对称催化、药物中间体新的合成方法学研究.E-mail:ossozw@yahoo.com.cn