LRIG1过表达对顺铂诱导的胶质瘤细胞凋亡的影响及其机制*
肖群根, 张 涛, 毛 峰, 王 莹, 谢蕊繁, 王宝峰, 郭东生, 雷 霆
华中科技大学同济医学院附属同济医院神经外科,武汉 430030
顺铂(cisplatin,CDDP)是广泛应用于治疗包括胶质瘤在内的多种恶性肿瘤的化疗药物[1]。虽然其在肿瘤化疗中的地位尤为重要,但是还有许多肿瘤对CDDP的治疗不敏感[2],目前越来越多的研究集中在如何提高肿瘤对化疗药物治疗的敏感性。化疗抵抗通常与酪氨酸激酶受体(receptor tyrosine kinases,RTKs)的过度表达或异常激活有关,这些RTKs受体(如EGFR)激活后促进细胞增殖与存活[3]。LRIG1 基因是LRIG 基因家族(LRIG1、LRIG2和LRIG3)中的一员,目前已证实其可负性调节EGFR 信号通路而发挥抑癌基因作用[4],但其是否能改善胶质瘤对化疗药物的敏感性尚未见报道。本研究将LRIG1 基因转染入胶质瘤细胞U251,探讨LRIG1过表达后对CDDP 诱导的胶质瘤细胞凋亡的影响及可能的机制。
1 材料与方法
1.1 材料与试剂
胶质瘤细胞系U251购自中国上海细胞保藏中心,LRIG1 过表达质粒(pEGFP-LRIG1)由瑞典Hakan Hedman教授馈赠。Lipofectamine 2000(美国Invitrogen公司),G418(美国Amresco公司),RPE/7-AAD 双染细胞凋亡检测试剂盒(美国Southern Biotech 公司),EGFR、P-EGFR(美国Upstate公司),Bcl-2、Bax、Caspase-3(美国CST 公司),ReverTra Ace-α-逆转录试剂盒、SYBR Green Realtime PCR 试剂盒(日本TOYOBO 公司)。
1.2 细胞转染
U251细胞种于24孔板内,待细胞长至80%融合时按照Lipofectamine 2000 转染说明书进行转染,将对照质粒(EGFP-N1)及LRIG1质粒(EGFPN1-LRIG1)分别转染U251 细胞。用600 mg/L G418对细胞进行筛选,挑取细胞克隆,逐级扩大培养。
1.3 Real-time PCR
分别提取对照组及LRIG1过表达组细胞mRNA,并逆转录成cDNA,Real-time PCR反应条件如下:95℃,1min,以后每个循环为95℃15s,60℃30 s,72℃45s,循环40次。LRIG1real-time PCR 引物[5]正义链:5′-GGTGAGCCTGGCCTTATGTGAATA-3′,反义链:5′-CACCACCATCCTGCACCTCC-3′。GAPDH 引物正义链:5′-CACCAGGGCTGCTTTTAACTCTGGTA-3′,反义链:5′-CCTTGACGGTGCCATGGAATTTGC-3′。以GAPDH 为内参,通过2-ΔΔCt方法进行相对定量分析。
1.4 R-PE/7-AAD双染细胞凋亡检测
细胞同步化培养24h 后加入含有不同浓度CDDP的完全培养液再培养48h,收集细胞,按RPE/7-AAD 凋亡试剂盒说明书进行染色,细胞用预冷的PBS洗2遍后用500μL 缓冲液重悬细胞,再加入10μL Annexin Ⅴ-R-PE 于冰上孵育15min,最后加入10μL 7-AAD,混匀后于流式细胞分析仪上检测凋亡,实验行3次,结果取3次平均值。
1.5 Western blot检测蛋白表达
将细胞用无血清培养液同步化培养24h后再用含有不同浓度CDDP的完全培养液培养48h,收集细胞,PBS洗细胞2遍后,RIPA 裂解液冰上裂解细胞,离心后收集上清,用12%聚丙烯酰胺凝胶电泳,蛋白转移到醋酸纤维膜上,用含5%脱脂奶粉的TBST 常温封闭1h,加入一抗(均为1∶1 000)4℃孵育过夜;TBST 洗涤3次,每次10min,加入辣根过氧化物酶标记的二抗,37℃孵育1h;增强化学发光显色。条带密度由Quantity one软件分析。
1.6 统计分析
2 结果
2.1 U251过表达LRIG1稳定株的鉴定
Real-time PCR 检测结果示LRIG1 过表达组(U251-LRIG1)LRIG1 mRNA 表达水平是对照组(U251-EGFP)的(26.90±1.85)倍(P<0.01)。Western blot检测结果示LRIG1 过表达组LRIG1蛋白表达水平较对照组也明显升高(图1)。过表达LRIG1的胶质瘤细胞U251稳定株成功建立。
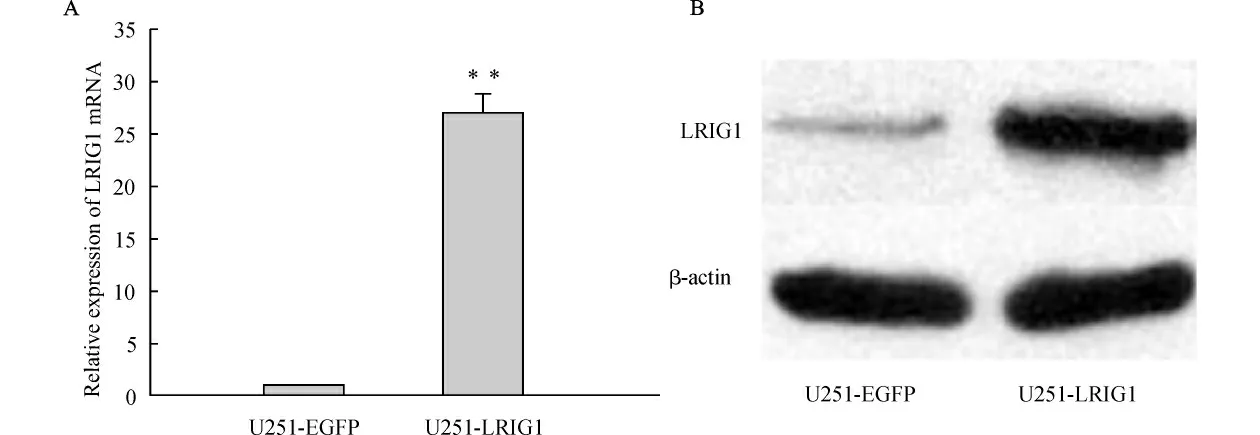
图1 LRIG1过表达U251细胞中LRIG1mRNA 及蛋白的表达Fig.1 The expression levels of LRIG1mRNA and proteins
2.2 LRIG1对CDDP诱导的胶质瘤细胞凋亡的影响
在浓度为0、10、20μg/mL 的CDDP 作用下,LRIG1过表达组及对照组的细胞凋亡率分别为(3.66±0.51)%和(1.49±0.27)%,(16.35±0.89)%和(7.60±0.50)%,(29.63±2.12)%和(10.87±1.82)%。提示在不同浓度的CDDP诱导下,LRIG1过表达组细胞凋亡率均明显高于对照组(P<0.01)(图2)。
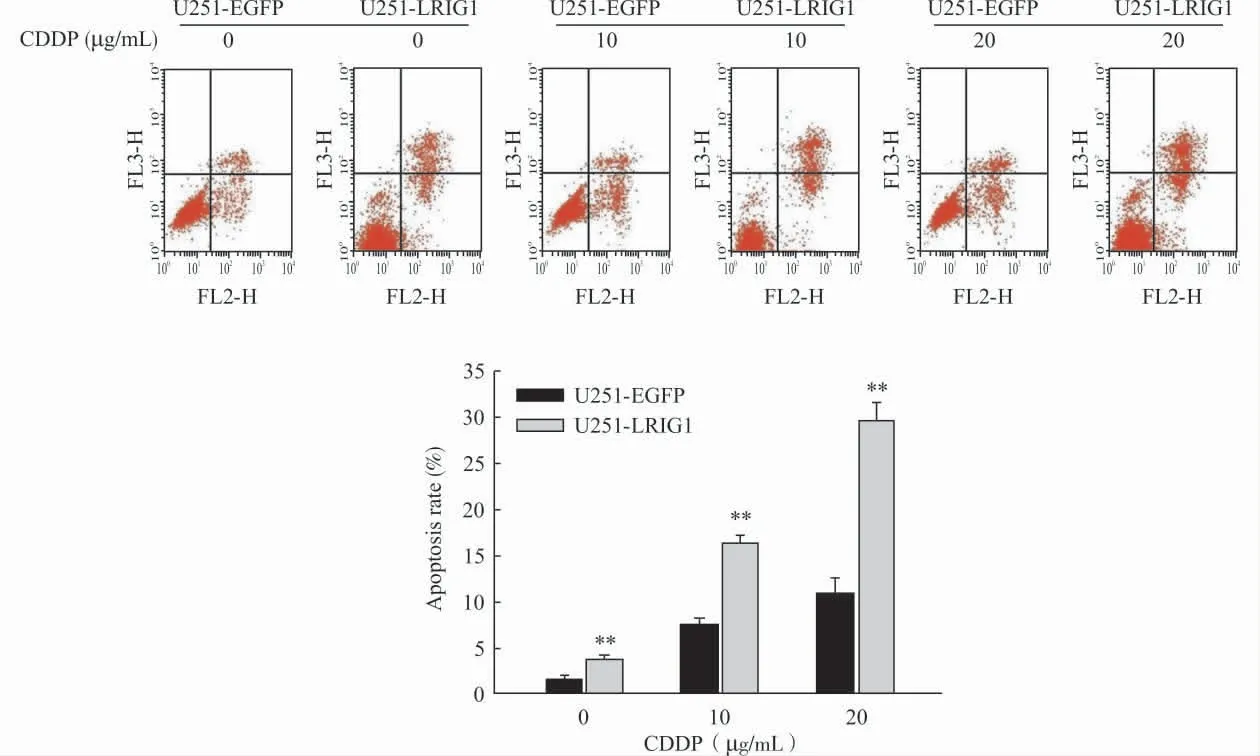
图2 LRIG1对CDDP诱导的胶质瘤细胞凋亡的影响Fig.2 The effects of LRIG1on apoptosis of glioma cells induced by CDDP
2.3 CDDP诱导胶质瘤细胞EGFR 活化
不同浓度的CDDP(0、5、10、20μg/mL)作用48 h,随着CDDP 浓度的增加,EGFR 蛋白表达下降,其活化形式P-EGFR 的表达则升高;条带相对密度分析示,各浓度组间EGFR 及P-EGFR 表达量的差异均有统计学意义(P<0.05)。提示CDDP可诱导胶质瘤细胞EGFR 活化,且这种活化与CDDP呈剂量依赖性(图3)。
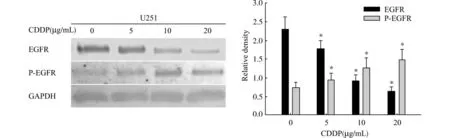
图3 CDDP诱导胶质瘤细胞U251EGFR 活化Fig.3 CDDP-induced activation of EGFR in U251cells
2.4 LRIG1对CDDP诱导的胶质瘤细胞P-EGFR及凋亡相关蛋白表达的影响
浓度分别为0、10及20μg/mL CDDP作用下,LRIG1过表达组P-EGFR 水平较对照组均明显降低;LRIG1 过表达组促凋亡相关蛋白Bax 及Caspase-3表达水平较对照组明显升高,凋亡抑制相关蛋白Bcl-2则明显降低(图4)。

图4 LRIG1对CDDP诱导的胶质瘤细胞P-EGFR及凋亡相关蛋白表达的影响Fig.4 The effects of LRIG1on the expression of P-EGFR and apoptosis-related proteins induced by CDDP
3 讨论
恶性胶质瘤是中枢神经系统最常见的肿瘤,对于胶质母细胞肿瘤,经过手术、放疗和化疗等综合治疗后,患者的中位生存期也只有12~15个月[6]。化疗在胶质瘤的综合治疗中占有重要地位,然而其严重的副作用及肿瘤对化疗药物的抵抗性使其临床应用严重受限,探讨肿瘤对化疗药物产生抵抗性的机制及改善肿瘤对化疗药物的敏感性已成为新的挑战。
CDDP是治疗多种恶性肿瘤包括胶质瘤的最常用和最有效的化疗药物之一[1]。在化疗抵抗的分子水平研究中,EGFR 最受关注。目前已有研究发现,在多种实体肿瘤中CDDP 的耐药性与EGFR 表达增强密切相关[7-8]。本研究发现,在胶质瘤细胞系U251中,CDDP可诱导胶质瘤细胞EGFR 活化,且随着CDDP浓度增加,P-EGFR 表达也增加,CDDP诱导胶质瘤细胞EGFR 活化呈剂量依赖性。
LRIG1是最早发现的LRIG 基因家族成员,目前已证实其可负性调节EGFR 信号通路而发挥抑癌基因作用[9-10]。本研究建立稳定表达LRIG1 的胶质瘤细胞株U251,发现在不同CDDP 浓度作用下,LRIG1过表达组细胞凋亡率均明显高于对照组,LRIG1过表达组细胞P-EGFR 表达明显下降,抗凋亡相关蛋白Bcl-2 明显下降,凋亡相关蛋白Bax、Caspase-3 升高,证实LRIG1 可通过下调PEGFR 水平改善胶质瘤对化疗药CDDP 的敏感性。结合LRIG1对EGFR 的负反馈机制,推测LRIG1改善胶质瘤对化疗药CDDP敏感性的具体机制为:CDDP诱导胶质瘤细胞EGFR 活化,EGFR 激活后诱导LRIG1蛋白合成,LRIG1转移至细胞膜,在胞外通过LRR 区与EGFR 结合,胞内段通过E3泛素连接酶c-Cb1与EGFR 形成复合体,使EGFR 泛素化,内吞,最后降解,抑制EGFR 信号通路,从而改善细胞对CDDP的敏感性[9,11]。
综上所述,胶质瘤对化疗药物CDDP的耐药性可能与CDDP 诱导EGFR 活化有关,而LRIG1 通过抑制EGFR 的活化而明显改善胶质瘤细胞对CDDP的敏感性,LRIG1在胶质瘤化疗药物的研究方面具有广阔的应用前景。
[1] Duan L,Aoyagi M,Tamaki M,et al.Sensitization of human malignant glioma cell lines to tumor necrosis factor-induced apoptosis by cisplatin[J].J Neurooncol,2001,52(1):23-36.
[2] Brozovic A,Ambriovic-Ristov A,Osmak M.The relationship between cisplatin-induced reactive oxygen species,glutathione,and BCL-2and resistance to cisplatin[J].Crit Rev Toxicol,2010,40(4):347-359.
[3] Xu A M,Huang P H.Receptor tyrosine kinase coactivation networks in cancer[J].Cancer Res,2010,70(10):3857-3860.
[4] Hedman H,Henriksson R.LRIG inhibitors of growth factor signalling-double-edged swords in human cancer?[J].Eur J Cancer,2007,43(4):676-682.
[5] Nilsson J,Vallbo C,Guo D,et al.Cloning,characterization,and expression of human LIG1[J].Biochem Biophys Res Commun,2001,284(5):1155-1161.
[6] Mao H,Lebrun D G,Yang J,et al.Deregulated signaling pathways in glioblastoma multiforme:molecular mechanisms and therapeutic targets[J].Cancer Invest,2012,30(1):48-56.
[7] Dai Q,Ling Y H,Lia M,et al.Enhanced sensitivity to the HER1/epidermal growth factor receptor tyrosine kinase inhibitor erlotinib hydrochloride in chemotherapy-resistant tumor cell lines[J].Clin Cancer Res,2005,11(4):1572-1578.
[8] Kuroda H,Takeno M,Murakami S,et al.Inhibition of heme oxygenase-1with an epidermal growth factor receptor inhibitor and cisplatin decreases proliferation of lung cancer A549 cells[J].Lung Cancer,2010,67(1):31-36.
[9] Gur G,Rubin C,Katz M,et al.LRIG1restricts growth factor signaling by enhancing receptor ubiquitylation and degradation[J].EMBO J,2004,23(16):3270-3281.
[10] 叶飞,高庆蕾,徐同江,等.LRIG1对胶质瘤细胞中表皮生长因子受体的抑制作用及其机制[J].华中科技大学学报:医学版,2009,38(1):49-51.
[11] Benhar M,Engelberg D,Levitzki A.Cisplatin-induced activation of the EGF receptor[J].Oncogene,2002,21(57):8723-8731.

