流感病毒快速检测方法在儿童流感样病例病原诊断中的应用
王 芳 孙 宇 朱汝南 赵林清 邓 洁 廖 斌 黄荣妍 钱 渊
流感病毒是仅次于呼吸道合胞病毒(RSV)的可引起婴幼儿急性呼吸道感染的常见重要病毒病原之一。流感病毒分甲(A)、乙(B)和丙(C)3 个型别。目前,感染人类的甲型流感病毒根据抗原性和基因特征分为甲1(H1N1)和甲3(H3N2)型,乙型流感病毒分为Victoria 和Yamagata 两大谱系。甲型流感病毒抗原变异活跃,可引起世界范围的大流行。而乙型流感病毒感染和传播的严重程度不如甲型流感病毒,但也常引起小规模的暴发流行[1,2]。在流感的流行季节,往往因急性呼吸道感染而发热的就诊患儿骤增,临床上需要快速、准确、操作简便和适用于临床应用的流感病毒病原诊断方法,以便对出现流感样症状的患儿及早做出正确的病原诊断,采取恰当的治疗方案。目前有一些可用于临床实验室快速诊断呼吸道病毒的方法[3],如检测抗原的有ELISA、免疫荧光法;检测病毒核酸的有PCR、RTPCR 等,上述方法经过了与经典病毒学方法(如病毒分离法)的大量比较,证明其敏感、特异和可靠,但需要特殊的仪器设备和经特殊培训的技术人员,而且检测所需要的时间较长,因此不宜在临床、尤其是基层医疗机构使用推广。目前一些更加简便快速的诊断方法被陆续推出[4]。用胶体金、胶乳免疫层析法来进行抗原检测的方法逐渐应用于呼吸道病毒的检测,这些方法检测时间短,标本采集后8 ~15 min 便可用肉眼观察结果,不需要特殊设备,有望在临床实验室甚至在基层的社区医院推广。本研究报道了一种已在国外临床使用的流感病毒抗原快速检测方法在儿科流感样病例病原诊断中的应用结果,并将该方法与流感病毒诊断的金标准——病毒分离法进行比较分析。
1 方法
1.1 标本来源 2010 年12 月至2011 年4 月根据中国卫生部颁布的《流行性感冒诊断与治疗指南(2011 年版)》从首都儿科研究所附属儿童医院门诊采集发病3 d 内的流感样病例(即体温≥38℃,伴咳嗽、咽痛或流涕症状之一,同时缺乏其他实验室诊断依据)的14 岁以下患儿的咽拭子标本。流感样病例的纳入和标本采集由经培训的临床医生负责。
1.2 实验设计和方法 ①流感病毒抗原检测采用甲型和乙型流感病毒抗原检测试剂盒,以推荐的流感病毒检测的病毒分离法[《流行性感冒诊断与治疗指南(2011 年版)》]为对照方法,并检测该试剂盒与其他常见的呼吸道病毒之间的交叉反应性。每次采集的标本在现场进行抗原快速诊断(8 min 出结果);②病毒分离法则是将标本收集后于当日进行细胞接种(几天至2 周出结果)。③对于抗原检测和病毒分离法结果不相符的咽拭子标本集中采用RT-PCR方法验证。三部分实验由不同的实验人员操作。
1.3 标本采集方法 同时用两支无菌粘胶纤维采样拭子(Copan 公司,意大利)对有流感样症状的就诊患儿采集咽拭子标本,其中一支拭子放入病毒采样液中立刻置于冰壶,用于病毒分离(需要时行RT-PCR 验证),另一支拭子即刻在现场进行流感病毒抗原的快速诊断。
1.4 流感病毒抗原检测 使用甲型和乙型流感病毒抗原检测试剂盒(QuickNaviTM-Flu,生研公司产品,日本)胶乳免疫层析法对咽拭子标本进行抗原检测。使用该试剂盒时将样品滴加在检测卡的样品孔中,样品通过毛细管现象移动至结合垫,溶解此处的抗甲型及抗乙型抗体结合乳胶,与样品中的甲型或乙型抗原结合形成免疫复合物。该免疫复合物通过毛细管现象移动至试纸的薄膜内,被固定在测试带上的抗甲型或抗乙型抗体特异性捕捉,甲型呈红色带状、乙型呈蓝色带状。该试剂盒可以使用一个检测卡同时检测标本中的甲型或乙型流感病毒抗原。标本采集和加样严格按照说明书操作,于加样后8 min 肉眼判定检测结果。
1.5 病毒分离法 咽拭子标本经常规处理后,接种于传代狗肾细胞(MDCK),置33℃恒温室培养。用于病毒分离的维持液含有2 μg·mL-1的TPCK 处理的胰酶(Sigma 公司,美国)。逐日观察细胞病变,自标本接种后第3 日起每隔2 d 用0.75%的豚鼠血细胞进行血细胞凝集试验(简称血凝试验)。血凝试验阳性的培养液进行血凝抑制试验鉴定型别。第1 代病毒分离的细胞上清血凝试验阴性者行盲传培养。传第2 代培养仍为阴性者判定为病毒分离阴性。
1.6 流感病毒分离株型别鉴定 血凝试验阳性的培养上清中血凝滴度以(+ +)凝集的病毒,最高稀释度的倒数为1 个血凝单位。制备4 个血凝单位作为抗原,用血凝抑制试验鉴定流感病毒亚型[甲1(原季节性H1N1)、H3N2、乙型(Victoria 和Yamagata 系)、2009 甲型H1N1]。用于分离株型别鉴定的流感病毒特异性分型血清为WHO 的流感病毒参考血清,均由美国CDC 流感实验室提供。
1.7 标本核酸提取 咽拭子标本液(与病毒分离所用同一管)按常规处理并使用QIAamp®Viral RNA Mini Kit(Qiagen 公司)提取标本中的核酸。按照说明书进行操作。
1.8 RT-PCR 以中国国家流感中心提供的特异性引物和探针,参照中国流感中心下发的RT-PCR 方法,对抗原检测与病毒分离法结果不相符的标本进行流感病毒核酸检测和型别鉴定[2]。
1.9 QuickNaviTM-Flu 与其他常见呼吸道病毒之间的交叉反应性 使用QuickNaviTM-Flu 检测常见的其他6 种呼吸道病毒的培养物,包括RSV、腺病毒、副流感病毒1 ~3 型和人偏肺病毒的培养物(本实验室制备)。
1.10 统计学方法 对QuickNaviTM-Flu 和病毒分离法的结果进行Kappa 一致性检验分析。Kappa 值≥0.75,表明两者一致性较好;0.75 >Kappa 值≥0.4,表明两者一致性一般;Kappa 值<0.4,表明两者一致性较差。
2 结果
本研究纳入流感样病例共350 例,其中男204 例,女146 例。患儿年龄为1 个月至13 岁。所采集的咽拭子标本同时进入病毒抗原快速诊断和病毒分离法分析。
2.1 病毒分离结果 从350 例咽拭子标本中分离到106株流感病毒,阳性率为30.3%。经血凝抑制试验鉴定,其中8 株为乙型流感病毒(3 株Victoria 和5 株Yamagta 系毒株);98 株为甲型流感病毒(包括72 株H3N2,26 株2009 甲型H1N1)。流感病毒阳性患儿中~6 岁组为46.2%,~3岁组为30.2%(表1)。
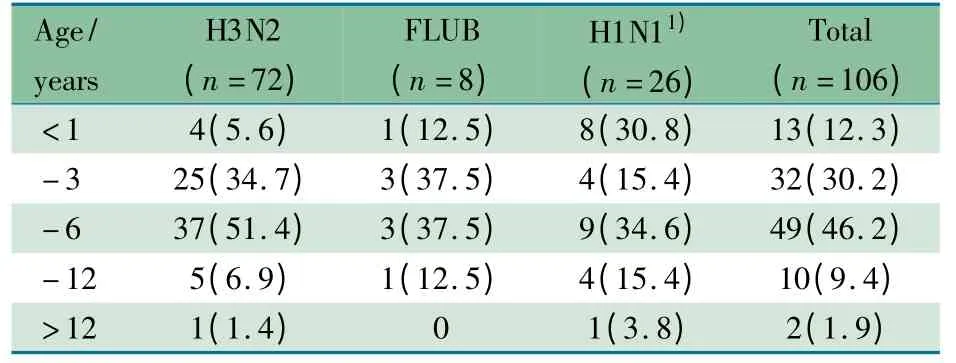
表1 不同型别流感病毒阳性患儿的年龄分布[n(%)]Tab 1Age distribution of children infected by different type influenza viruses[n(%)]
2.2 标本中流感病毒抗原检测结果 350 例咽拭子标本经QuickNaviTM-Flu 试剂盒检测,显示102 例标本为甲型流感病毒阳性,阳性率为29.1%;7 例标本为乙型流感病毒阳性,阳性率为2.0%;总阳性率为31.1% (109/350)。
2.3 流感病毒抗原检测与病毒分离法结果比较
2.3.1 甲型流感病毒检测结果比较 表2 显示,88 例咽拭子标本采用QuickNaviTM-Flu 检测甲型流感病毒抗原与病毒分离法均为阳性,10 例为抗原检测阴性而病毒分离法阳性,敏感度为89.8%(88/98);238 例用QuickNaviTM-Flu检测甲型流感病毒抗原与病毒分离法均为阴性,14 例为抗原检测阳性而病毒分离法阴性,特异度为94. 4% (238/252),总符合率为93.1%[(88 +238)/350]。一致性检验显示两种方法的一致性好(Kappa=0.832,95%CI:0.767 ~0.897)。

表2 流感病毒抗原检测和病毒分离法检测甲型流感病毒比较(n)Tab 2Comparison of influenza virus A detection by QuickNaviTM-Flu and virus isolation(n)
2.3.2 乙型流感病毒检测结果比较 表3 显示,7 例咽拭子标本用QuickNaviTM-Flu 检测乙型流感病毒抗原与病毒分离法均为阳性,1 例为抗原检测阴性而病毒分离法阳性,敏感度为87.5%(7/8);342 例用QuickNaviTM-Flu 检测乙型流感病毒抗原和病毒分离法均为阴性,特异度为100%(342/342),总符合率为99.7%[(7 +342)/350]。一致性检验显示两种方法的一致性好(Kappa =0. 932,95% CI:0.799 ~1.066)。

表3 流感病毒抗原检测和病毒分离法检测乙型流感病毒比较(n)Tab 3Comparison of influenza virus B detection by QuickNaviTM-Flu and virus isolation(n)
2.3.3 甲型和乙型流感病毒总检测结果比较 表4 显示,QuickNaviTM-Flu 检测甲型和乙型流感病毒抗原与病毒分离法的总敏感度为89.6%[(88 +7)/(98 +8)],总特异度为94.3% (230/244),总符合率为92.9%[(88 +7 +230)/350]。一致性检验显示两种方法的一致性好(Kappa =0.832,95%CI:0.769 ~0.895)。
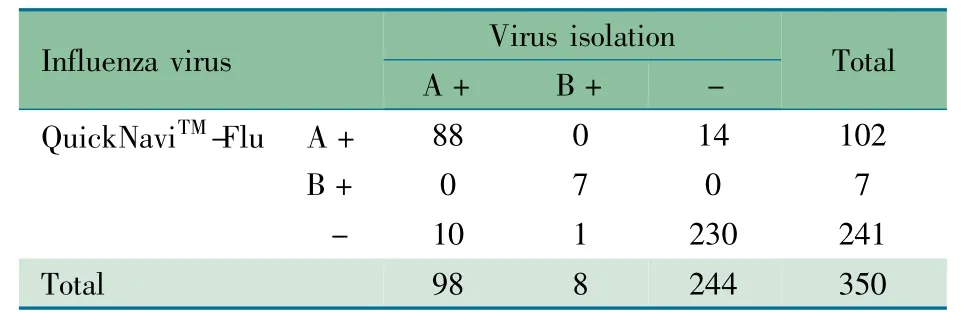
表4 流感病毒抗原检测和病毒分离法检测甲型和乙型流感病毒的比较(n)Tab 4Comparison of influenza virus A and B detection by QuickNaviTM-Flu and virus isolation(n)
2.3.4 RT-PCR 验证后结果比较 表5 显示,QuickNaviTMFlu 检测甲型流感病毒抗原阳性而病毒分离法为阴性的14例标本,经RT-PCR 验证后13 例为阳性,与QuickNaviTMFlu 结果一致,1 例仍为阴性;10 例病毒分离法阳性而QuickNaviTM-Flu 检测阴性标本经PCR 验证后均为阳性。以RT-PCR 验证结果作为最终标准修正后,显示敏感度、特异度和总符合率均有所升高(分别为91. 0%、99. 6% 和96.9%),两种方法的一致性也相应升高(Kappa =0.926,95%CI:0.883 ~0.969)。
1 例病毒分离法为乙型流感病毒阳性而QuickNaviTMFlu 检测为阴性的标本,经RT-PCR 方法验证后为阳性,因此QuickNaviTM-Flu 检测乙型流感病毒的结果与未验证之前一致。

表5 经RT-PCR 验证后QuickNaviTM-Flu 和病毒分离法检测甲型流感病毒的比较(n)Tab 5Comparison of influenza virus A detection by QuickNaviTM-Flu and virus isolation verified by realtime RT-PCR(n)
2.4 与其他呼吸道病毒的交叉反应 以其他常见的6 种呼吸道病毒的培养物作为待检样本,使用QuickNaviTM-Flu检测,结果均为阴性。
3 讨论
流感是全球传染性较强的感染性疾病之一。由于流感病毒易发生抗原漂移,人群对流感病毒普遍易感。在历史上,全球出现过数次流感大流行,最近一次发生的大流行于2009 年3 月首先在墨西哥暴发了甲型H1N1 流感,随后迅速蔓延至世界各地,对公众健康和社会造成了严重的危害,中国同样也受到了波及[5]。研究显示,0 ~3 岁婴幼儿感染流感之后因严重并发症导致住院的可能性与65 岁以上老年人相当,属于高危人群。同时学龄前和学龄期儿童往往是流感的第一受害者,并成为主要的传播者之一[6]。因此流感样病例的快速病原诊断非常重要,及时确诊有利于正确的治疗。
至今仍认为流感病毒诊断的金标准为病毒分离法,但需要进行细胞或鸡胚分离培养,一般耗时3 ~7 d。流感病毒的快速诊断包括了抗原检测和核酸检测。核酸检测需要对临床标本中的病毒核酸进行提取、逆转录和目的基因的扩增及检测,一般耗时4 h 左右,并且需要在符合条件的实验室进行。抗原检测可采用免疫荧光法和免疫层析法检测,耗时短。免疫荧光法需要特殊仪器及有经验的专业人员进行结果判断,而免疫层析法可在短时间内实现特异性的抗原检测,确定病原。本研究比较分析了利用免疫层析法对流感病毒进行快速抗原检测的方法在儿科流感样病例病原诊断中的应用效果。
QuickNaviTM-Flu 试剂盒只需单独一个检测卡即可在8 min 内对甲型和乙型流感病毒进行抗原诊断并分型,并且与其他常见的呼吸道病毒之间无交叉反应。本研究显示该方法与经典的流感病毒培养的一致性好,其检测甲型流感病毒的敏感度为89.9%,特异度为94.4%。经RT-PCR 验证后,13/14 例抗原检测和病毒分离法不相符样本结果为阳性(与抗原检测结果一致),使该抗原检测方法的敏感度和特异度升至91.0%和99.6%。抗原检测乙型流感病毒经RT-PCR 验证前后的结果一致,因此检测乙型流感病毒抗原的敏感度和特异度仍为87.5%和100%。病毒分离法结果显示在阳性标本中包括了H3N3、乙型(Victoria 和Yamagata 系)和新发的2009 甲型H1N1,提示该试剂盒所提供的抗原检测方法虽然不能对标本中的流感病毒进行亚型的鉴别,但是能够很好地检出目前在人类流行的所有流感病毒亚型,包括2009 年新出现的猪源的发生人类大流行的甲型H1N1。
QuickNaviTM-Flu 作为流感病毒抗原诊断的试剂盒,耗时短,操作简便,具有良好的敏感度和特异度,在临床病例的诊断、流感监测和突发疫情时可在短时间内对流感疑似病例进行病原的排查和确诊。
[1]Wang F(王芳),Zhu RN,Qian Y,et al. Surveillance for influenza B virus infections in infants and young children in Beijing,China. Chin J Pediatr(中华儿科杂志),2008,46(2):94-97
[2]Zhu RN(朱汝南),Qian Y,Wang F,et al. Surveillance for influenza A virus infections in infants and young children in Beijing,China,2001-2005. Chin J Pediatr(中华儿科杂志),2006,47(11):518-522
[3]Yang JR,Lo J,Liu JL,et al. Rapid SYBR Green I and modified probe real-time RT-PCR assays identify influenza H1N1 viruses and distinguish between pandemic and seasonal strains. J Clin Microbiol,2009,47(11):3714-3716
[4]Hurt AC,Alexander R,Hibbert J,et al. Performance of six influenza rapid tests in detecting human influenza in clinical specimens. J ClinVirol,2007,39(2):132-135
[5]Cao B,Li XW,Mao Y,et al. Clinical features of the initial cases of 2009 pandemic influenza A (H1N1)virus infection in China. N Engl J Med,2009,361(26):2507-2517
[6]Writing Committee of the WHO Consultation on Clinical Aspects of Pandemic (H1N1)2009 Influenza. Bautista E,Chotpitayasunondh T,Gao Z,et al. Clinical aspects of pandemic 2009 influenza A (H1N1)virus infection. N Engl J Med,2010,362(18):1708-1719

