先天性血管环12 例诊断与治疗分析
崇 梅 李 伟 韩 玲 刘迎龙 金 梅 顾 虹 程 沛 苏俊武 耿 斌 贺 彦
“血管环”一词最早由Gross 于1945 年在N Engl Med J报道主动脉双弓时首次提出,由于胚胎期多对鳃弓和成对的背侧主动脉未能顺序融合和吸收,在解剖上形成完全性或不完全性血管环,围绕气管和(或)食管造成压迫的一组先天性血管畸形。血管环是一类较少见的先天性大血管发育异常,占先天性心脏病的1% ~2%。临床上主要表现为呼吸道和(或)消化道症状,往往被误诊或漏诊,早期正确诊断和及时手术治疗是生存的关键[1]。近几年随着对血管环认识水平的提高及诊断方法的进步,相关报道逐渐增多,但仍缺乏大宗的病例报道[2]。本研究回顾性分析首都医科大学附属北京安贞医院(我院)儿童心脏中心2008 年7 月至2011 年12 月收治先天性血管环患儿的临床特征、诊断和治疗情况,以期提高该病的诊治水平。
1 方法
1.1 血管环的诊断方法和流程 血管环的完整诊断包括血管环的起源、走行、形态,合并心内畸形以及气管、支气管、食道的狭窄情况。对考虑诊断为血管环的患儿进行以下检查以明确诊断:①胸部X 线:初步了解主动脉弓位置、形态,肺充血和肺动脉段突出情况,有无肺炎、肺不张和肺气肿等;②超声心动图:探查主动脉弓及其分支有无异常,左肺动脉起始位置、内径及合并心内畸形等;③64 排CT 血管及气道重建:直观显示血管环的位置、形态,与周围组织的关系,气管、食管有无狭窄及狭窄的程度、位置与长度等;④纤维支气管镜:明确气管狭窄的位置、性质与程度;⑤肺功能:了解有无阻塞性改变;⑥随访:术后3、6、12 个月门诊规律随访,1 年后每年随访1 次,随访项目包括症状、体征、超声心动图、部分呼吸道症状明显患儿复查64 排CT。。
1.2 纳入标准 ①2008 年7 月至2011 年12 月在我院诊断为血管环的连续病例;②血管环的诊断符合以下标准:环绕气管和(或)食管并产生压迫的一组先天性血管畸形,分为完全性或不完全性血管环,完全性血管环包括主动脉双弓(DAA)、右位主动脉弓合并左侧导管/韧带或左位主动脉弓合并右侧导管/韧带等,形成包绕气管与食管的完整环。部分性血管环包括肺动脉吊带(PAS)、无名动脉压迫综合征以及迷走右锁骨下动脉,形成半环状结构[3]。
1.3 临床资料截取 从病史资料中截取以下项目用于分析:①一般情况:性别和年龄等;②临床资料:发病年龄、临床表现、实验室检查、影像学检查(包括胸部X 线片、超声心动图、64 排CT)、纤维支气管镜、肺功能和治疗情况;③心脏手术方式:根据血管环的病理类型选择术式,包括切断双主动脉弓中的次弓、切断右位主动脉弓伴随的左位动脉导管和左肺动脉移植术。④随访情况。
2 结果
2.1 一般情况 影像学表现符合血管环诊断12 例患儿进入分析(表1)。男3 例,女9 例。起病年龄1 d 至1 岁,确诊年龄1 个月至21 岁,中位年龄6.5 个月,<3 个月1 例,~6 个月5 例,~1 岁1 例,~3 岁3 例,~21 岁2 例。仅2例(例3,4)在外院首诊时得到正确诊断,9 例误诊或漏诊,其中例5 出生后2 个月即出现反复咳喘,就诊多家医院,2年后CTA 检查发现PAS;例6 在外院拟行房间隔缺损(ASD)封堵术,术中右心导管检查难以达到左肺动脉,肺动脉造影发现PAS(表1)。
2.2 临床表现 表1 显示,11 例有反复发作咳嗽、喘鸣和肺炎等呼吸道症状,内科诊治效果不佳,其中1 例(例4)生后即有严重的呼吸困难、喘鸣。2 例(例2,9)伴有进食缓慢、喂养困难;伴有心脏杂音10 例,青紫3 例(例9 ~11)。例10 无明显呼吸道和消化道症状,因青紫和心脏杂音就诊;9 例生长落后(身高或体重低于同性别、同年龄正常健康儿童的P3
[4])。
2.3 辅助检查 辅助检查结果如表1 所示。
2.3.1 胸部X 线片 例12 示右位主动脉弓,例5 示中位心,肺血增多6 例,肺动脉段突出3 例(例2,3,7),肺炎7例,右肺膨胀不全1 例。
2.3.2 超声心动图 12 例超声心动图示DAA 4 例,其中例8 单发,例9 合并法洛四联症、动脉导管未闭(PDA),例10 合并肺动脉闭锁、室间隔缺损(VSD)和PDA,例11 合并大动脉转位、肺动脉闭锁和VSD;例12 右位主动脉弓伴左位动脉导管和VSD;PAS 7 例,其中合并VSD 2 例,ASD 4例,部分型心内膜垫缺损1 例,PDA 1 例(图1A ~C)。
2.3.3 64 排CT 例1 放弃诊治,未行CT 检查,例8 拒绝行CT 检查,余10 例行64 排CT 清晰显示血管环的位置、形态以及与周围组织的关系,气管、支气管狭窄程度、位置及范围。右侧气管狭窄3 例(例4,5,7,图1D ~F),主气管狭窄5 例(例3,6,9,11,12,图2),左主支气管狭窄1 例(例2),食管狭窄2 例(例2,9)。
2.3.4 纤维支气管镜 2 例行纤维支气管镜检查,例4 示主气管狭窄,例5 示右主支气管狭窄。
2.3.5 肺功能 例7 行肺功能检查,示气道阻力增高,小气道功能障碍。
2.4 治疗 2 例(例1,11)未行手术自动出院,2 例(例2,4)因气管插管困难,出现严重低氧血症、高碳酸血症,未行手术死亡,例10 DAA 合并肺动脉闭锁患儿因外周肺血管床发育差,发绀严重,考虑不存在呼吸道和消化道压迫情况,暂且选择姑息腔肺分流术,以增加肺血缓解缺氧,再行双弓矫治术;余7 例患儿,全麻体外循环下行双弓矫治(切除小弓)2 例(例8,9);右位主动脉弓,左位PDA 缝扎并切断1 例(例12);左肺动脉移植术4 例(例3,5 ~7),对合并心内畸形同时矫治。例3 术后出现难以纠正的高气道阻力,致严重低氧血症、高碳酸血症,术后3 d 死亡。体外循环时间70 ~123 min,气管插管机械通气时间11 ~72 h,例12 术后20 h 拔管后CPAP 辅助呼吸6 d。6例患儿术后规律随访,2例术前呼吸道症状严重者复查64 排CT。6 例术后复查胸部X 线片检查,肺炎消失,超声心动图均示心脏血管畸形矫治满意,例5 ~7 可见左肺动脉重新与主肺动脉相连,例8,9 未见主动脉弓异常分支,例12 未见左位PDA。例5,6 复查CT 示气道外压性狭窄较前明显减轻。3 例(例7~9)在术后3 个月和3例(例5,6,12)在术后6个月呼吸道症状逐渐好转,生长发育较前改善。

?
3 讨论
完全性或不完全性血管环临床表现主要是压迫呼吸道和(或)消化道而出现的症状,容易被漏诊或误诊。完全性血管环同时将气管和食道包绕在内,不完全性血管环如PAS 走行在气管后方和食管前方,而造成不同程度压迫症状。本组病例中完全性血管环包括DAA、右位主动脉弓合并左侧导管/韧带,形成包绕气管和食管的完整环;部分性血管环包括PAS,为半环状结构。本组11/12 例患儿存在喘鸣、气促、咳嗽、呼吸窘迫和反复呼吸道感染,临床上常误诊为呼吸系统疾病,仅2 例(例3,4)在外院首诊时得到正确诊断,9 例误诊或漏诊。本组10 例合并心内畸形的患儿,其反复呼吸道感染、心力衰竭、气促和发绀等临床表现常被临床医生归结于心脏畸形的症状而忽视血管环的诊断,致其中8 例漏诊,因考虑心脏畸形来我院就诊才得以明确诊断。2 例(例2,9)由于食管受压,出现进食缓慢、反复呕吐及喂养困难,易被疑诊为先天性食管狭窄。因此,对于反复出现呼吸道和(或)消化道症状者,应想到本病的可能,采取必要的辅助检查方法明确诊断[5]。
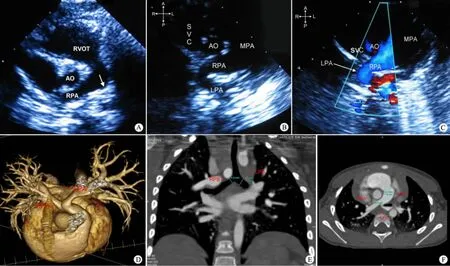
图1 PAS 患儿超声心动图和CTA 成像(例5)Fig 1 Pulmonary artery sling echocardiography and CTA imaging (No.5)

图2 DAA 患儿的CTA 成像(例11)Fig 2 Double aortic arch CTA imaging (No.11)
本组12 例患儿多以呼吸道症状起病,胸部X 线片检查必不可少,可提示主动脉弓的位置、形态、肺部炎症、肺膨胀不全以及气道的狭窄;本组1 例胸部X 线片提示右位动脉弓,6 例提示肺血增多。对于伴随消化道症状者消化道钡餐检查可以协助鉴别主动脉双弓(食管后端受压)和肺动脉吊带(食管前端受压),由于本组2 例(例2,9)消化道压迫症状较轻,且年龄小,未采用此项检查。超声心动图检查可很好探查主动脉弓的位置及其分支、走向,当主肺动脉未探及左肺动脉分叉时,应注意左肺动脉起自右肺动脉的可能,并且可以诊断合并的心脏畸形,但是其缺陷在于不能明确血管环对周围组织的压迫,并且不能发现无血流通过的闭锁的弓和动脉韧带。因此,需要进一步行多排CT 心血管、气道三维重建,可直观显示异常血管的走行,对气管和食管的压迫,并可对气管、支气管管腔直径与面积进行准确的量化,本组10 例CT 均清晰显示了异常血管的走行,体现了在血管环诊断方面的价值。也有研究选择MRI 作为血管环的诊断评估方法,其为无创性检查,可以不用造影剂而清楚显示,然而通常情况下,婴幼儿MRI 检查需要全麻或深镇静,所需时间相对较长,由于血管环畸形患儿通常有喘鸣、呼吸困难或呼吸暂停,需要插管或机械通气,所以MRI 在婴幼儿中的应用受到限制[6,7]。纤维支气管镜可产生气管狭窄部一系列图像,对于先天性气管狭窄或合并气管全环者,有重要的诊断价值,但因存在加重气道阻塞的风险,并不是必须的检查手段。也有术者在术中应用纤维支气管镜评估手术前后的疗效,了解手术对气管的压迫有无解除及解除程度[8]。本组2 例(例4,5)为进一步明确气管狭窄情况行纤维支气管镜检查。肺功能检查用于评价年长患儿呼吸功能状况、评估麻醉、外科手术的危险度,预测术后恢复情况。本组病例超声心动图对血管环及心脏畸形诊断的准确率高达100%,提示其可作为一种简单、无创的方法诊断血管环。超声心动图联合多排CT 进一步确定血管环对周围组织的压迫,以及气管支气管的狭窄程度,有助于外科医师实施手术。因此本研究认为超声心动图联合高分辨率多排螺旋CT 是血管环术前诊断、评估的最佳辅助检查。
血管环的内科治疗包括抗感染、物理治疗及营养支持等,一般作为术前准备的一部分。有症状的血管环病例,一经确诊应尽早进行外科手术治疗。本组2 例术前存在严重的感染,多日抗感染治疗无效,且病情加重,最终因气管狭窄及水肿,致插管困难死亡。提示对有感染征象的血管环患儿不宜推延手术,手术解除气道压迫有助于肺部感染的控制。手术治疗包括离断血管环、彻底松解血管环周围组织,根据血管环不同的病理类型,离断血管环手术包括切断双主动脉弓中的次弓、切断动脉韧带/导管或移植异位的血管,彻底松解血管环周围组织非常重要。
由于部分PAS 患儿气管支气管存在先天性发育异常的问题,对于支气管狭窄是否需要一期根治,也存在一定的争议。有研究[9]发现狭窄段气管可随患儿年龄的增长而生长,多数患儿在9 岁时狭窄段气管管径将接近正常水平,可避免手术。但对于气管狭窄严重,尤其伴有长段病变,症状明显者仍需手术治疗[10]。近年来,随着先天性气管狭窄手术病例的积累和治疗效果改善,合并气管狭窄可一期修补[11],但由于对长时间体外循环耐受的有限性,复杂先天性心脏病合并气管狭窄一期手术是小婴儿手术死亡的危险因素,手术治疗仍具有较高的病死率和并发症发生率[12]。本组7 例患儿均未进行气管狭窄的同期手术治疗,1 例术后出现难以纠正的高气道阻力,考虑存在先天性气管狭窄,此类合并气管狭窄患儿在何种情况下选择一期根治术,尚需要积累经验。其他6 例患儿成功手术,术后3 ~6 个月呼吸道症状逐渐缓解,2 例复查CT 示气管狭窄程度减轻,但在狭窄气管远期生长等方面,仍需要长期随访。
总之,对临床出现慢性喘息、气促、呼吸困难或(和)吞咽困难、进食缓慢的患儿,尤其是内科治疗效果不佳者,应想到血管环的可能,以免延误诊治。超声心动图联合多排CT 是血管环术前诊断、评估的最佳辅助检查,早期正确诊断和及时手术治疗是生存的关键。
[1]Phelan E,Ryan S,Rowley H. Vascular rings and slings:interesting vascular anomalies,J Laryngol Otol,2011,125(11):1158-1163
[2]Ma GQ,Li ZZ,Li XF,et al.Congenital vascular rings:a rare cause of respiratory distress in infants and children. Chin Med J(Engl),2007,120(16):1408-1412
[3]Backer CL,Mavroudis C. Congenital Heart Surgery Nomenclature and Database Project:vascular rings,tracheal stenosis,pectus excavatum,Ann Thorac Surg,2000,69(S):308-318
[4]Li H (李辉),Ji CY,Zong XN,et al. Height and weight standardized growth charts for Chinese children and adolescents aged 0 to 18 ages. Chin J Pediatr(中华儿科杂志),2009,47(7):487-492
[5]Turner A,Gavel G,Coutts J. Vascular rings-presentation,investigation and outcome. Eur J Pediatr,2005,164(5):266-270
[6]Hernanz-Schulman M. Vascular rings:a practical approach to imaging diagnosis. Pediatr Radiol,2005,35(10):961-979
[7]Kellenberger CJ. Aortic arch malformations. Pediatr Radiol,2010,40(6):876-884
[8]Gaafar AH,El-Noueam KI. Bronchoscopy versus multi-detector computed tomography in the diagnosis of congenital vascular ring. J Laryngol Otol,2011,125(3):301-308
[9]Cheng W,Manson D,Forte V,et al. The role of conservative management in congenital tracheal stenosis:an evidence-based long term follow-up study. J Pediatr Surg,2006,41(7):1203-1207
[10]Terada M,Hotoda K,Toma M,et al. Surgical management of congenital tracheal stenosis. Gen Thorac Cardiovasc Surg,2009,57(4):175-183
[11]Xu ZW,Li WH. One stage surgical correction of congenital cardiac disease and congenital tracheal stenosis in infants and children. J Card Surg,2009,24(5):558-560
[12]Okamoto T,Nishijima E,Maruo A,et al. Congenital tracheal stenosis:the prognostic significance of associated cardiovascular anomalies and the optimal timing of surgical treatment. J Pediatr Surg,2009,44(2):325-328

