红曲多糖的过氧化氢法脱色工艺研究*
汪鹏荣, 陈文静, 韦 凤, 董夏梦, 蒋冬花
(浙江师范大学化学与生命科学学院,浙江金华 321004)
红曲霉是一类十分重要的药用真菌,系中药红曲的基原菌[1],是一类小型丝状腐生真菌,属子囊菌亚门(Ascomycotina)不整囊菌纲(Plectomycetes)散囊菌目(Eurotiales)红曲科(Monascaceae).由于红曲霉在发酵过程中能产生多种具有生理活性的代谢产物,如红曲色素、Monacolin类物质、红曲多糖、γ-氨基丁酸及多种酶类,因此红曲霉的次级代谢产物也成为研究的焦点.红曲多糖是从红曲霉发酵液和菌丝体中分离出来的一种活性多糖,具有广泛的生物学作用,如抗肿瘤、抗氧化、抗病毒、提高免疫力等多种功能[2-5].红曲粗多糖呈黄褐色,颜色较深,对后续的分离纯化及生物活性的研究有较大的影响.因此,对红曲粗多糖进行脱色,既可以提高多糖的纯度,又有利于对红曲多糖活性的研究.
响应面分析法(Response Surface Method,RSM)是由Box等于20世纪50年代提出的一种优化工艺条件的有效方法[6].它以回归方程作为函数估算的工具,确定各因素及其交互作用对响应指标的影响,精确地表述因素和响应值之间的关系.响应面法已经在诸多工艺过程优化中得到应用[7].本研究以过氧化氢为脱色剂,在单因素实验的基础上,采用响应面分析法对红曲多糖的过氧化氢脱色工艺进行了优化.
1 材料与方法
1.1 材料
红色红曲霉(Monascus rubber)菌株Mr-70由本实验室自行分离得到.
1.2 培养基
1)种子培养基
参见文献[8].组成:葡萄糖50 g,蛋白胨5 g,酵母膏 1 g,KH2PO41 g,FeSO4·7H2O 0.01 g,MgSO4·7H2O 0.5 g,水 1 000 mL,pH 6.0.
2)发酵培养基
参见文献[9].蔗糖40 g/L,酵母粉4.5 g/L,KH2PO4·3H2O 3.5 g/L,MgSO4·7H2O 0.4 g/L,发酵液起始pH 5.0.
1.3 仪器设备与试剂
C24KC生物恒温摇床(美国Certified公司);MIKRO-22R高速冷冻离心机(德国Hettichi公司);UV-7504紫外可见分光光度计(上海欣茂仪器公司);DHG-9101.28A电热恒温鼓风干燥箱(山东鄄城科源仪器设备厂);HH-4数显恒温水浴锅(山东鄄城科源仪器设备厂);JA3003A天平(上海精天电子仪器有限公司).
过氧化氢(3%)和无水乙醇均为国产分析纯.实验用水为去离子水.
1.4 红曲粗多糖的提取
用打孔器(直径0.8 cm)取30℃培养5 d的红曲霉菌株Mr-70接种到种子培养基中,在30℃培养48 h,再接种到液体发酵培养基中,以200 r/min,30℃培养96 h.发酵液抽滤,向滤液中加入4倍体积的无水乙醇,在5℃静置12 h后离心,沉淀用乙醇和丙酮反复冲洗多次,在80℃烘干12 h至恒重,即得红曲霉胞外粗多糖.
1.5 脱色率测定
对红曲粗多糖溶液进行可见-紫外光全波长扫描,结果表明无色素的最大吸收波长.根据互补色原理,选择450 nm为检测波长[10],并按照公式(1)计算脱色率:

1.6 单因素实验
选取过氧化氢加入量、脱色温度和脱色时间3个影响因素,分别做单因素实验.具体做法如下:取20 mL的试管,分别加入4 mL红曲粗多糖提取液,按设计要求加入适量的过氧化氢,在设定的温度下震荡脱色相应时间,测定脱色前后的吸光度A450,按公式(1)计算各自的脱色率.
1.7 响应面优化设计实验
根据单因素实验结果,选择确定过氧化氢加入量、脱色时间和脱色温度的3个水平,按Box-Behnken方法设计3因素3水平的实验,并利用响应面法对红曲多糖的过氧化氢脱色条件进行优化.实验设计方案如表1所示.

表1 Box-Behnken中心组合实验设计因素和水平
2 结果与分析
2.1 过氧化氢加入量对脱色效果的影响
用过氧化氢法脱除红曲多糖溶液的色素时,4 mL多糖(8 mg/mL)溶液中分别加入1,2,3,4 和5 mL 3%过氧化氢溶液,50℃水浴条件下脱色120 min,过氧化氢的加入量与脱色效果的关系如图1所示.
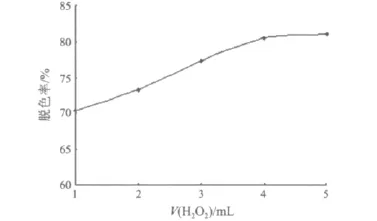
图1 3%过氧化氢溶液加入量对脱色率的影响
由图1可知,随着过氧化氢加入量的增加,红曲多糖的脱色率逐渐提高.但是,当过氧化氢加入量超过4 mL后,脱色率增加很缓慢.过氧化氢加入量从1 mL增加到3 mL时,脱色率增加了6.92%;从3 mL增加到4 mL时,脱色率增加了3.16%;而从4 mL增加到5 mL时,脱色率仅仅增加了0.59%.考虑到成本和降解等因素,选择3%过氧化氢溶液的适宜加入量为4 mL.
2.2 脱色时间对脱色效果的影响
用过氧化氢脱除红曲多糖溶液的色素时,4 mL多糖(8 mg/mL)溶液中加入4 mL 3%过氧化氢溶液,50℃水浴条件下设定脱色时间分别为30,60,90,120 和 150 min,脱色时间与脱色效果的关系如图2所示.
由图2可知,随着脱色时间的增加,脱色率也随之增加,但当脱色时间超过120 min后,脱色率增加很缓慢.考虑到随着脱色时间的增加多糖的损失也会增加,选定120 min为最佳脱色时间.
2.3 脱色温度对脱色效果的影响
用过氧化氢脱除红曲多糖溶液的色素时,4 mL多糖(8 mg/mL)溶液中加入4 mL 3%过氧化氢溶液,分别在30,40,50,60和70℃水浴条件下脱色120 min,脱色温度与脱色效果的关系如图3所示.
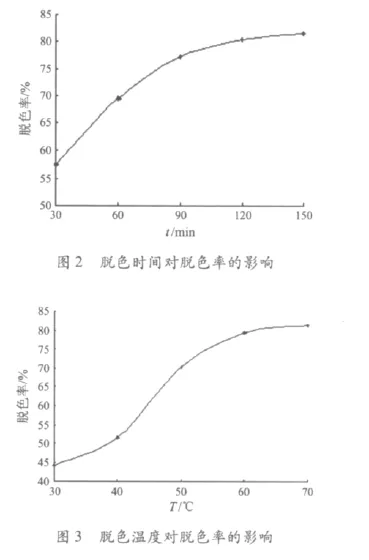
由图3可知:温度对红曲多糖脱色率的影响较大,从30℃到40℃,脱色率增加了7.46%;从40℃到60℃,脱色率分别增加了18.67%和9.07%;而从60℃到70℃,脱色率仅仅增加了1.86%,同时,高温还容易使多糖降解.因此,选择60℃为本研究的最适脱色温度.
2.4 响应面法优化红曲多糖过氧化氢脱色工艺
在单因素实验结果的基础上,以过氧化氢加入量、脱色时间和脱色温度3个因素为自变量、红曲多糖脱色率为响应值,采用响应面分析法在3因素3水平上对红曲多糖的脱色工艺进行优化.实验因素与水平设计见表1;响应面实验方案及结果见表2.
2.4.1 Box-Benhnken 实验设计与分析
Box-Behnken设计每个因素取3个水平,以(-1,0,+1)编码,对数据进行二次回归拟合,得到包括一次项、平方项和交互项的二次方程,分析各因素的主效应和交互效应,最后在一定水平范围内求取最佳值[11].表2中,12组实验为析因实验、3组为中心实验.15个实验点分为析因点和零点,其中:析因点为自变量取值在X1,X2和X3所构成的三维顶点;零点为区域的中心点,零点实验重复3次,用以估计实验误差.
2.4.2 回归方程的建立与方差分析
利用 Design-Expert(version7,Stat-EaseInc.,MinneapolisN.USA)软件对表2数据进行多元回归拟合,得到了红曲多糖脱色率(Y)对过氧化氢加入量(X1)、脱色时间(X2)和脱色温度(X3)的二次多项式回归模型:
表3和表4是对方程(2)的方差和回归分析结果.由表 3和表 4可知:FModel=42.92,P=0.000 3 <0.01,表明二次多项式回归模型极显著;P失拟项=0.115 2 >0.05,说明模型失拟不显著;模型的确定系数R2=0.987 2,表明模型与实验数据有98.72%的符合度;调整后的 R2Adj=0.964 2,表明模型有很高的可信度,可以用此模型对红曲多糖的过氧化氢法脱色进行分析和预测.其中:模型的一次项X1,X2和X3显著,单因素对红曲多糖脱色率的影响大小顺序依次是脱色温度﹥脱色时间﹥过氧化氢加入量;二次项X21,X22和X23显著;交互项中X1X3和X2X3显著,X1X2不显著.
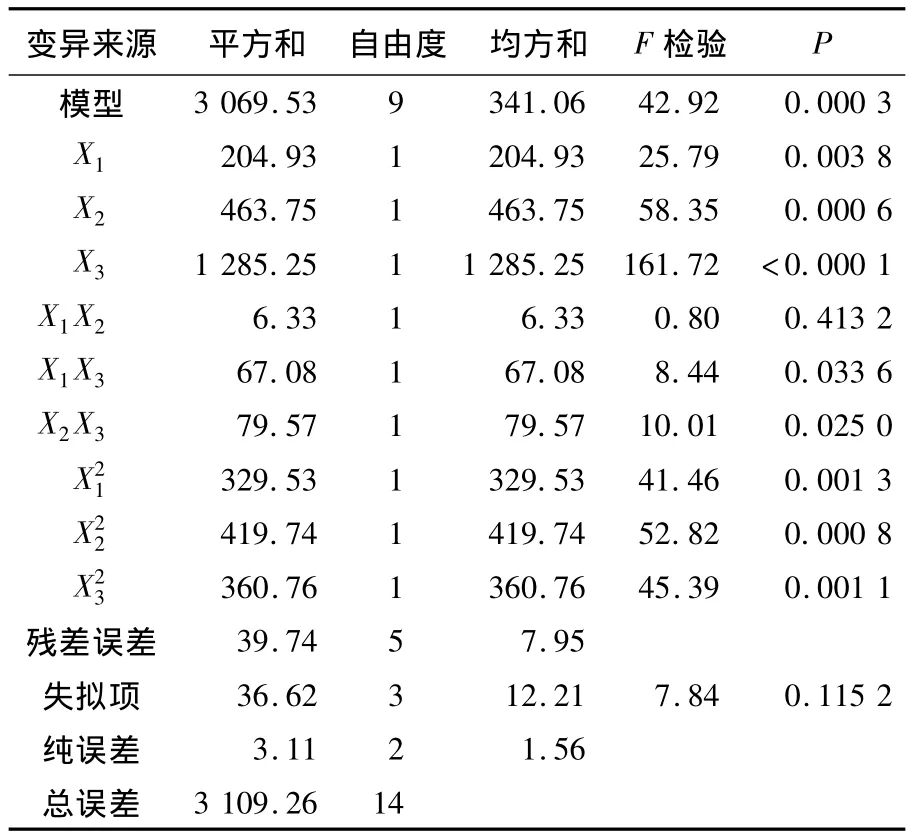
表3 方差分析表
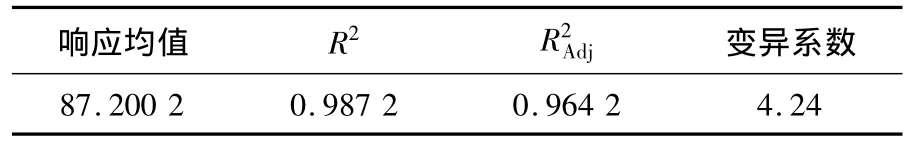
表4 回归分析表
2.4.3 红曲多糖脱色率的响应面法分析
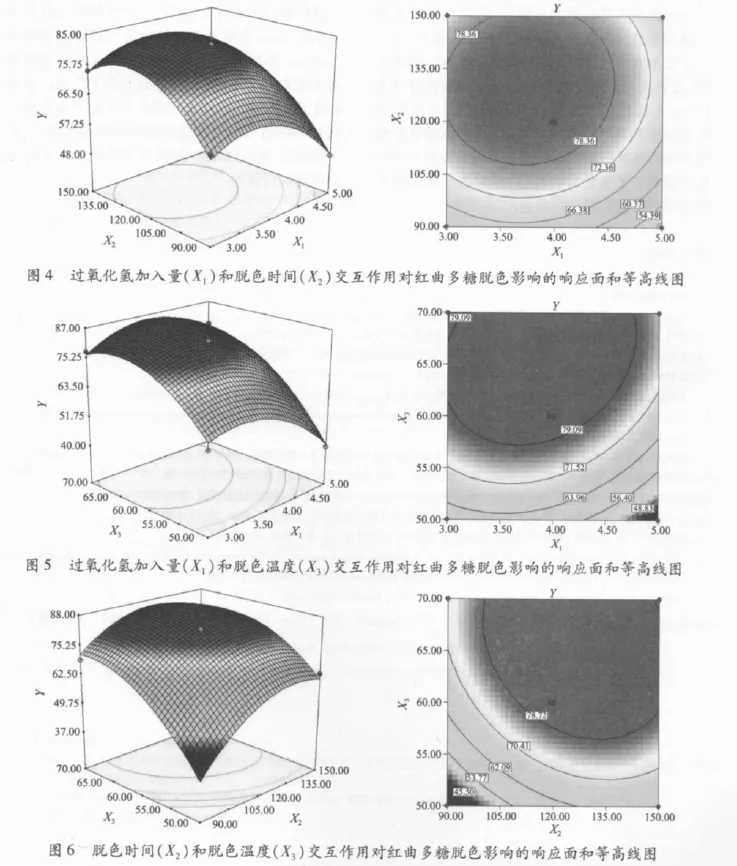
响应面分析的图形是特定的响应值对应自变量构成的一个三维空间图,可以直观地反映出各自变量对响应值的影响[12].根据回归模型,利用Design-Expert软件作出相应的响应曲面和等高线图:过氧化氢加入量和脱色时间对红曲多糖脱色率的影响见图4;过氧化氢加入量和脱色温度对红曲多糖脱色率的影响见图5;脱色时间和脱色温度对红曲多糖脱色率的影响见图6.等高线的形状(圆形或者椭圆形)可以反映出变量之间的相互影响是否显著,圆形表示两因素间交互作用不显著,而椭圆形则显著[13].
由图4可知:当脱色时间较短时,随着过氧化氢加入量的增加,红曲多糖脱色率先增加、后缓慢下降;而当脱色时间较长时,脱色率随过氧化氢加入量的增加缓慢升高后开始显著下降.因此,在脱色时间较短的情况下,过氧化氢加入量的增加有利于红曲多糖脱色率的提高,而在脱色时间较长时则呈现相反的趋势.
由图5可知:当过氧化氢加入量一定时,随着脱色温度的升高,红曲多糖脱色率逐渐增加,温度达到一定值后,脱色率趋于平缓;当脱色温度一定时,随着过氧化氢加入量的增加,红曲多糖脱色率呈现出下降的趋势.
由图6可知:当脱色温度不变时,随着脱色时间的延长,红曲多糖的脱色率逐渐增加,脱色时间达到一定值后,脱色率的变化趋于平缓;当脱色时间一定时,随着脱色温度的升高,红曲多糖的脱色率逐渐增加.表明欲达到较高的脱色率,提高脱色温度可缩短脱色时间.但是,较高的脱色温度可能会导致多糖的降解.在较低的脱色温度下,适当延长脱色时间有利于红曲多糖脱色率的增加.
2.4.4 红曲多糖脱色条件优化
通过软件分析得到红曲多糖过氧化氢脱色法的最佳脱色条件:4 mL多糖(8 mg/mL)溶液中3%过氧化氢溶液的加入量为3.87 mL、脱色时间为126.97 min、脱色温度为65.62℃,在此条件下红曲多糖脱色率的理论值为87.20%.为验证响应面分析法所得结果的可靠性,采用上述条件对红曲多糖进行脱色,考虑到实际操作的便利,将上述工艺参数修正为:4 mL多糖(8 mg/mL)溶液中3%过氧化氢溶液加入量为3.9 mL,脱色时间为127 min,脱色温度为65.6℃,3次平行试验得到的实际平均脱色率为86.24%.实际实验值与模型预测值基本一致.因此,基于响应曲面法所得的优化脱色工艺参数准确可靠,得到的红曲多糖的脱色条件具有实际应用价值.
3 结论
综上所述,为了探索用过氧化氢法脱除红曲多糖颜色的适宜工艺条件,在过氧化氢加入量、脱色时间和脱色温度3个单因素实验的基础上,采用3因素3水平的Box-Behnken中心组合实验设计进行响应面法优化实验,实验结果经过软件分析发现,红曲多糖过氧化氢法脱色最适宜的条件为:4 mL多糖(8 mg/mL)溶液中3%过氧化氢溶液的加入量为3.9 mL、脱色时间为127 min、脱色温度为65.6℃.在该条件下红曲多糖的脱色率可达86.24%,与响应面模型预测的脱色率87.20%十分相近,验证了响应面模型对脱色工艺优化结果预测的可靠性.
[1]Kohama Y,Matsumoto S,Mimura T,et al.Isolation and identification of hypotensive principles in red-mold rice[J].Chem Pharm Bull,1987,35(6):2484-2489.
[2]丁红梅.红曲多糖抑瘤作用初步研究[J].菌物研究,2007,5(3):171-173.
[3]蔡琴,沈彬彬,张慧,等.红曲霉菌胞外多糖提取及抗氧化活性测定[J].中华中医药学刊,2010(3):598-600.
[4]曾露燕,赵树欣,李燚.红曲霉抑菌成分糖肽类物质的分离纯化及稳定性[J].天津科技大学学报,2009,24(4):18-21.
[5]张建峰,昌友权,陈光,等.红曲多糖的免疫活性研究[J].食品科学,2008,29(2):391-393.
[6]曹新志,金征宇.响应曲面法在环糊精糖基转移酶反应中的应用[J].郑州工程学院学报,2004,25(1):58-61.
[7]Chandrika L P,Fereidoon S.Optimization of extraction of phenolic compounds from wheat using response surface methodology[J].Food Chemistry,2005,93(1):47-56.
[8]蒋冬花,后家衡,李杰,等.红腐乳中高产γ-氨基丁酸红曲霉菌株的筛选[J].浙江师范大学学报:自然科学版,2007,30(4):447-452.
[9]李霞姣,夏永军,王铁军,等.红曲多糖液态发酵工艺条件的优化[J].生物加工过程,2009,7(2):13-17.
[10]杨云,刘福勤,冯卫生,等.碱法提取大枣渣多糖及活性炭脱色的工艺研究[J].食品与发酵工业,2004,30(7):30-32.
[11]吕国英,张作法,潘慧娟,等.响应面分析法优化香菇多糖发酵培养基[J].菌物学报,2010,29(1):106-112.
[12]孙萍萍,王颉,孙剑锋,等.响应面法对缢蛏粗多糖提取工艺的优化[J].水产科学,2010,29(4):203-207.
[13]Muralidhar R V,Chirumamila R R,Marchant R,et al.A response surface approach for the comparison of lipase production by Candida cylindracea using two different carbon sources[J].Biochemical Engineering Journal,2001,9(1):17-23.

