玉米叶水浸提液对不同产地黄芩种子的化感效应
彭晓邦,张硕新
(1.商洛学院生物医药工程系,陕西 商洛 726000; 2.中国中医研究院商洛中药材GAP科研工程中心,陕西 商洛 726000; 3.西北农林科技大学林学院,陕西 杨凌 712100)
玉米叶水浸提液对不同产地黄芩种子的化感效应
彭晓邦1,2,张硕新3
(1.商洛学院生物医药工程系,陕西 商洛 726000; 2.中国中医研究院商洛中药材GAP科研工程中心,陕西 商洛 726000; 3.西北农林科技大学林学院,陕西 杨凌 712100)
以不同产地的黄芩(Scutellariabaicalensis)种子为材料,研究了不同质量浓度(0、0.005、0.010、0.020、0.030和0.040 g·mL-1)玉米(Zeamays)叶浸提液对黄芩种子萌发和幼苗生长的影响。结果表明,低质量浓度(0.005、0.010、0.020 g·mL-1)的玉米叶水浸提液对不同产地黄芩种子的萌发有明显的化感促进作用;随着水浸提液质量浓度的提高,其对受体的促进作用逐渐减弱、消失,甚至表现为抑制作用。在试验质量浓度范围内,玉米叶水浸提液对黄芩种子的幼苗根长、苗高、相对电导率、可溶性糖含量及可溶性蛋白含量均表现为促进作用,最佳质量浓度为0.020 g·mL-1。玉米叶水浸提液可以在某种程度上促进黄芩种子的萌发和幼苗的生长。
玉米;水浸提液;黄芩;化感效应
黄芩(Scutellariabaicalensis)是唇形科植物,具有清热燥湿、泻火解毒的作用[1-2],可用于胸闷呕恶、湿热痞满、泻痢、黄疸、肺热咳嗽、高热烦咳、痈肿疮毒、胎动不安等症的治疗。黄芩不仅常被用于中医临床调剂和中成药的生产,而且还被用作提取黄芩苷等黄酮化合物的原料,是我国常用大宗中药材,也是商洛地区的主要经济作物。在实际生产中,把玉米(Zeamays)和黄芩进行粮药复合经营既可缓解黄芩的连作障碍,又是解决土地资源紧缺、提高土地利用效率、促进商洛经济发展的有效途径之一。
化感作用是指植物可以产生一些特殊的生化物质并释放到环境中,对其他植物或自身产生直接或间接的相生或相克的作用[3-4]。化感作用存在于许多植物中,并通过残体分解、挥发和根系分泌等不同机理释放到根际。化感物质能影响植物的萌芽、生长、繁殖和分布,其抑制植物生长的程度取决于化感物质的产率、存留时间及化合物种类[4]。化感作用的研究有利于粮药复合系统中物种的配置、耕作制度和栽培措施的优化,控制农田病虫害,以保持生物多样性和农业可持续发展。本研究以商洛地区主要农作物玉米为供体,对其水溶物在不同产地黄芩种子萌发和幼苗生长方面的作用进行了初步研究,为合理利用玉米的化感作用进行粮药复合生态系统的管理、作物的合理间作套种提供一定的科学依据。
1 材料与方法
1.1材料 供体材料为商洛地区主栽玉米品种沈单10号的叶子,采自吐丝期。受体种子为不同产地(陕西商州、陕西蓝田、山东淄博、四川成都和甘肃陇县)的黄芩种子,于2010年购于陕西天士力植物药业有限公司。
1.2方法
1.2.1玉米叶水浸提液的制备 取风干的玉米叶片,用剪刀剪成1~2 cm长的小段,按每20 g 500 mL水的比例,用蒸馏水2 000 mL浸泡80 g 剪碎的叶片,在振荡器上振荡48 h(25 ℃),过滤后即得质量浓度为0.040 g·mL-1的玉米叶水浸提液,放入4 ℃冰箱中待用。
1.2.2化感作用的生物活性测定 将提取的玉米叶水浸提液稀释至所需浓度,试验共设0、0.005、 0.010、0.020、0.030和0.040 g·mL-16个处理,其中0为加蒸馏水的对照。选取籽粒饱满、不同产地的黄芩种子,先用0.1% HgCl2消毒10 min,再用蒸馏水冲洗数次,晾干后分别均匀排列在发芽床上(∅10 cm的培养皿,内铺2层湿滤纸),每个培养皿里摆100粒种子,摆好后用移液枪分别加入1 mL水浸提液和蒸馏水到不同处理的各培养皿中,然后放入人工智能培养箱中在25 ℃恒温、光照4 000 lx(12 h)下进行培养,每个处理重复3次。播种后48 h开始统计萌发情况(胚根或胚轴突破种皮1~2 mm时为萌发)。每隔24 h统计萌发一次,并及时补充等量蒸馏水,使滤纸始终保持湿润。第4天开始统计发芽势(Germination Energy,GE),第10天开始统计发芽率(Germination Percentage,GP),发芽试验共持续14 d[5]。统计完发芽率后再挑选前3次统计过的萌发良好的黄芩种子放于铁纱网上,铁纱网置于盛满自来水的塑料箱上,紧贴水面,采用自来水水培法,使其生长7 d,每个处理随机选取50个黄芩幼苗,然后测定幼苗根长(Root Length,RL)和幼苗苗高(Shoot Height,SH)。分别计算对照和不同处理黄芩种子的发芽指数(Germination Index,GI)。
1.2.3化感指标测定方法


式中,Gt为在第t天黄芩种子的发芽数,Dt为相应的发芽天数。
化感效应数据统计分析方法参照Williamson[5]的方法。即:
当T≥C时,RI=1-C/T;
当Tlt;C时,RI=T/C-1。
式中,C为对照值,T为处理值。RI为化感效应指数。当RIgt;0时,表现为促进作用,当RIlt;0时,表现为抑制作用[6]。
1.2.4种子浸出液电导率(Relative Electric Conductivity,REC)测定 将用不同质量浓度玉米叶水浸提液浸种处理后的黄芩种子捞出,用清水反复冲洗次数,每个处理选取籽粒饱满的黄芩种子各10粒,加6 mL无离子水室温下浸泡12 h(以充分吸胀为准),然后用DDS-IIA型电导仪测定黄芩种子浸出液的电导率(A1),再将测定完的黄芩种子和浸出液在沸水浴中煮15 min,冷却至25 ℃时测定其绝对电导率(A2),相对电导率就是A1与A2的比值[6]。
1.2.5种子可溶性蛋白和可溶性糖含量测定 可溶性蛋白(Soluble Protein,SP)含量采用考马斯亮蓝G-250染色法[8]进行测定;可溶性糖(Soluble Sugar,SS)含量采用蒽酮-硫酸法[9]测定。
1.3数据处理 所得数据用SPSS和Excel 软件进行方差分析和显著性检验。
2 结果与分析
2.1不同质量浓度玉米叶水浸提液对不同产地黄芩种子发芽率的影响 低质量浓度玉米叶水浸提液对商州黄芩、蓝田黄芩、淄博黄芩、成都黄芩和陇县黄芩种子的发芽率均表现出一定的促进作用,当玉米叶水浸提液质量浓度达到0.02 g·mL-1时,商州黄芩、蓝田黄芩和陇县黄芩种子的发芽率最高,其化感效应指数分别为0.051 8、0.094 0和0.059 7;而淄博和成都黄芩种子发芽率的最高值均出现在玉米叶水浸提液质量浓度为0.01 g·mL-1时,其化感效应指数分别为0.054 4和0.033 6(表1)。随着玉米叶水浸提液浓度的逐渐提高,其对不同产地黄芩种子的发芽率则表现出一定的抑制作用。商州黄芩、蓝田黄芩、淄博黄芩、成都黄芩和陇县黄芩种子的发芽率均相应降低,且最低发芽率均出现在玉米叶水浸提液质量浓度为0.04 g·mL-1时,其化感效应指数分别为-0.045 0、-0.053 5、-0.072 8、-0.063 8和-0.034 9。由此可见,低质量浓度玉米叶水浸提液对5种供试黄芩种子的发芽率均表现出一定的促进作用,而高质量浓度玉米叶水浸提液对不同产地黄芩种子的发芽率则表现出一定的抑制作用。
2.2不同质量浓度玉米叶水浸提液对不同产地黄芩种子发芽势的影响 与发芽率相比,不同质量浓度玉米叶水浸提液对不同产地黄芩种子发芽势的影响更为明显(表2)。低质量浓度玉米叶水浸提液对不同产地黄芩种子的发芽势均表现出一定的促进作用,当玉米叶水浸提液质量浓度达到0.01

表1 不同质量浓度玉米叶水浸提液对不同产地黄芩种子发芽率的影响Table 1 Effects of different concentrations aqueous extract of Zea mays leaf on the seed germination rateof Scutellaria baicalensis of different regions %
注:同列标有不同小写字母表示不同质量浓度玉米叶水浸提液处理间差异显著(Plt;0.05)。下表同。
Note: Different lower case letters within the same column indicate significant difference at 0.05 level. The same below.

表2 不同质量浓度玉米叶水浸提液对不同产地黄芩种子发芽势的影响Table 2 Effects of different concentrations aqueous extract of Zea mays leaf on seed germination potentialof Scutellaria baicalensis of different regions %
g·mL-1时,蓝田黄芩、淄博黄芩、成都黄芩和陇县黄芩种子的发芽势均达到最大值,其化感效应指数分别为0.103 0、0.123 7、0.069 9和0.140 5。而商州黄芩种子发芽势的最大值出现在玉米叶水浸提液质量浓度为0.02 g·mL-1时,其化感效应指数为0.104 5。随着玉米叶水浸提液质量浓度的进一步提高,不同产地黄芩种子的发芽势逐渐降低,较高质量浓度的玉米叶水浸提液对不同产地黄芩种子发芽势表现出明显的抑制作用。5种供试的黄芩种子发芽势的最低值均出现在玉米叶水浸提液质量浓度为0.040 g·mL-1时,其化感效应指数分别为-0.046 7、-0.135 9、-0.153 4、-0.136 3和-0.086 5。
2.3不同质量浓度玉米叶水浸提液对不同产地黄芩种子发芽指数的影响 不同质量浓度玉米叶水浸提液对不同产地黄芩种子发芽指数影响的变化规律与其发芽率和发芽势的变化规律相似,均表现出“低质量浓度促进,高质量浓度抑制”的变化规律(表3)。除蓝田黄芩种子发芽指数的最大值出现在玉米叶水浸提液质量浓度为0.010 g·mL-1时外,其他产地黄芩种子发芽指数的最大值均出现在玉米叶水浸提液质量浓度为0.020 g·mL-1时,且各产地黄芩种子发芽指数的最低值均出现在玉米0.040 g·mL-1时。由此可见,低质量浓度玉米叶水浸提液对5种供试黄芩种子的萌发有一定的促进 作用,而较高质量浓度玉米叶水浸提液对不同产地黄芩种子的萌发有一定的抑制作用。

表3 不同质量浓度玉米叶水浸提液对不同产地黄芩种子发芽指数的影响Table 3 Effects of different concentrations aqueous extract of Zea mays leaf on seed germination indexof Scutellaria baicalensis of different regions %
2.4不同质量浓度玉米叶水浸提液对不同产地黄芩种子幼苗生长的影响 不同质量浓度玉米叶水浸提液对5种不同产地黄芩幼苗生长均有显著影响。在低质量浓度玉米叶水浸提液处理下,大部分黄芩幼苗根长大于对照(图1),所以低质量浓度玉米叶水浸提液促进了不同产地黄芩幼苗根的发育。但当水浸提液质量浓度达到0.020 g·mL-1时,所有黄芩幼苗根长均小于对照,且随着水浸提液质量浓度的逐渐提升不同产地黄芩幼苗根长减小愈发明显,方差分析表明,各处理中不同产地幼苗根长间存在显著差异(Plt;0.05),这表明高质量浓度玉米叶水浸提液对黄芩幼苗根的生长有抑制作用。
不同质量浓度玉米叶水浸提液对不同产地黄芩幼苗苗高的影响与其对根长的影响变化相似(图 2),在水浸提液质量浓度为0.010~0.020 g·mL-1时,大部分受体作物苗高大于对照,但当玉米叶水浸提液质量浓度大于0.020 g·mL-1时,所有黄芩幼苗苗高均开始减小。方差分析表明,各处理中不同产地黄芩幼苗苗高间存在显著差异(Plt;0.05)。此外,试验观察还发现玉米叶水浸提液对黄芩根生长的抑制不仅表现在根长上,与对照相比较,不同质量浓度处理黄芩的根还表现出卷曲、颜色变深暗等抑制现象,这表明玉米叶水浸提液中的化感物质对黄芩根的抑制作用比茎强烈[10]。

图1 不同浓度玉米叶水浸提液对不同产地黄芩种子幼苗根长的影响Fig.1 Effects of different concentrations aqueous extract of Zea mays leaf on seedling roots length ofScutellaria baicalensis of different regions
注:不同字母表示同一产地黄芩种子在不同水浸提液浓度间差异显著(Plt;0.05)。下图同。
Note:Different lower case letters indicate significant difference between different concentration ofZeamaysleaf aqueous extract within the same Scutellaria baicalensis region at 0.05 level.The same below.

图2 不同质量浓度玉米叶水浸提液对不同产地黄芩种子苗高的影响Fig.2 Effects of different concentrations aqueous extract of Zea mays leaf on seedling heightof Scutellaria baicalensis of different regions
2.5不同质量浓度玉米叶水浸提液对不同产地黄芩种子相对电导率的影响 电导率的大小能直接反映种子质膜受伤害的程度。低质量浓度玉米叶水浸提液处理不同产地黄芩种子的相对电导率与对照相比差异不显著(表4),这意味着不同质量浓度玉米叶水浸提液处理对5种供试黄芩种子质膜的损伤相对比较小。
2.6不同质量浓度玉米叶水浸提液对不同产地黄芩种子可溶性蛋白含量和可溶性糖含量的影响 可溶性蛋白为种子萌发和幼苗生长提供氮素营养,对种子萌发与胚的生长有着极其重要的 作用;同时与种子活力的形成和保持有着密切的关系[11]。低质量浓度玉米叶水浸提液处理不同产地黄芩种子的可溶性蛋白含量均明显高于对照,而高质量浓度玉米叶水浸提液处理黄芩种子的可溶性蛋白含量明显低于对照(表5)。这表明低浓度玉米叶水浸提液处理能够促进黄芩种子体内淀粉和贮藏蛋白的转化,以适应胁迫环境,减少对自身造成的伤害,为种子萌发和幼苗生长提供能量和物质基础。

表4 不同质量浓度玉米叶水浸提液对不同产地黄芩种子相对电导率的影响Table 4 Effects of different concentrations aqueous extract of Zea mays leaf on relative conductivity ofScutellaria baicalensis of different regions %
可溶性糖不仅是高等植物光合作用的主要产物,而且在有机物的代谢中起着十分重要的作用。可溶性糖含量的增加可以提高植物细胞渗透调节能力,降低质膜受伤害的程度[12]。低质量浓度玉米叶水浸提液处理黄芩种子可溶性糖含量均显著高于对照,说明低质量浓度玉米叶水浸提液处理能够促进不同产地黄芩种子萌发和生长(表6)。

表5 不同质量浓度玉米叶水浸提液对不同产地黄芩种子可溶性蛋白含量的影响Table 5 Effects of different concentrations aqueous extract of Zea mays leaf on seed soluble proteins concentration ofScutellaria baicalensis of different regions mg·g-1
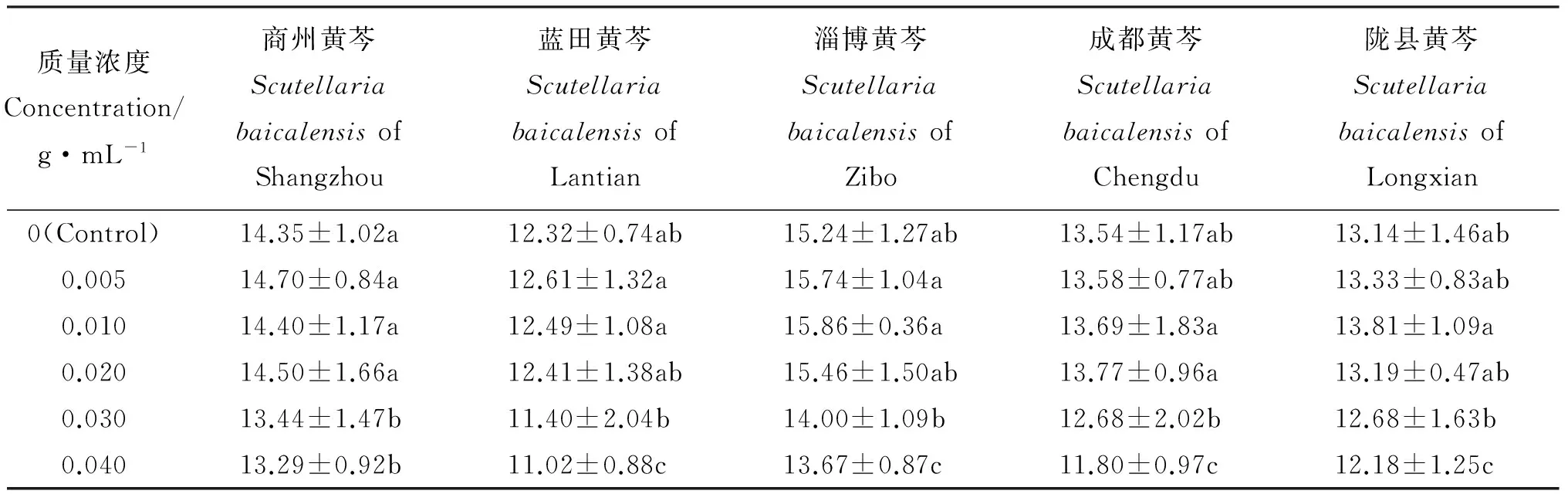
表6 不同质量浓度玉米叶水浸提液对不同产地黄芩种子可溶性糖含量的影响Table 6 Effects of different concentrations aqueous extract of Zea mays leaf on seed soluble sugar content ofScutellaria baicalensis of different regions %
3 讨论与结论
利用水浸提法研究作物的化感作用已有很多报道[13-16],本研究表明,玉米叶淋洗释放的化感物质对商州黄芩、蓝田黄芩、淄博黄芩、成都黄芩和陇县黄芩种子的萌发率、根长和苗高的影响基本上均表现为低质量浓度促进高质量浓度抑制的双重效应。说明玉米叶水浸提液中含有某些亲水性的化感物质,可影响受体植物种子的萌发和幼苗期的生长,它们对细胞膜有一定的损伤[17]。此外,在种子萌发试验中,发现不同质量浓度玉米叶水浸提液对不同产地黄芩幼苗不同部位有不同的化感效应,比如根长的影响比苗高更为敏感,这与之前做的核桃(Juglansregia)叶水浸液对黄芩化感效应研究结果一致[5]。董沁方和程智慧[18]对百合(Liliumlophophorum)水浸提液的化感效应研究分析认为,在百合水浸提液的处理下,受体植物的幼根比幼苗表现敏感,可能是由于试验条件下水分充足,根的伸长生长受到适度的抑制而长的粗壮,从而促进幼苗的生长或者改变物质在苗和根之间的分配。尽管本研究也发现类似的现象,但玉米叶水浸提液对黄芩幼苗化感效应的内在机理还有待进一步研究。
化感作用是植株通过淋溶、残体分解、根系分泌向环境中释放化学物质,从而对自身或其他作物产生间接或直接的有利或有害的作用。这类化学物质是以酚类、脂肪酸类为主的高分子化合物,以酯键形态存在于土壤-植物体系中[19]。化感物质的浓度效应是化感作用的一个重要研究内容。大量研究表明,植物化感作用对受体作物的影响因浓度而异,具有明显的浓度效应[20-22],即化感作用强度随化感物质浓度的增大而增加。本研究结果也证实了这一点,试验发现5种黄芩种子的发芽率、发芽势、发芽指数及幼苗苗高和根长的抑制作用均随水浸提液质量浓度的提升而增强。但同一作物不同时期对不同浓度的化感分泌物产生的影响往往不同,所以玉米叶水浸提液对不同产地黄芩其他发育时期的化感作用还有待于进一步研究。
本研究还发现,在试验质量浓度范围内,不同质量浓度玉米叶水浸提液处理黄芩种子的相对电导率与对照相比基本上有一定程度的增加,说明玉米叶水浸提液处理对不同产地黄芩种子质膜有一定的损伤,这与笔者等[23]对桔梗(Platycodongrandiflorus)的化感作用研究结果一致。本研究中,中低质量浓度玉米叶水浸提液处理黄芩种子的可溶性糖含量和可溶性蛋白含量均高于对照,有报道认为逆境条件下可溶性糖含量的增加,不仅是由于可溶性糖参与细胞的渗透调节作用,更重要的是许多可溶性碳水化合物是植物适应环境的信号物质[24],可以调控植物的防御性反应[25]。另外,逆境条件下植物的一些蛋白表达量发生变化,而另一些特异蛋白被诱导[26-27],蛋白质含量取决于两者的变化情况。在中低质量浓度下玉米叶水浸提液处理增加了不同产地黄芩的可溶性蛋白含量,表明在化感物质胁迫下,植株可能产生一些特异蛋白以抵抗外界的不利影响,这与李坤等[28]对葡萄(Eriobotryajaponica)的研究结果一致。但本研究是采用室内模拟试验,通过外施化感物质来研究黄芩的化感作用,而在田间情况下,玉米的实际作用浓度以及其与黄芩之间的交互作用还需进一步深入研究。
[1] 徐国钧,何宏贤,徐珞珊,等.中国药材学[M].北京:中国医药科技出版社,1996:398.
[2] 龚子端,李高阳.PEG干旱胁迫对植物的影响[J].河南林业科技,2006,26(3):21-23.
[3] Chou C H.The role of allelopathy in phytochemical ecology[A].In:Chou C H,Waller G R.Phytochemical Ecology:Allelochemicals,Mycotoxins and Insect Pheromones and Allomones[M].Taipei:Institute of Botany,1989:19-38.
[4] Rice E L.Allelopathy[M].New York:Academic Press,1974:1-50.
[5] 彭晓邦,程飞,张硕新.核桃叶水浸液对不同产地黄芩的化感效应[J].草地学报,2011,19(5):839-845.
[6] Williamson G B.Bioassays for allelopathy:Measuring treatment responses with independent controls[J].Journal of Chemical Ecology,1988,14(1):181-187.
[7] 宋松泉,程红焱.种子生物学研究指南[M].北京:北京农业大学出版社,2004:92-94.
[8] Read M S,Northcote D H.Minimization of variation in the response to different protein of the coomassic blue G dyedinding:Assay for protein[J].Analytical Biochemistry,1981,116:53-64.
[9] 白宝璋,靳占忠,李存东.植物生理学实验教程(下)[M].北京:中国农业科技出版社,2001:61-62.
[10] 韦琦,曾任森,孔垂华,等.胜红蓟地上部化感作用物的分离与鉴定[J].植物生态学报,1997,21(4):360-366.
[11] 陈娟,雷霁,王磊,等.4种化学试剂浸种对桔梗种子萌发及幼苗生长的影响[J].西北农业学报,2010,19(4):100-105.
[12] 孔广红,岳海,陈丽兰,等.低温胁迫下澳洲坚果幼苗的某些生理生化特征[J].西南农业学报,2010,23(2):375-378.
[13] 田梅,侯扶江.3种植物枯落物水提液对达乌里胡枝子幼苗生长的作用[J].草业科学,2009,26(1):45-49.
[14] 尹亚丽,李红旭,王俊,等.杂草对紫花苜蓿的化感作用[J].草业科学,2009,26(12):131-135.
[15] 高承芳,翁伯琦,王义祥,等.铝、镁离子胁迫下决明对百喜草的化感作用[J]. 草业学报,2009,18(5):40-45.
[16] 高兴祥,李美,高宗军,等.外来物种小飞蓬的化感作用初步研究[J].草业学报,2009,18(5):46-51.
[17] 于风兰,孔令韶,马茂华.油蒿(Artemisiaordosica)的化感作用研究[J].生态学报,1999,19(5):670-676.
[18] 董沁方,程智慧.百合地上部分水浸液的化感效应研究[J].西北农业学报,2006,15(2):144-147.
[19] 孔垂华,胡飞.植物化感(相生相克)作用及其应用[M].北京:中国农业出版社,2001:161-163.
[20] 孔垂华,徐涛,胡飞.胜红蓟化感作用研究及主要化感物质的释放途径和活性[J].应用生态学报,1998,9(3):257-260.
[21] 曾任森,骆世明,石木标,等.彩色马勃豆子实体的化感作用及其化感物质的分离鉴定[J].应用生态学报,1999,10(2):206-208.
[22] 韩丽梅,沈其荣,鞠会艳,等.大豆地上部水浸液的化感作用及化感物质的鉴定[J].生态学报,2002,22(9):1425-1430.
[23] 彭晓邦,程飞,张硕新.玉米叶水浸液对不同产地桔梗种子的化感效应[J].西北林学院学报,2011,26(6):129-134.
[24] 王静,杨德光,马凤鸣,等.水分胁迫对叶片可溶性糖和脯氨酸含量的影响[J].科学,2007,15(6):57-59.
[25] Yoshida S,Ito M,Nishida I,etal.Identification of a novel gene HYS1 /CPR5 that has a repressive role in the induction of leaf senescence and pathogen-defense responses inArabidopsisthaliana[J].The Plant Journal,2002,29:427-437.
[26] Shen S H,Jing Y X,Kuang T Y.Proteomics approach to identify wound-response related proteins from rice leaf sheath[J].Proteomics,2003,3:527-535.
[27] Renaut J,Lutts S,Hoffmann L,etal.Responses of poplar to chilling temperatures:Proteomic and physio-logical aspects[J].Plant Biology,2004,6:81- 90.
[28] 李坤,郭修武,郭印山,等.葡萄根系浸提液的化感作用[J].应用生态学报,2010,21(7):1779-1784.
AllelopathyeffectsofaqueousextractofmaizeleafonScutellariabaicalensisseeds
PENG Xiao-bang1,2, ZHANG Shuo-xin3
(1.Department of Biological and Medical Engineering, Shangluo College, Shangluo 726000, China;2.Shangluo GAP Research Engineering Center of Chinese Traditional Medicine Academy, Shangluo 726000, China;3.College of Forestry, Northwest Aamp;F University, Yangling 712100, China)
This study examined allelopathy effects of aqueous extract of maize (Zeamays) leaf on seed germination and seedling growth ofScutellariabaicalensisobtained from different regions and treated with different concentrations (0,0.005,0.010,0.020,0.030, and 0.040 g·mL-1) of the aqueous extract. The results showed that low concentrations (0.005,0.010 and 0.020 g·mL-1) of maize leaf aqueous extract stimulated the seed germination rate ofS.baicalensissignificantly. With the concentration of the aqueous extract increasing, the seed germination rates of all the receptors decreased gradually and were inhibited when the aqueous extract concentration reacheed a certain level. The results also indicated that maize leaf aqueous extract enhanced the root length, shoot height, relative electricity conductivity, content of soluble protein and content of soluble sugar of receptor plants. TheS.baicalensisseeds treated with 0.020 g·mL-1concentration of maize leaf aqueous extract gave stronger promoting allelopathy than that of other concentration. Maize leaf aqueous extract can promote seed germination and seedling growth ofS.baicalensis.
Zeamays; aqueous extract;Scutellariabaicalensis; allelopathy
PENG Xiao-bang E-mail:xbpeng1898@yaho.com.cn
S513.01;Q945.7
A
1001-0629(2012)02-0255-08
2011-04-11 接受日期:2011-07-07
陕西省自然科学基金项目(2010JQ3007);商洛市政府科技计划项目(09skj001);商洛学院博士启动基金项目(09sky024);商洛学院自然科学基金项目(11SKY-FWDF005)
彭晓邦(1980-),男,陕西西安人,博士,主要从事植物生理生态方面的研究。E-mail:xbpeng1898@yahoo.com.cn

