恒河猴睾丸支持细胞对间质细胞分泌睾酮的研究
王训立 谢金东 周建华
睾丸组织中除了生精细胞外,还有两种重要的细胞即支持细胞(sertoli cells)和间质细胞(leydig cells)[1]。支持细胞主要功能是维持睾丸曲细精管的结构、维持血睾屏障的完整性、维护睾丸组织天然免疫豁免,对生精细胞及间质细胞的营养支持作用,可调控间质细胞的生理功能,而间质细胞的主要功能是合成和分泌雄激素。因此,间质细胞和支持细胞是睾丸组织构建的种子细胞。
在生命科学和医学研究领域,非人灵长类动物作为高等级的实验动物模型受到人们重视,而恒河猴作为一种实验动物得到了广泛的应用。近年来,虽然我们进行了恒河猴睾丸内激素调控的离体研究,但对于支持细胞对间质细胞分泌睾酮的作用机制还不甚了解[2]。本研究通体外无血清培养的方法,开展了支持细胞对间质细胞分泌睾酮的研究,对于进一步了解非人灵长类动物睾丸支持细胞对间质细胞分泌睾酮的调节机制,具有重要的理论价值。
材料与方法
1.试剂:McCoy's 5a培养基购于Gibco公司;牛血清白蛋白(BSA)、人卵泡刺激素(human follicle stimulating hormone,hFSH)、内皮素 -1(endothelin-1,ET -1)、促性腺激素释放激素(gonadotropin releasing hormone,GnRH)、cAMP、表皮生长因子(epidermal growth factor,EGF)、白细胞介素 -1(interleukin-1,IL-1)购自Sigma公司;睾酮放射免疫测定药盒为上海原子核研究所的产品。
2.实验动物:恒河猴由福建省人口和计划生育科学技术研究所提供,实验动物生产许可证号:SCXK(闽)2005-0002,SYXK(闽)2005-0015,单笼饲养,经检验符合普通级实验动物标准。
3.支持细胞和间质细胞的分离:(1)支持细胞分离:将取得的睾丸组织在无菌条件用培养液冲洗数次,在玻璃平皿中将睾丸外周的脂肪和结缔组织等去除,剥除白膜,分离出睾丸实质,将其拉松、剪碎,用0.1%BSA-Hepes溶液混合剪碎的睾丸组织,加入胶原酶(Ⅱ),在37℃消化45min。在尼龙滤网上过滤,离心(1000r/min,5~8min)收集细胞。经BSA密度梯度重力沉降分离细胞,得到的支持细胞(sertoli cells)用培养液离心冲洗3次。取20μl细胞悬液加20μl Trypan bule染色。用血球计数板确定成活细胞数目,此时得到的支持细胞纯度达95%以上。(2)间质细胞分离:将取得的睾丸组织用培养液冲洗数次,在玻璃平皿中将睾丸外周的脂肪和结缔组织等去除,剥除白膜,分离出睾丸实质,将其拉松、剪碎,用0.1%BSA-Hepes溶液混合剪碎的睾丸组织,加入胶原酶(Ⅱ),在37℃消化45min。在尼龙滤网上过滤,离心(1000r/min,5~8min)收集细胞。经BSA密度梯度重力沉降分离细胞,得到的间质细胞(leydig cells)用培液离心冲洗3次。取20μl细胞悬液加20μl Trypan bule染色。用血球计数板确定成活细胞数目,此时得到的间质细胞纯度达95%以上。
4.支持细胞和间质细胞的培养:细胞培养液由McCoy's 5a培养基配制。分离获得的间质细胞按每个1ml培养液含105个细胞接种到直径35mm的培养皿中,同时接种支持细胞,支持细胞按每个1ml培养液含 0、5 ×103、104、2 ×104、5 ×104、105个细胞分别接种。两种共培养的细胞在5%CO2、95%空气和37℃的条件下培养。每24h更换培养液1次,换液之前在倒置相差显微镜下检查细胞贴壁和细胞形态。第1次换液时用培养液洗两次以去除细胞碎片和内源激素。
在研究外源因子对共培养细胞的影响时,随机分组后,根据不同的实验组分别加入 GnRH(10-7mol/L),FSH(100ng/ml),EGF(10-7mol/L),ET - 1(10-5mol/L)和 IL - 1(10-5mol/L)连续培养72 h,每天采集培养液并更换新鲜培养液,收集培养液,煮沸15min,冻存于-20℃待测定。同样实验重复3次。
5.睾酮的测定:培养液中的睾酮含量采用放射免疫测定法测定。培养液中睾酮不需提取直接测定,睾酮抗体稀释度为1∶(5 ×105),灵敏度为 4 ~7pg,批内误差 2.8%,批间误差3.5%。
6.统计学方法:每次实验重复3次(SPSS 13.0),实验数据经t检验,以p<0.05为差异有统计学意义。
结 果
1.促性腺激素释放激素(GnRH)对睾酮分泌水平的影响:在体外连续培养3天后,在GnRH(10-7mol/L)作用下,恒河猴睾丸间质细胞睾酮的分泌水平与共培养的支持细胞数量有明显的线性关系,并出现增加支持细胞共培养的数量,睾酮的分泌量就增多的趋势,结果如图1所示。
2.卵泡刺激素(FSH)对睾酮分泌水平的影响:体外共培养的恒河猴睾丸细胞,在连续培养3天后,加入卵泡刺激素(100ng/ml),对睾酮分泌水平的影响,分离后的间质细胞与支持细胞共培养,在FSH作用下,产生睾酮分泌水平,与共培养的支持细胞的数量有明显关系,以含有105个共培养的支持细胞组别最为显著。结果如图2所示。
3.表皮生长因子(EGF)对睾酮分泌水平的影响:结果表明在EGF(10-7mol/L)存在下,明显促进了共培养的恒河猴睾丸细胞分泌睾酮水平,且上升的程度与支持细胞数量相关。结果如图3所示。
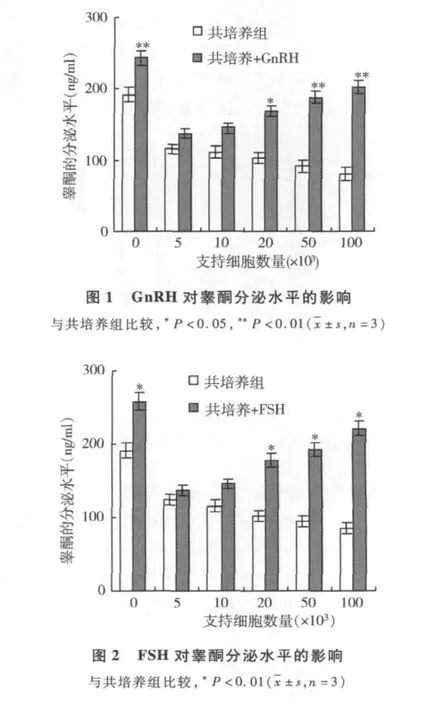

图3 EGF对睾酮分泌水平的影响
4.内皮素-1(ET-1)对睾酮分泌水平的影响:体外共培养的恒河猴睾丸细胞,经cAMP(10-5mol/L)处理24h后,加入 ET-1(10-5mol/L)继续培养48h,结果发现ET-1对睾酮的分泌也有明显的刺激作用,出现睾酮的分泌量随着共培养的支持细胞的数量增加,有显著的上升。结果如图4所示。
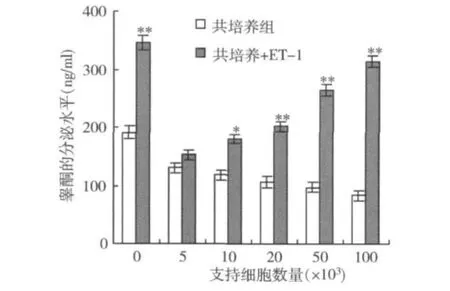
图4 ET-1对睾酮分泌水平的影响
5.白细胞介素-1(IL-1)对睾酮分泌水平的影响:IL-1(10-5mol/L)对共培养的恒河猴睾丸细胞睾酮的分泌,没有产生明显的刺激反应,随着共培养的支持细胞的数量增加,培养液中睾酮的分泌水平未出现显著的增加趋势。结果如图5所示。
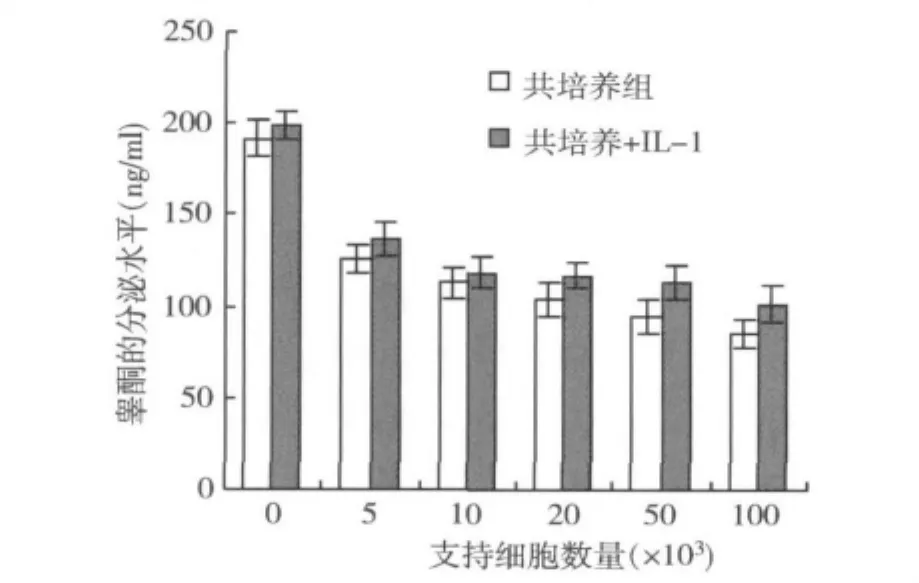
图5 IL-1对睾酮分泌水平的影响
讨 论
睾丸组织的支持细胞对生殖细胞具有支持和营养作用,构成血睾屏障、形成睾丸内微环境、调节精子的发生、吞噬细胞残体、产生类固醇类物质及分泌细胞因子以调节生殖功能,对生殖细胞的形成起关键作用[3]。此外,支持细胞还有重要的免疫豁免作用。而睾丸组织的间质细胞,分布于生精小管之间的疏松结缔组织中,是睾丸间质内最主要的细胞。非人灵长类动物—恒河猴睾丸间质细胞是雄激素的主要来源,雄激素的产生受促黄体素(LH)调节,其合成和分泌的雄激素主要是睾酮[4]。
恒河猴睾丸组织中,类黄体生成素释放激素的主要来源支持细胞,间质细胞上有类黄体生成素释放激素受体,通过类黄体生成素释放激素与受体的结合,改变间质细胞的通透性,进而调节间质细胞睾酮的分泌功能[5]。由于支持细胞上有FSH的受体,间质细胞有LH的受体,所以卵泡刺激素是通过对支持细胞的调节来增强间质细胞分泌睾酮[6]。本研究表明,GnRH、FSH都能够明显增加恒河猴支持细胞与间质细胞共同培养细胞中,间质细胞的睾酮分泌水平。
恒河猴支持细胞可分泌多种细胞因子,如转化生长因子(transforming growth factor,TGF)、表皮生长因子、胰岛素样生长因子(insulin like growth factor,IGF)、成纤维细胞生长因子等,这些因子可通过自分泌或旁分泌的方式调节间质细胞的功能[7]。EGF既能增加孕烯醇酮的合成,也能提高关键酶的活性来增加睾酮的合成。实验结果表明,在EGF存在下,对共培养恒河猴睾丸细胞睾酮生物合成有明显的促进作用,且睾酮分泌水平与恒河猴睾丸的支持细胞数量呈线性关系。
体外培养的支持细胞在卵泡刺激素和cAMP作用下能释放内皮素-1样免疫活性物质,而睾丸间质细胞含有高密度的内皮素-1受体,内皮素-1通过与靶细胞膜上的内皮素受体结合而发挥生物效应,因此,ET-1对睾丸间质细胞的生理功能具有调节作用[8]。实验证实了,在cAMP刺激下,恒河猴睾丸的支持细胞与间质细胞共培养,间质细胞产生睾酮量增加,提示恒河猴睾丸支持细胞通过提高间质细胞对LH的敏感性,促进了间质细胞的睾酮分泌水平。
在人和大鼠睾丸组织中具有活性IL-1物质,并且证明是由支持细胞释放的[9]。在睾丸中存在IL-1自分泌和旁分泌调节,从而影响睾丸间质细胞睾酮的生物合成。但是,关于IL-1对睾丸间质细胞的作用有不同的看法,而在非人灵长类动物睾丸组织的IL-1的作用并不十分清楚。IL-1α对睾丸间质细胞睾酮释放有促进效应,并呈剂量依赖关系[10];但也有人认为IL-1可以影响雄激素合成中的多个步骤,可能导致胆固醇侧链裂解酶P450sccmRNA的表达降低,从而导致间质细胞内雄激素的合成量减少[11]。本研究表明,IL-1对共培养的恒河猴睾丸细胞睾酮的分泌,不影响睾酮的基础合成,随着共培养的恒河猴睾丸支持细胞的数量增加,睾酮的分泌水平未出现显著的增加趋势。可见IL-1对恒河猴睾酮分泌的调节是比较复杂的,IL-1的细胞信号可能不是体内间质细胞功能或睾酮合成所必需的。
1 Grinspon RP,Rey RA.Anti- müllerian hormone and sertoli cell function in paediatric male hypogonadism[J].Hormone Research in Paediatrics,2010,73(2):81-92
2 王训立,庄临之,李荣皓,等.恒河猴睾丸内激素调控的离体研究Ⅰ—恒河猴睾丸Leydig细胞的离体培养及激素分泌的研究[J].中国实验动物学报,1998,6(1):56-60
3 O'Shaughnessy PJ,Morris ID,Huhtaniemi I,et al.Role of androgen and gonadotrophins in the development and function of the sertoli cells and leydig cells:data from mutant and genetically modified mice[J].Molecular and Cellular Endocrinology,2009,306(1):2-8
4 王训立,庄临之,李荣皓,等.恒河猴睾丸内激素调控的离体研究Ⅱ—恒河猴睾丸Sertoli细胞的离体培养及激素分泌的研究[J].中国实验动物学报,1998,6(1):48-53
5 Elletier G.Localization of androgen and estrogen receptors in rat and primate tissue[J].Histol Histopatho1,2000,15(4):1261 -1270
6 Willems A,Gendt KD,Allemeersch J,et al.Early effects of sertoli cell selective androgen receptor ablation on testicular gene expression[J].International Journal of Andrology,2010,33(3):505-517
7 Oatley JM,Brinster RL.Regulation of spermatogonial stem cell selfrenewal in mammals[J].Annual Review of Cell and Developmental Biology,2008,24:263-286
8 Jonsson CK,Setchell BP,Martinelle N.Endotoxin-induced interleukin 1 expression in testicular macrophages is accompanied by down regulation of the constitutive expression in sertoli cells[J].Cytokine,2001,14(5):283-288
9 Eman RM,Hofny MD,Mohamed E,et al.Semen parameters and hormonal profile in obese fertile and infertile males[J].Fertility and Sterility,2010,94(2):581-584
10 Combes AN,Wilhelm D,Davidson T,et al.Endothelial cell migration directs testis cord formation[J].Developmental Biology,2009,326(1):112-120
11 En H,Hardy MP,Zirkin BR.Age-related decreases in leydig cell testosterone production are not restored by exposure to LH in vitro[J].Endocrinology,2002,143(5):1637-1642

