器官移植体液免疫理论的100年历史回顾
Paul I Terasaki
翻译:周永昌
体液免疫理论强调抗体是移植排斥的主要原因。该理论的发展和确定伴随着历史上大量的无可争辩的证据。然而,像所有的历史一样,对证据的判定、阐述和结论无法避免主观的影响。这也是为什么接受体液免疫理论的人还在不断地探索并报道令人信服的证据和结论。
需要提醒的是,体液免疫理论的历史从未包括细胞方面的免疫反应。理由是不管细胞免疫多重要,其与体液免疫理论的发展关系并不紧密。移植物排斥是个复杂的过程,涉及诸多因素。笔者在这里强调抗体的作用是因为抗体极可能是引发其他连锁反应的关键因素,包括激发细胞免疫反应。8年前,笔者在综述体液免疫理论时曾呼吁坚持细胞免疫理论的人也能够写1篇细胞免疫理论的综述。如果大量的证据支持细胞免疫理论,该理论应该得到论证及确定。
另一个值得提醒的地方是,Medawar明确支持细胞免疫理论。很多人认为,支持体液免疫理论是对Medawar本人的抨击。50年前,笔者是Medawar的学生,为此深感荣幸。笔者至今仍认为,当初在Medawar实验室工作时获得的激励和鞭策对笔者整个事业的影响是巨大的。笔者相信,如果Medawar活在今日,他对细胞免疫的观点一定会有改变。
科学的进步不会一帆风顺,需要一步一步地前进,但每一步前进或每一个突破都是基于新观念或新技术的引进,每一步前进都是巨大的。例如,成千上万的论文和无数问题的解决基于的是聚合酶链反应(polymerase chain reaction,PCR)技术的引进,相比之下,器官移植体液免疫理论的发展基于很多小的前进步伐,历经100年的探索,其进展可分为3个阶段,每个阶段大约40~50年。1900年,Landsteiner发现了红细胞ABO系统,但该系统不是与器官移植相关的组织相容系统,所以器官移植体液免疫理论发展的第一步应该是1914年染料排除试验的建立,该检测方法可在体外鉴定细胞的存活或死亡,从而可鉴定出细胞毒抗体。第二步发生在50年后的微量淋巴毒检测方法的建立,该方法至今仍在应用,只是在配型方面,分子生物学方法已成为主要的检测手段。这个阶段经历了40年,直到几年前单一抗原微珠方法的建立,该技术通过重组细胞株获得纯化的抗原。人类白细胞抗原(human leucocyte antigen,HLA)系统的多态性表现在众多不同的抗原/抗体特异性。单一纯化抗原可确定单一抗体的特异性,从而使监测移植后抗体的出现,尤其是针对供者特异性抗体(donor specific antibody,DSA),成为可能。以下是对体液免疫理论发展三个历程的具体描述。
一、染料排除实验
Pappenheimer[1]首次报告锥虫蓝(Trypan Blue)排除实验,即被抗体和补体破坏的细胞被染为蓝色,而没有被染色的细胞为活细胞。目前检测抗体的技术仍参考这样相对简单的方法。1913年到1929年期间,肿瘤免疫方面的研究主要集中在提高机体对肿瘤的免疫力,为此锥虫蓝染色或曙红染色实验被普遍应用,以确定肿瘤细胞是否被抗体消灭[2]。
1929年,Woglom[3]综述了自1913年以来发表的有关移植肿瘤的600篇学术论文。例如,将大鼠肉瘤移植到豚鼠身上会导致豚鼠对大鼠肉瘤的免疫排斥,但大鼠的皮肤和血液同样具有免疫原性,由此提示,豚鼠产生的免疫性并非针对肉瘤,而是针对大鼠组织[4]。Ruo和Murphy[5]发现,来自鸡鲁斯肉瘤致敏的鹅血清,其表现的免疫性不同于对细胞的免疫性。后来发现,对肿瘤的作用实际上来自一种病毒,既鲁斯肉瘤病毒[5]。众多的类似研究,希望动物体内产生抗肿瘤抗体,但其结果使科研人员最终认识到,移植肿瘤确实可产生抗体,包括同源或非同源,但其免疫性并不是针对肿瘤本身。也就是说,机体排斥的不是肿瘤,而是移植物的组织,长期以来探索的肿瘤免疫实际上仅是对移植抗原的免疫。尽管结果令人沮丧,但可明确地证实抗体导致移植物排斥。
为了解决肿瘤特异性的问题,20世纪30和40年代,人们建立了小鼠的纯系株。Gorer和Schutze[6]通过纯系鼠发现了小鼠的H-2组织相容位点,针对A系小鼠的兔血清抗体不能与C57/bl小鼠发生反应,这是一项重大的突破。他们进一步证实,机体对肿瘤的反应受抗原类别的影响,而抗原类别可通过抗血清(血清抗体)得以确定。此后,Snell[7]通过移植肿瘤确定了小鼠的,由他起名的组织相容位点(H-2)。这一历史性的发现使他获得了诺贝尔奖。如果Gorer没有去世的话,非常可能他会分享这一殊荣。
自1950年,笔者开始研究针对移植的Brown-Pearce兔肿瘤细胞的同种异体抗体。1953年,Kalfayan和Kidd[8]发表了类似的研究结果。笔者觉得,他们的研究做得比笔者好。在证明移植抗原时,红细胞凝聚抗体很有帮助[9],细胞毒抗体也在Gorer和Amos[10]的淋巴瘤研究中得到描述。移植抗体的检测技术和方法受到了重视,有关这方面的论述来自3篇重要的文献,每篇间隔1年[11-13]。结论是红细胞凝聚试验实际上检测的是同一的抗体。Amos等[14]在皮肤移植的小鼠体内发现了抗体的存在。随后,皮肤移植的鸡体内发现有淋巴细胞凝聚素[15]以及皮肤移植的兔体内发现有细胞毒抗体[16]。此外,补体在免疫反应中的作用也受到了重视[17],然而问题仍然存在,即这些抗体是否在体内攻击移植物。
对这一问题最令人信服的答案可参考Stetson和Demopoulos[18]在等1958年发表的论文。他们证实,将同种异体抗体注射到小鼠体内,移植的皮肤颜色转为苍白。此后,笔者实验室的研究表明,将同种异体抗体注射到小鼠的肾动脉里可导致肾脏失去功能[19]。当时用的检测方法是摄取邻碘马尿酸钠,但由于当时技术上的原因,抗体注射后不能有效止血,一些注射正常血清的小鼠肾脏也出现功能受损。
1958年,在血库工作的Dausset[20]发现,接受多次输血的患者可产生抗白细胞抗体。Dausset作为第一个发现HLA而获得诺贝尔奖。此后,其他血库的科研人员陆续发现不同的HLA。荷兰的van Rood等[21]开始用白细胞凝聚实验确定HLA;美国斯坦福大学的Payne和Rolfs[22]开始研究妊娠血清,并发现妊娠血清中存在由胎儿刺激产生的HLA抗体,因胎儿的HLA与母亲的HLA不具相容性。
二、微量淋巴细胞毒检测
直至1964年,越来越多的研究机构开始研究人类组织相容性,由此促成了第一届国际组织相容研讨会。Bernard Amos出任大会主席,地点在美国的杜克[25]。大会的主要议题是哪种方法是检测HLA的最好方法。当时,白细胞凝聚试验最为普遍,在会上介绍了微量淋巴细胞毒实验方法。该方法只用1μl试剂和同样微量的淋巴细胞。为了更快,更精确地确定HLA抗原,并报告给国际组织相容研讨会,各实验室间开始了血清交换及比较。由于微量淋巴细胞毒方法可使1ml血清检测1000个标本或1000次试验,避免了大量血清的流失。1970至1984年间的国际组织相容研讨会报道了诸多新的抗原。
Ceppellini等[27]在1967年第3届国际组织相容研讨会上报道,所有观察到的抗原抗体反应均涉及到一个共同的遗传基因位点,该结论受到了高度的评价。1968年,世界卫生组织召开了第一次对新抗原的命名会议,命名这个基因位点为HLA。这个新位点的命名基于对抗体 (直接针对移植抗原的抗体)的认识。此种抗体来自于人与人之间的免疫反应,因此HLA抗原的发现直接源于体液免疫理论。
通过微量细胞毒检测方法,笔者报道了第1例抗体介导的肾移植急性排斥病例[28]。之后,Kissmeyer-Nielson等[29]根据白细胞凝聚实验方法报道了两例他们称为肾移植“超急排斥”的病例。因为当时交叉配型试验尚未开始应用,出现超急排斥的病例很多。笔者对初始报道的30例急性排斥进行了总结,发现24例(80﹪)患者交叉配型结果为阳性[30],Starzl等[31]和Williams等[32]随后将此种排斥归类于超急排斥。这些临床观察首次提出了令人信服的证据,即抗体可在移植后数分钟内将移植物排斥掉。
体液免疫的理论推断为:如果抗体导致移植物排斥,排斥发生后应该能检测到抗体。Morris等[33]在1968年首次报道了肾移植排斥前后存在抗体。当时,Morris往返于Richmond和笔者的实验室,研究肾移植排斥与抗体的关系。笔者发现,这些导致排斥的抗体为DSA[34]。Jeannet等[35]在1970年报道了同样的发现。
之后的证据进一步表明,术前存在抗体的肾移植患者可发生急性排斥,即排斥发生在移植后4个月内[36]。随后的40年,大量的临床数据反复验证了抗体与早期排斥的关系。目前,只要肾移植患者术前存在HLA抗体,就会被注明“高危险”。所有这些均基于细胞毒检测,但该方法正在逐渐被更敏感的流式细胞仪检测所取代[37]。例如,笔者在1987报道了52例细胞毒检测阴性,但流式细胞仪法阳性的肾移植患者,其中33﹪的患者其移植物在术后1个月内被排斥掉,而另外一组流式细胞仪检测阴性的患者,1个月内的移植失败率为8﹪[38]。以后的类似研究显示,148例流式细胞仪检测阳性的肾移植患者,1个月内的移植失败率为20﹪[39]。此外,即便患者的抗体在移植前呈弱阳性反应,对移植物的危害也是显著的。目前,DSA的检测意义已经获得了公认。通过检测患者DSA而排除抗原相对应的供者,再加上敏感的交叉配型试验,移植前被致敏和没有致敏的肾移植患者,其存活率相同,即便是再次移植,其存活率也与首次移植的存活率相同[40]。
通过非血清学方法确定移植物排斥抗体存在的早期方法是通过活检检测C4d。C4d染色阳性的患者,其存活率低于C4d阴性的患者[41],许多研究证实了类似的结果。但最近的一些研究表明,许多抗体介导的排斥病例,C4d检测结果为阴性[42]。尽管如此,C4d染色可证实抗体破坏肾脏毛细血管方面的作用。如果抗体导致移植失败,人们应该能够从排斥的肾脏上洗脱下抗体,以证实抗体确实存在。试验表明,从超级排斥的肾脏上可通过洗脱技术获得HLA抗体[43]。同样的结果也见于慢性排斥的肾脏。
体液免疫的新实验证据仍在陆续报道。例如,同种系的小鼠心脏移植,如果将导致超免疫(hyperimmunized)的血清注入给小鼠,可导致心脏血管的损伤,由此证明抗体在体内的作用[44]。另一项很有说服力的研究来自猕猴肾移植实验。首先,针对供者的抗体被发现,然后出现C4d沉积,继而发生肾小球损伤,最终导致移植失败[45]。通过这些研究,人们不难发现抗体的首先出现引发了随后的各种反应及病理变化。
随着抗体检测敏感性的提高,大量极具说服力的研究结果进一步证实了抗体与排斥的紧密关系。例如,1969年的相关报道指出,54﹪肾移植排斥的患者血清中可检测出抗体[33]。当抗体检测包括了HLA-DR位点后,72﹪的肾移植排斥患者被检测出抗体。随着检测技术的进一步提高,肾移植排斥患者的抗体阳性率达到了82﹪[46]。Harmer等[47]应用流式细胞仪检测法,发现95﹪的排斥患者存在抗体。在抗体检测的敏感性方面,抗人球蛋白增强型补体依赖细胞毒方法可达到与流式细胞仪法相同的敏感性。一项大标本量(826例排斥患者)的研究表明,96﹪的患者被检测出抗体[48]。抗体与排斥如此明确的强关联,提示抗体是引发排斥的元凶。
对抗体作用的主要异议是:抗体可能是排斥的结果,而非诱因。澄清这一因果关系需要确定抗体是否在排斥前已经存在,获得这样的证据存在难度。因需要对患者进行长期随访,并评估排斥前后的抗体状况,幸运的是一些移植中心储存了患者的血清,使回顾性研究抗体的作用成为可能。2004年,Lee等[49]首次报道了这方面的研究结果,他们的研究涉及到过去8年中29例均有血清检测历史记录的排斥患者,结果表明,发生排斥的所有患者,排斥前均产生了抗体。随后,英国的曼彻斯特实验室也报道了类似的结果[50]。目前已证实,抗体出现在排斥发生之前,由此不难看出抗体与排斥的关系。笔者等人分别在2000和2003年发表了器官移植体液免疫理论的综述,希望这一理论的提出能引起足够的重视及争论[51-52]。
三、单一抗原微珠法检测
1987年,Bjorkman等[53]在鉴定HLA分子结构方面作出了重大的突破。有了这样的基础,通过重组细胞株可获得单一抗原特异性,并由此促成了Luminex单一抗原微珠检测技术的诞生。该技术是将单一HLA抗原包备在每个不同颜色的微珠上。进而精确地检测出抗体的特异性[54],包括DSA。
图1显示,患者在移植失败前产生了针对供者的DQ2和B58抗体(DSA),一段时间后血清肌苷升高,移植物被排斥[55]。Miller等[56],Rebellato 等[57],Kinukawa 等[58],van den Berg-Loonen等[59]众多专家随后分别报道了类似的结果。这些研究满足了确定因果关系的重要标准,即抗体先出现,然后发生移植排斥。Hill[60]针对吸烟与肺癌的相关性提出了9项确定因果关系的标准,这些标准也满足HLA抗体导致移植排斥的因果关系[61]。
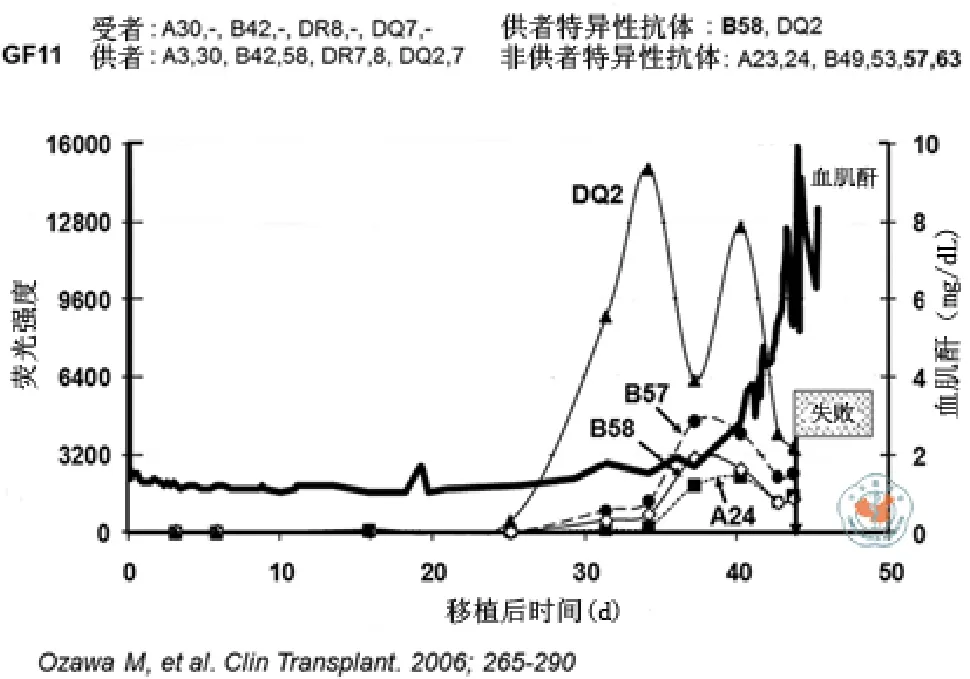
图1 HLA抗体(DSA)在移植失败前产生,然后发生血清肌酐升高,移植物被排斥
一项前瞻性研究表明,在术后移植物功能良好的患者中,有25﹪的患者发现有抗体[62]。一项众多中心参与,涉及2231例患者的国际合作研究表明,对移植物功能良好的患者进行1次抗体检测,发现抗体的阳性率也为25﹪,移植后4年,具有抗体的患者,其存活率明显低于没有抗体的患者[63]。同样的现象也见于抗MICA抗体(图2)。需要强调的是,所有这些患者只检测1次抗体。然后根据当时是否存在抗体分别总结存活率。笔者认为,针对这样的结果,惟一可行的解释是:抗体造成移植物存活率降低。这仅是第一次前瞻性研究获得的证据。心脏移植和肺移植同样显示抗体导致存活率降低[64],可以作出结论,在评估移植物存活后果方面,HLA抗体比任何其它因素都具有预测性。
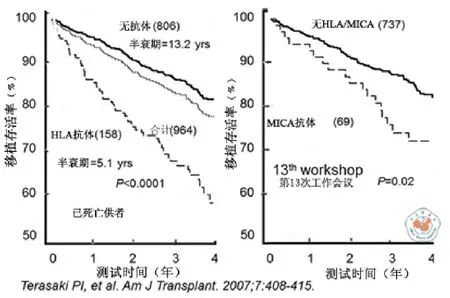
图2 HLA抗体与肾移植排斥的前瞻性研究。所有被检测的患者,其移植物功能良好至少1年以上
长期以来,肝移植一直被认为不受抗体的影响,但肝移植患者首次经历了类似的研究。原因是位于克林特马尔姆(Klintmalm)的一个移植中心储存了过去20年1000例移植患者的血清[65]。在39例排斥患者中,95﹪在排斥发生前存在抗体,而同期移植的对照组患者中,只有41﹪的患者存在抗体。由此提示,肝移植并非可以免除抗体造成的损伤,因移植后抗体确实存在。类似的情况也见于心脏移植。例如,Rose的一个心脏移植中心也储存了过去15年的血清,对比显示,产生抗体的患者,其移植存活率低于没有产生抗体的患者[66]。在胰岛细胞移植方面,移植物失败与抗体形成相关[67],图3显示,患者C肽水平降低,而DSA水平对应性增高。笔者认为,体液免疫理论适用于所有的同种异体移植,包括肾脏、心脏、肝脏、肺脏和胰岛等移植。
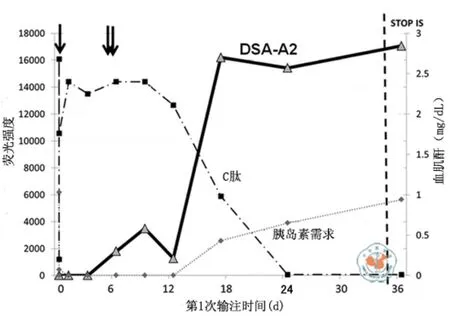
图3 移植后,供者特异性抗体A2升高,C肽对应性降低
另一个重要的问题是HLA相合是否可以影响移植物存活率。Mickey等[68]在1971年报道了HLA配型对肾移植的影响。之后的40年争论不断,很多HLA相合很差的患者,其存活率却很理想。最近,联邦器官管理机构(UNOS)停止了反映HLA错配的记分要求,理由是该记分系统的益处不是很明显。新的观念是任何错配都可考虑移植,重要的是移植后需要监测抗体的生成,因为产生抗体可导致移植失败;而不产生抗体常预示移植物功能良好。当然,错配应该避免,因其与抗体形成相关,尤其是错配使得二次移植更为困难。然而,对于心脏、肝脏和肺脏等移植,医生常常没有其它选择而必须移植错配的器官。笔者曾倡导建立肾脏的器官运输系统,以使更多的患者获得零错配的移植,截止到目前,在美国已经有2万名以上的肾移植患者通过该系统获得零错配的移植,幸运的是,目前UNOS的供者选择政策仍保留了器官运输系统功能。
坚持控制错配的政策可以使刚刚进入等待器官名单中的部分患者因获得了更好的相合器官很快获得移植,而因为没有相合程度好的器官,许多患者常常需要等待10年以上,这似乎不大公平,尤其是完全相合的移植,其10年存活率的优势仅为2﹪~5﹪。大量累积的证据提示,如果抗体造成慢性排斥,去除抗体可防止排斥的发生。一项重要的研究显示,硼替佐米(Bortezomib,一种浆细胞蛋白酶抑制剂)具有清除抗体的功能。图4显示,抗体降低50﹪以上的患者,其5年存活率为100﹪,而抗体没有被清除的患者,大部分患者在移植后5年期间内,移植物丢失[69]。
调整免疫抑制剂用量加上清除抗体可改善肾移植存活率。例如,在增加骁悉用药剂量的患者中,抗体被清除的患者,其存活率可达100﹪,而没有清除抗体的患者存活率受到影响[70]。法国的一家移植中心通过血浆置换和静脉注射IgG也获得了类似的结果[71]。治疗后抗体被清除的患者,其存活率会明显高于那些治疗后抗体仍存在的患者的存活率,例如,肺移植患者中,清除DSA可获得较高的存活率[72]。
四、结论
大量的研究结果证实了体液免疫理论,尤其是不同的实体器官移植均存在抗体相关排斥,最为明显的是,DSA出现在排斥发生前,说明抗体是器官移植排斥的原因。前瞻性的研究也显示,即便只检测1次,抗体阳性的患者,其4年存活率明显低于抗体阴性的患者。目前,临床医生正在应用抗体检测技术监测移植后的抗体产生情况及设法清除抗体,这些措施无疑会改善移植患者的长期存活质量。
1 Pappenheimer AM.Experimental studies upon lymphocytes.I.The reactions of lymphocytes under various experimental conditions[J].J Exp Med,1917,25(5):633-650.
2 Schrek R.A biological method for sterilizing contaminated transplantable tumors[J].Am J Pathol,1936,12(4):531-543.
3 Woglom WH.Immunity to transplantable tumours[J].Cancer Rev,1929,4:129-214.
4 Lambert RA.Anote on the specificity of cytotoxins[J].J Exp Med,1914,19(3):277-822.
5 Rous PJ,Murphy JB.On immunity to transplantable chicken tumors[J].J Exp Med,1914,20(4):419-432.
6 Gorer PA,Schutze H.Genetical studies on immunity in mice.Ⅱ.Correlation between antibody formation and resistance[J].J Hyg (Lond),1938,38(6):647-662.
7 Snell GD.Methods for the study of histocompatibility genes[J].J Genet,1948,49(2):87-108.
8 Kalfayan B,Kidd JG.Structural changes produced in Brown-Pearce carcinoma cells by means of a specific antibody and complement[J].J Exp Med,1953,97(1):145-162.
9 Gorer PA.Some reactions of H-2 antibodies in vitro and in vivo[J].Ann N Y Acad Sci,1958,73(3):707-721.
10 Gorer PA,Amos DB.Passive immunity in mice against C57BL leukosis E.L.4 by means of iso-immune serum[J].Cancer Res,1956,16(4):338-343.
11 Jensen E,Stetson CA Jr.Humoral aspects of the immune response to homografts.II.Relationship between the hemagglutinating and cytotoxic activities of certain isoimmune sera[J].J Exp Med,1961,113:785-794.
12 Moller E,Moller G.Quantitative studies of the sensitivity of normal and neoplastic mouse cells to the cytotoxic action of isoantibodies[J].J Exp Med,1962,115:527-553.
13 Terasaki PI,McClelland J.Antibody response to homografts.Ⅷ.Relation of mouse hemagglutinins and cytotoxins[J].J Exp Med,1963,117:675-690.
14 Amos DB,Gorer PA,Mikulska BM,et al.An antibody response to skin homografts in mice[J].Br J Exp Pathol,1954,35(2):203-208.
15 Terasaki PI.Antibody response to homografts.II.Preliminary studies of the time of appearance of lymphoagglutinins upon homografting[J].Am Surg,1959,11:896-899.
16 Terasaki PI,Bold EJ,Cannon JA,et al.Antibody response to homografts.VI.In vitro cytotoxins produced by skin homografts in rabbits[J].Proc Soc Exp Biol Med,1961,106: 133-136.
17 Terasaki PI,McClelland J,Cannon JA,et al.Antibody response to homografts.VII.The role of complement in cytotoxicity of serum from homografted rabbits[J].J Immunol,1961,87:39-45.
18 Stetson CA Jr,Demopoulos R.Reactions of skin homografts with specific immune sera[J].Ann N Y Acad Sci,1958,73(3):687-692.
19 Terasaki PI,Akiyama T,McClelland J,et al.Renal damage produced in vivo by homologous mouse antisera[J].Ann N Y Acad Sci,1962,99:645-656.
20 Dausset J.Iso-leuco-anticorps[J].Acta Haematol,1958,20(1-4):156-166.
21 van Rood JJ,Eernisse JG,van Leeuwen A.Leucocyte antibodies in sera of pregnant women[J].Nature,1958,181(4625):1735-1736.
22 Payne R,Rolfs MR.Fetomaternal leucocyte incompatibility[J].J Clin Invest,1958,37(12):1756-1763.
23 Brent L,Brown JB,Medawar PB.Skin transplantation immunity in relation to hypersensitivity reactions of the delayed type[J].Bull Soc Int Chir,1959,18(2):116-130.
24 Kwun J,Knechtle SJ.Overcoming chronic rejection—Can it B[J].Transplantation,2009,88(8):955-961.
25 Russell PS.Histocompatibility testing: national a cademy of sciences-national research council,Washington DC,1964.
26 Terasaki PI,McClelland JD.Microdroplet assay of human serum cytotoxins[J].Nature,1964,204:998-1000.
27 Ceppellini R,Curtoni ES,Mattiuz PL,et al.Genetics of leukocyte antigens: A family study of segregation and linkage.In: Curtoni ES,Mattiuz PL,Tosi RM,eds.Histocompatibility.Copenhagen,Munksgaard,1967,149-185.
28.Terasaki PI,Marchioro TL,Starzl TE.Sero-typing of human lymphocyte antigens: Preliminary trials on longterm kidney homograft survivors.First Histocompatibility Workshop,1964:83-69.
29 Kissmeyer-Nielsen F,Olsen S,Petersen VP,et al.Hyperacute rejection of kidney allografts associated with pre-existing humoral antibodies against donor cells[J].Lancet,1966,2(7465):662-665.
30 Patel R,Terasaki PI.Significance of the positive crossmatch test in kidney transplantation[J].N Engl J Med,1969,280(14): 735-739.
31 Starzl TE,Lerner RA,Dixon FJ,et al.Shwartzman reaction after human renal homotransplantation[J].N Engl J Med,1968,278(12):642-648.
32 Williams GM,Hume DM,Hudson RP Jr,et al.“Hyperacute” renalhomograft rejection in man[J].N Engl J Med,1968,279(12):611-618.
33 Morris PJ,Williams GM,Hume DM,et al.Serotyping for homotransplantation.XII.Occurrence of cytotoxic antibodies following kidney transplantation in man[J].Transplantation,1968,6(3):392-399.
34 Morris PJ,Mickey MR,Singal DP,et al.Serotyping for homotransplantations XXII,specificity of cytotoxic antibodies developing after renal transplantation[J].Br Med J,1969,1(5646):758-759.
35 Jeannet M,Pinn VW,Flax MH,et al.Humoral antibodies in renal allotransplantation in man[J].N Engl J Med,1970,282(3):111-117.
36 Terasaki PI,Kreisler M,Mickey RM.Presensitization and kidney transplant failures[J].Postgrad Med J,1971,47(544):89-100.
37 Salvatierra O Jr,Melzer J,Potter D,et al.A sevenyear experience with donor-specific blood transfusions.Resultsand considerations for maximum efficacy[J].Transplantation,1985,40(6):654-659.
38 Cook DJ,Terasaki PI,Iwaki Y,et al.The flow cytometry crossmatch in kidney transplantation[J].Clin Transpl,1987:409-414.
39 Ogura K,Koyama H,Takemoto S,et al.Flow cytometry crossmatching for kidney transplantation[J].Transplant,Proc,1993,25(14):245-246.
40 Mizutani K.HLA mismatches and PRA in kidney retransplants[J].Clin Transpl,2007:19-27.
41 Feucht HE,Schneeberger H,Hillebrand G,et al.Capillary deposition of C4d complement fragment and early renal graft loss[J].Kidney Int,1993,43(6):1333-1338.
42 Haas M.C4d negative antibody-mediated rejection in renal allografts:Evidence for its existence and effect on graft survival[J].Clin Nephrol,2011,75(4):271-278.
43 Zou Y,Heinemann FM,Grosse-Wilde H,et al.Detection of anti-MICA antibodies in patients awaiting kidney transplantation,during the posttransplant course,and in eluates from rejected kidney allografts by Luminex flow cytometry[J].Hum Immunol,2006,67(3):230-237.
44 Russell PS,Chase CM,Winn HJ,et al.Coronary atherosclerosis in transplanted mouse hearts.II.Importance of humoral immunity[J].J Immunol,1994,152(10):5135-5141.
45 Smith RN,Kawai T,Boskovic S,et al.Four stages and lack of stable accommodation in chronic alloantibody-mediated renal allograft rejection in Cynomolgus monkeys[J].Am J Transplant,2008,8(8):1662-1672.
46 Park MS,Terasaki PI,Lau M,et al.Sensitization after transplantation[J].1987,393-397.
47 Harmer AW,Koffman CG,Heads AJ,et al.Sensitization to HLA antigens occurs in 95﹪ of primary renal transplant rejections[J].Transplant Proc,1995,27(1):666-667.
48 El-Awar N,Terasaki P,Lazda V,et al.Almost all patients who are waiting for a regraft of a kidney transplant have anti-HLA antibodies[J].Transplant Proc,2002,34(7):2531-2532.
49 Lee PC,Terasaki PI,Takemoto SK,et al.All chronic rejection failures of kidney transplants were preceded by the development of HLA antibodies[J].Transplantation,2002,74(8):1192-1194.
50 Worthington JE,Martin S,Al-Husseini DM,et al.Posttransplantation production of donor HLA-specific antibodies as a predictor of renal transplant outcome[J].Transplantation,2003,75(7):1034-1040.
51 McKenna RM,Takemoto SK,Terasaki PI.Anti-HLA antibodies after solid organ transplantation[J].Transplantation, 2000,69(3):319-326.
52 Terasaki PI.Humoral theory of transplantation[J].Am J Transplant,2003,3(6):665-673.
53 Bjorkman PJ,Saper MA,Samraoui B,et al.Structure of the human class I histocompatibility antigen,HLA-A2[J].Nature,1987,329(6139):506-512.
54 Pei R,Lee JH,Shih NJ,et al.Single human leukocyte antigen flow cytometry beads for accurate identification of human leukocyte antigen antibody specificities[J].Transplantation,2003,75(1):43-49.
55 Ozawa M,Rebellato LM,Terasaki PI,Tong A,Briley KP,Catrou P and Haisch CE.Longitudinal testing of 266 renal allograft patients for HLA and MICA antibodies:Greenville experience.//Terasaki PI,ed.Clinical transplantation.Los Angeles,CA,Terasaki Foundation Laboratory,2006:265-290.
56 Mizutani K,Shibata L,Ozawa M,Esquenazi V,Rosen A,Miller J,and Terasaki PI.Detection of HLA and MICA antibodies before kidney graft failure.//Terasaki PI,ed.Clinical transplantation.Los Angeles,CA,Terasaki Foundation Laboratory,2006:255-264.
57 Rebellato LM,Ozawa M,Verbanac KM,Catour P,Haisch CE and Terasaki PI.Clinical and anti-HLA antibody profile of nine renal transplant recipients with failed grafts:Donorspecific and non-donor-specific antibody development.//Terasaki PI,ed.Clinical transplantation.Los Angeles,CA,Terasaki Foundation Laboratory,2006:241-253.
58 Kinukawa T,Kato M,Terasaki Pi and Ozawa M.Retrospective antibody analysis of thirty patients with kidney graft failure.// Terasaki PI,ed.Clinical transplantation.Los Angeles,CA,Terasaki Foundation Laboratory,2006:291-303.
59 van den Berg-Loonen EM,Terasaki PI,Kohanof S and Christiaans MHL.Longitudinal testing of seventy-six renal allograft patients for HLA antibodies: Maastricht experience.//Terasaki PI,ed.Clinical transplantation.Los Angeles,CA,Terasaki Foundation Laboratory,2006:305-322.
60 Hill AB.The environment and disease: Association or causation[J].Proc R Soc Med,1965,58:295-300.
61 Terasaki PI,Cai J.Human leukocyte antigen antibodies and chronic rejection: From association to causation[J].Transplantation,2008,86(3):377-383.
62 Terasaki PI,Ozawa M.Predictive value of HLA antibodies and serum creatinine in chronic rejection:Results of a 2-year prospective trial[J].Transplantation,2005,80(9):1194-1197.
63 Terasaki PI,Ozawa M,Castro R.Four-year follow-up of a prospective trial of HLA and MICA antibodies on kidney graft survival[J].Am J Transplant,2007,7(2):408-415.
64 Morales-Buenrostro LE,Castro R,Terasaki PI.A single human leukocyte antigen-antibody test after heart or lung transplantation is predictive of survival[J].Transplantation,2008,85(3):478-481.
65 O’Leary JG,Kaneku H,Susskind BM,et al.High mean fluorescence intensity donor-specific anti-HLA antibodies associated with chronic rejection postliver transplant[J].Am J Transplant,2011,11(9):1868-1876.
66 Smith JD,Banner NR,Hamour IM,et al.De novo donor HLA-specific antibodies after heart transplantation are an independent predictor of poor patient survival[J].Am J Transplant,2011,11(2):312-319.
67 Piemonti L,Everly MJ,Maffi P,et al.Both alloantibodies and autoantibodies are a significant barrier to preservation of islet cell function after transplantation[J].Transpl Int,2011,24(2):47.
68 Mickey MR,Kreisler M,Albert ED,et al.Analysis of HL-A incompatibility in human renal transplants[J].Tissue Antigens,1971,1(2):57-67.
69 Everly MJ,Everly JJ,Susskind B,et al.Bortezomib provides effective therapy for antibody-and cell-mediated acute rejection[J].Transplantation,2008,86(12):1754-1761.
70 Everly MJ,Rebellato LM,Ozawa M,et al.Beyond histology:Lowering human leukocyte antigen antibody to improve renal allograft survival in acute rejection[J].Transplantation,2010,89(8):962-967.
71 Lefaucheur C,Nochy D,Andrade J,et al.Comparison of combination Plasmapheresis/IVIg/anti-CD20 versus high-dose IVIg in the treatment of antibody-mediated rejection[J].Am J Transplant,2009,9(5):1099-1107.
72 Hachem RR,Yusen RD,Meyers BF,et al.Anti-human leukocyte antigen antibodies and preemptive antibodydirected therapy after lung transplantation[J].J Heart Lung Transplant,2010,29(9):973-980.

