一株异肠球菌SJR-16-1胞外多糖合成条件的研究
白丽娟,李向东
(1.辽宁医学院食品科学与工程学院,辽宁 锦州 121001;2.光明乳业股份有限公司技术中心乳业生物技术国家重点实验室,上海 200436)
一株异肠球菌SJR-16-1胞外多糖合成条件的研究
白丽娟1,李向东2
(1.辽宁医学院食品科学与工程学院,辽宁 锦州 121001;2.光明乳业股份有限公司技术中心乳业生物技术国家重点实验室,上海 200436)
针对分离自内蒙古锡林郭勒牧区马奶酒中的41株乳酸菌进行胞外多糖生物合成能力的的研究,筛选出一株胞外多糖产量高的菌株异肠球菌SJR-16-1,分别改变基础培养基的碳源、氮源以及发酵温度、时间、pH等条件,探讨其对异肠球菌SJR-16-1胞外多糖生物合成能力的影响。优化的培养基的组成为蛋白胨2.0%;葡萄糖1.5%;麦芽糖1.5%;K2HPO40.2%;MnSO4·4H2O 0.02%;MgSO4·7H2O 0.02%;醋酸钠0.5%;酵母粉0.5%;Tween801 mL/L。确定其胞外多糖的最佳生物合成条件为:初始pH6.0,发酵温度35℃,发酵时间14 h,优化的条件显著提高了EPS的合成量。
异肠球菌;胞外多糖;生物合成
马奶酒(Kummis)是以鲜马奶为原料,加入含有乳酸菌、酵母菌等菌种的发酵剂,经科学方法酿制而成的活性乳饮料,在医疗保健作用方面,马奶酒具有驱寒、活血、舒筋、消食、健胃等功能[1]。
乳酸菌 (lactic acid bacterium,LAB)的胞外多糖(exopolysaccharide,EPS)是这类细菌在生长代谢过程中分泌到细胞外的黏液或荚膜多糖[2-3]。
乳酸菌胞外多糖可以作为增稠剂、稳定剂、乳化剂、起泡剂和凝胶剂应用于食品、化工和医药领域。但是产量低、成本高,菌株稳定性差是影响其广泛应用的主要因素。影响乳酸菌EPS生物合成的因素很多,而且不同乳酸菌EPS的最适生物合成条件差异较大。乳酸菌EPS生物合成除受遗传因素即菌株自身因素的影响外,还受培养基的组成、pH,培养温度、金属元素(Mg、Mn、Fe)、氨基酸、黄嘌呤和恒定的氧压浓度等因素的影响[4]。EPS产量的遗传不稳定性在工业应用上是一个较大的问题,己有研究报道了乳酸菌EPS生产性状易于丢失、降低或者组成发生改变。
乳酸菌EPS应用于产品的生产成本高要广泛应用于食品、化工和医药领域受到限制。为提高乳酸菌EPS的生物合成量,EPS合成机制、合成的遗传调控、高产菌株构建、发酵工艺条件优化、新型发酵方法的研究等都是切入点[5]。本文试图从马奶酒中分离出的乳酸菌中筛选出合成胞外多糖多的菌种,研究其大量合成胞外多糖的条件、优化发酵工艺,提高胞外多糖的产量,进行后续研究及应用。
1 材料与方法
1.1 样品来源
实验菌株均采于锡林郭勒牧区的巴彦锡勒等牧场,代号分别为:BX、LN、MD、AE、SN、SJ以及本课题组保留的菌株。本课题组在前期工作中将马奶酒发酵菌初步分离后,菌种冻干保存。
1.2 基础培养基
TPY液体增菌培养基、MRS固体培养基、MRS半固体培养基、MRS液体培养基及脱脂乳培养基按文献[6-7]介绍的方法配制。
1.3 方法
1.3.1 胞外多糖高产菌株的筛选及合成条件的研究
将分离保存的41株菌株分别接入MRS液体培养基中,培养24 h后,发酵液采用12000 g 4℃离心30 min,收集上清液,减压浓缩至适当体积加3倍95%的冷酒精沉淀24 h,于12000 g(4℃)离心30 min,重复3次,沉淀物溶解于重蒸水中,并于4℃下透析24 h,浓缩、真空干燥,并采用硫酸-蒽酮法测定,筛选出合成胞外多糖含量高的菌株鉴定后分别对碳源、氮源和培养条件进行研究,确定最合乳酸菌胞外多糖合成的条件[8]。
1.3.2 分析
光密度采用721分光光度计测定;pH用酸度计测定;总糖含量采用硫酸-蒽酮法测定,以葡萄糖作为标准[9],活菌数量用MRS琼脂培养基,培养后进行菌落计数。
2 结果与分析
2.1 马奶酒中乳酸菌合成胞外多糖能力的研究
2.1.1 高产胞外多糖乳酸菌株的筛选
来源于酸马奶的不同乳酸菌菌株,在11.5%的脱脂牛乳培养基中,置于37℃培养20 h后,凝乳经过离心、脱蛋白、乙醇沉淀、透析并采用硫酸—蒽酮法测定的EPS生物合成量如表1所示。
表1结果显示,分离株EPS产量差异显著,范围为0.33 mg/L~34.29 mg/L。EPS合成量最高的菌株为标准菌株双歧杆菌,合成量为34.29 mg/L。除标准菌株外,来源于马奶酒中的乳酸菌EPS产量最高的菌株是BXE-5-3,其次是 SJR-16-1,其产量是 31.56 mg/L,稍低于BXE-5-3,本项目选取菌株SJR-16-1胞外多糖生物合成条件的研究。
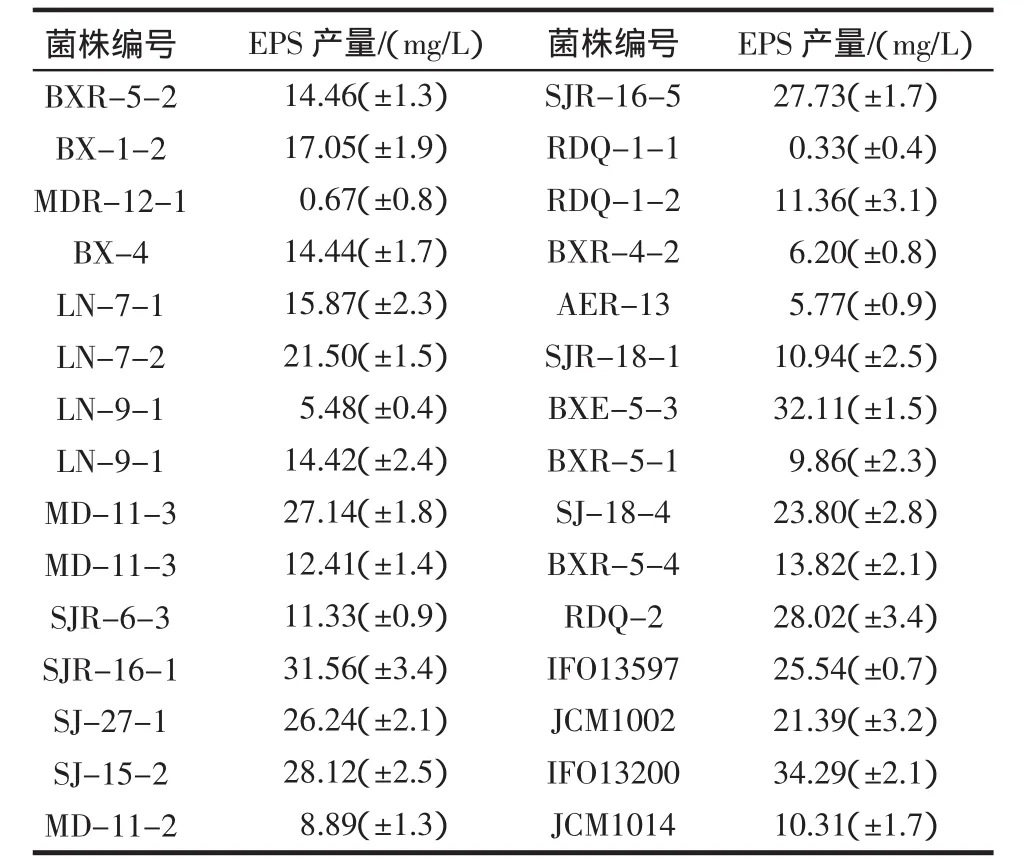
表1 不同乳酸菌株的胞外多糖产量(Mean±SD,n=3)Table1 Exopolysaccharide yield of different strains of lactic acid bacteria
2.1.2 高产EPS菌株的生长曲线
将高产EPS的乳酸菌SJR-16-1接种于装有MRS液体培养基的试管各14支,37℃培养,每间隔2小时取出1支,在600 nm的波长处检测光密度。以时间为横坐标,光密度为纵坐标,得到该菌株的生长曲线如图1所示。
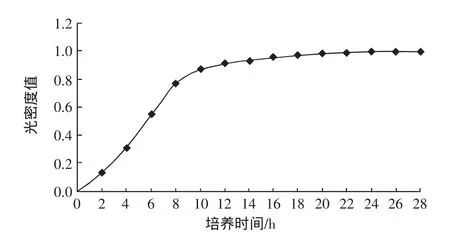
图1 菌株SJR-16-1在不同时间培养的生长曲线Fig.1 The growth curve of SJR-16-1 in different times
图1显示,乳酸菌SJR-16-1从接种到第4小时处于延迟期,这期间细胞数目变化不大,经过适应后细胞生理状态逐渐恢复,并开始生长;从第4小时到第10小时为对数期,此期间细胞代谢活跃,生长速度成线性上升,繁殖力强。从第15小时后进入稳定期,在此期间新繁殖细胞数目与死亡的细胞数目基本处于平衡的状态,活细菌数达到动态平衡。微生物的代谢因种而异,受培养基成分及环境条件的影响,同时与菌龄、接种量也有关系。
2.1.3 高产胞外多糖菌株的鉴定结果
本试验研究中,对高产EPS乳酸菌菌株SJR-16-1的属特性鉴定时,采用嗜热链球菌(Streptococcus thermophilus)IFO13597为标准菌株。高产菌株SJR-16-1在,在过氧化氢酶试验、硝酸盐还原试验和联苯胺反应中均为阴性,发酵葡萄糖产酸不产气,在15℃和45℃都生长的革兰氏阳性菌鉴定为肠球菌属的细菌。菌株SJR-16-1除具有乳球菌属的特征外,在45℃不生长,能在6.5%NaCl环境中生长,能还原0.1%美兰,能水解精氨酸,能分解棉籽糖,不分解鼠李糖、甘露醇、木糖、松三糖和蜜二糖等糖类的菌鉴定为异肠球菌。具体鉴定结果如表2所示。

表2 乳酸菌SJR-16-1的鉴定结果Table 2 Result of Lactic acid bacteria SJR-16-1 authenticated
2.2 不同碳源碳源对异肠球菌SJR-16-1生长和EPS合成的影响
在初始pH 6.5的基础液体培养基中,分别加入葡萄糖、蔗糖、麦芽糖作为碳源,接种异肠球菌SJR-16-1后置于37℃下发酵24 h,其pH、OD600nm和EPS的生物合成量如表3所示。
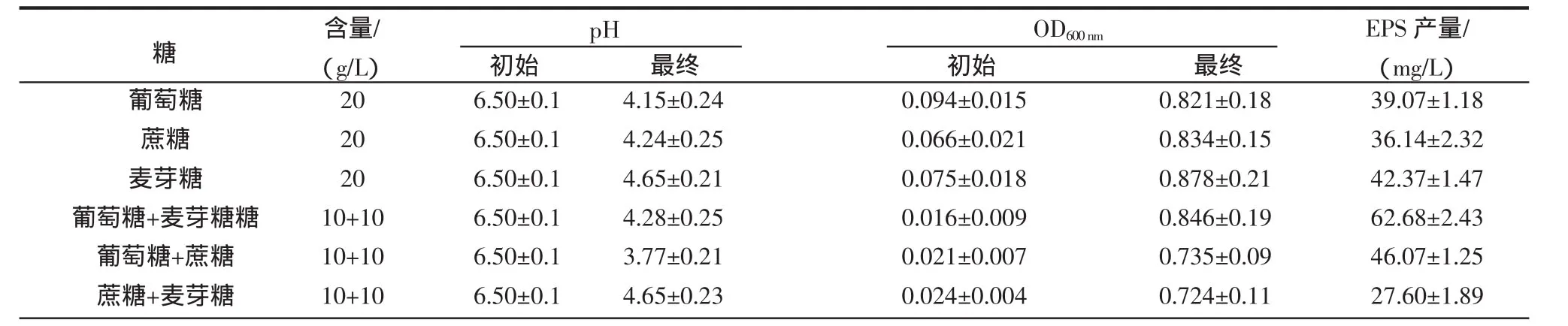
表3 不同碳源对异肠球菌SJR-16-1生长和EPS合成量的影响(Mean±SD,n=3)Table 3 Effect of various carbon sources on pH,OD600 and EPS produced by SJR-16-1
结果显示,在基础培养基中添加1%葡萄糖和1%麦芽糖,异肠球菌SJR-16-1生长旺盛而且EPS的生物合成量最高为62.68 mg/L。
2.3 不同氮源对异肠球菌SJR-16-1生长和胞外多糖合成的影响
在初始pH 6.5的基础培养基中,分别加入2%蛋白胨、胰蛋白胨和大豆蛋白胨,接种异肠球菌SJR-16-1置于37℃下发酵24 h后,其pH、OD变化和EPS的生物合成量如表4所示。
表4结果显示以蛋白胨作为氮源有利于乳酸菌的增殖和EPS的合成,因此,蛋白胨的添加量分别为20 g/L。

表4 不同氮源对异肠球菌SJR-16-1生长和EPS合成的影响(Mean±SD,n=3)Table4 Effect of various nitrogen sources on pH,OD600 and EPS produced by SJR-16-1
综合试验结果和成本考虑,在半合成培养基MRS的基础上确定的优化培养基组成为蛋白胨2.0%;葡萄糖1.5%;麦芽糖1.5%;K2HPO40.2%;MnSO4·4H2O0.02%;MgSO4·7H2O 0.02%;醋酸钠0.5%;酵母粉0.5%;Tween801 mL/L。
2.4 菌株胞外多糖最佳合成条件的研究
为确定异肠球菌SJR-16-1最适生长条件,进一步优化试验,分别选取pH为A因素,发酵温度为B因素,发酵时间为C因素,各取4个水平,以胞外多糖产量为指标进行L16(44)正交试验[8],因素水平见表5,试验结果如表6、7所示。

表5 正交试验设计Table 5 Project of the orthogonal experiment
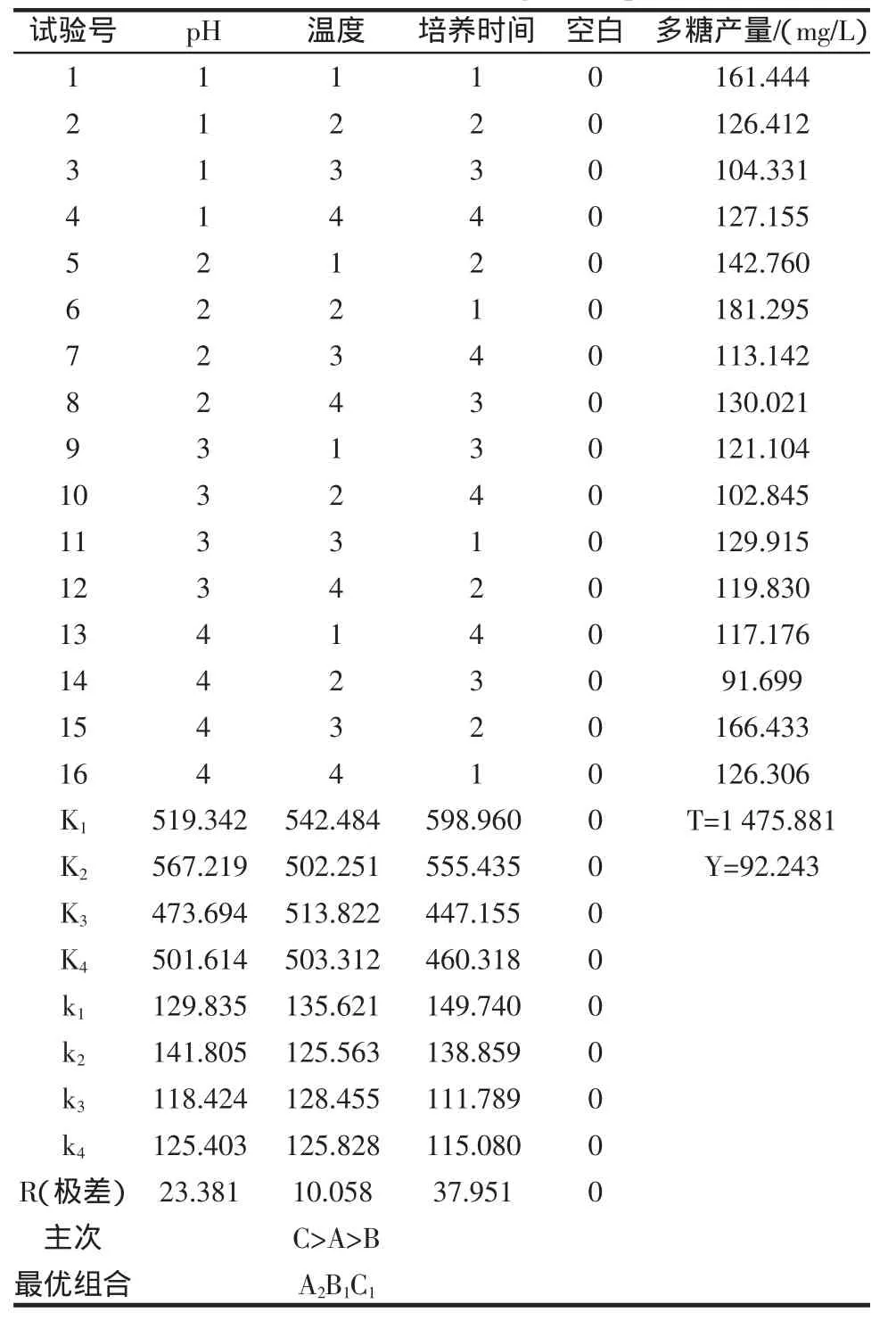
表6 正交试验结果Table 6 Result of The orthogonal experiment
由正交试验和方差结果可知:最优组合为A2B1C1,即温度30℃,pH6.0,发酵时间14 h,培养时间对结果影响显著。试验结果表明较低的培养温度适合胞外多糖生物合成量的提高。这可能是因为在较低的温度下,细胞生长慢,细胞壁的合成也慢,从而使较多的磷酸类异戊二烯用于胞外多糖的合成,14 h时合成量达到最大,随着时间的延长,培养液中乳酸菌的大量生长繁殖,碳源不能满足微生物生长的需求就会分解部分合成的胞外多糖,导致检测到的胞外多糖含量降低。由于温度对结果影响最小,且温度低乳酸菌繁殖速度慢,菌体少影响胞外多糖的总产量,因此综合各个方面的条件考虑应选择的发酵条件为:温度35℃,pH6.0,发酵时间14 h。
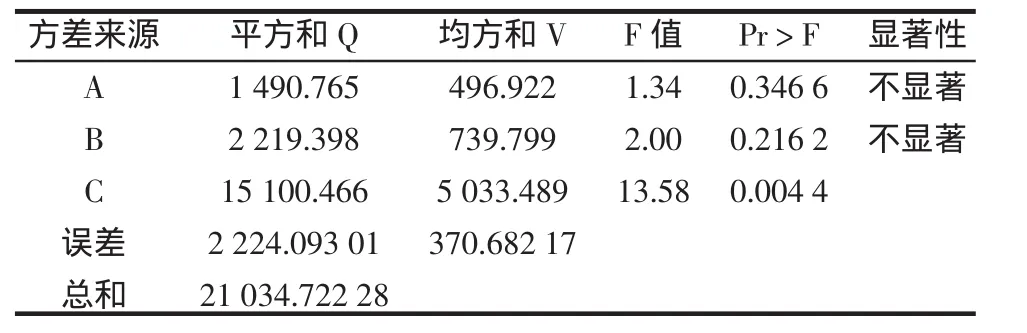
表7 正交试验的方差分析Table 7 The variance analysis of orthogonal experiment
2.5 优化条件与对照条件的比较结果
在初始pH6.0的优化液体培养基中接种2%的异肠球菌SJR-16-1,置于35℃温度下发酵14 h,对照组为初始pH6.5液体培养基MRS中接种2%的异场球菌SJR-16-1,置于35℃温度下发酵14 h测定其活菌数和EPS的产量如图2所示。
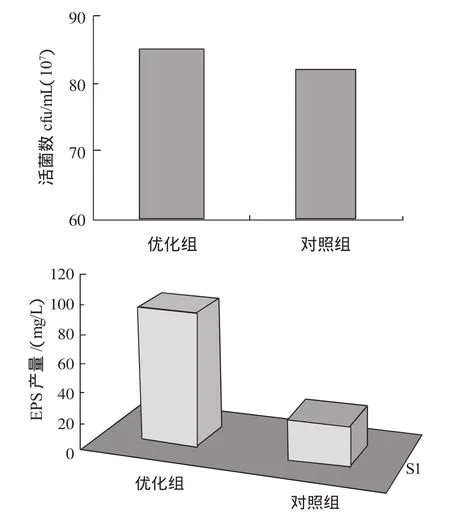
图2 优化组与对照组的活菌数和EPS的产量比较结果Fig.2 The comparative result of cfu/L and EPS production
从图2结果可以看出优化培养基菌体数量没有明显高于对照组,而且EPS产量大约是对照组的3倍~4倍,显著提高了EPS的合成量。
3 结论与讨论
本项目从内蒙古的马奶酒中分离的乳酸菌种筛选出一株高产胞外多糖的菌株,经鉴定为异肠球菌。经试验在半合成培养基MRS的基础上优化的培养基为蛋白胨2.0%;葡萄糖1.5%;麦芽糖1.5%;K2HPO40.2%;MnSO4·4H2O 0.02%;MgSO4·7H2O 0.02%;醋酸钠0.5%;酵母粉0.5%;Tween801 mL/L。
接种2%的异肠球菌SJR-16-1于优化培养基中35℃下培养时,初始pH为6.0时发酵14 h后,EPS最大合成量为181.29 mg/L,因此初始pH6.0时35℃是该乳酸菌较为理想的发酵温度,14 h是该乳酸菌较为理想的发酵时间,并且优化后的条件有利于EPS的合成和积累。
采用优化的培养基和最适的培养条件与对照组相比,EPS的产量有很大的提高,有助于整个研究向产业化方向发展。为了尽量减少MRS液体培养基中存在的大分子物质对多糖测定的影响,试验中除去了MRS培养基配方中的牛肉膏,优化后培养基对菌株的生长没有显著的影响却可以提高EPS产量,并且还将有利于下一步分离纯化EPS。
[1]芒来.蒙古人与马[M].呼和浩特:内蒙古科学技术出版社,2002:11-13
[2]张笃,刘宁,孟祥晨.乳酸菌胞外多糖的生物学活性[J].国外医学卫生学分册,2004,31(4):227
[3]王玲燕,李元.微生物胞外多糖生物合成研究进展[J].药物生物技,2002,9(6):369-373
[4]刘立波,刘宁,孟祥晨.影响乳酸菌胞外多糖合成的因素[J].中国乳品工业,2004,32(2):32-34
[5]陈晓红.乳酸菌胞外多糖的生物合成及其组成和体外抑瘤活性研究[D].南京农业大学,2003:10-13
[6]布坎南R E.伯杰细菌鉴定手册[M].8版.北京:中国农业出版社,1995:22-28
[7]凌代文,东秀珠.乳酸菌细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1996:117-128
[8]白丽娟,殷文政.米酒乳杆菌BXR-5-3胞外多糖合成条件的研究[J].微生物学杂志,2008,28(1):49-53
[9]Kimmel S A,Roberts R F,Ziegler G R.Optimization of exopolysaccharide production by L.delbrueckiisubsp.bulgaricus RR grown in a semidefined medium[J].Applied and environmental microbiology,1998,64(4):659-664
Study on the Conditions of Exopolysaccharide Biosynthesis of Enterococcus SJR-16-1
BAI Li-juan1,LI Xiang-dong2
(1.Food Science and Engineering of Liaoning Medical College,Jinzhou 121001,Liaoning,China;2.State Key Laboratory of Dairy Biotechnology,Technology Center,Bright Dairy&Food Co.,Ltd.,Shanghai 200436,China)
41strains of lactic acid bacterium comed from Kumiss of the pastoral area in Xilin Guole had been examined for its exopolysaccharide production capacities.It was proved that Enterococcus SJR-16-1 was more procreative.The effects of carbon source,nitrogen source,temperature,culture time and optimum initial pH value of medium on exopolysaccharide produced were studied and a new culture medium for the biosynthesis of exopolysaccharide was formulated.The medium had following composition:peptone,2.0%;glucose,1.5%;maltose1.5%;K2HPO40.2%;MnSO4·4H2O,0.02%;MgSO4·7H2O0.02%;Sodium acetace0.5%;yeast0.5%;Tween80,1 mL/L.The best culture conditions for Enterococcus SJR-16-1 to biosynthesis EPS was the constant pH 6.0 of medium with fermentation at 35℃for 14 h.
Enterococcus;exopolysaccharide;biosynthesis
白丽娟(1979—),女(蒙古),讲师,硕士,研究方向:食品微生物的研究与利用。
2011-08-01

