混合物料发酵产物小分子肽的测定
朱长波 王劲松 陈清蝉
(1.武汉烁森生物科技有限公司,湖北荆门 448121;2.荆楚理工学院,湖北荆门 448000)
我国每年产生数亿吨的各类糟粕,一方面没能很好的利用造成巨大浪费,另一方面又从国外进口大量大豆。我们将啤酒糟、白酒糟、味精糟、糖糟等农副产品及工业废料作为主要原料,以其他农副产品为辅助原料,加上我们的核心菌种,采用现代生物工程技术和酶工程技术,结合微生态理论,通过多菌种混合固体发酵和添加外源复合酶相结合的先进工艺,生产植物源性酶菌功能营养小肽——肽素35。
过去我们只能用单一的凝胶电泳的检测方法,只能单一的判断小分子肽分子量的范围,不能准确的判断各个分子量段的含量,从而不能准确的判断我们的发酵产品和别人的产品的差异。为了建立一种科学、可靠和稳定的检测方法,我们花了10年时间,通过大量的方法实验证明,Shodex尺寸排阻色谱法是一套比较科学的检测方法,该方法对确定小分子肽含量的测定准确、可靠。
1 待检测原料肽素35的原料组成及比例(见表1)

表1 肽素35的组成(%)
2 小分子肽的分离提取
2.1 蛋白质提取
肽素35样品粉碎,过0.25 mm的筛网,取100 g溶解在水中,定容到1 000 ml,在50℃的振荡水浴锅中振荡提取15 h,得固液混合物。
2.2 蛋白质溶液除杂
提取结束的固液混合物先用纱布粗过滤一次,然后用滤纸细过滤一次,离心(转速4 000 r/min,20 min)再次除去部分固型杂质。取出上清液体放入冰箱待盐析。
2.3 盐析
取800 ml样品蛋白质溶液,称取440 g硫酸铵,逐渐加入到蛋白质溶液中,边加边搅拌。待硫酸铵完全溶解后,放入冰箱中,放置时间15 h。
2.4 离心分离蛋白质
将盐析完成后的蛋白质溶液加入到离心管,将离心机转速调节到6 000 r/min,离心时间20 min。将分离出来的蛋白质用10 ml的水完全溶解,到入10 ml的试剂管中贮存。
2.5 透析
将分离出来的10 ml蛋白质溶液加入到透析袋中(膜孔径2 nm,截留小分子肽),透析时间1 h,充分将蛋白质中的硫酸铵分离出来,避免该试剂带来的试剂误差,透析后得小分肽——肽素35水提物。
3 小分子肽的测定
3.1 检测设备
LC98II-RI凝胶色谱仪、日本Shodex RI-201H示差折光检测器。
3.2 仪器参数
色谱柱:shodes凝胶柱(Column number E008027);流动相:H2O;流速:1.0 ml/min;标准品:普鲁兰 P-82(内装6瓶不同分子量标准品);样品:肽素水提物;进样量:10 μl;实测压力:2.4 MPa;检测器:Shodex RI-201h。
3.3 实验内容
3.3.1 标准曲线制作
取各种我们已知分子量的标准品,分别配成0.5%浓度的溶液,用0.45 μm针式滤器过滤。具体标准品浓度见表2。
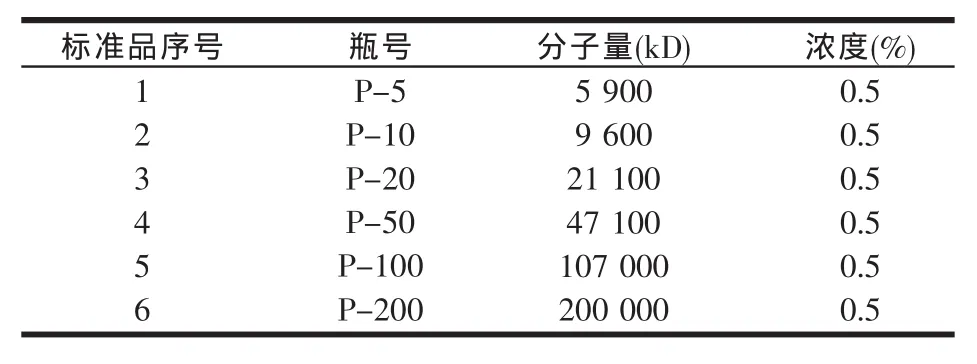
表2 标准品分子量
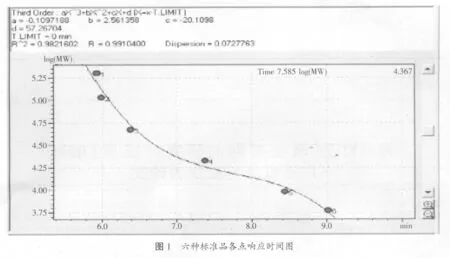
取以上标准品,按顺序将以上标准品进样10 μl,得到以下标准曲线。纵坐标是电压值,横坐标是各种样品的响应时间,各点代表相应标准品峰的响应时间。具体见图1。
3.3.2 肽素35水提物图谱
取肽素35水提物,用同样的实验条件进样10 μl,得到测试谱图(见图2)。
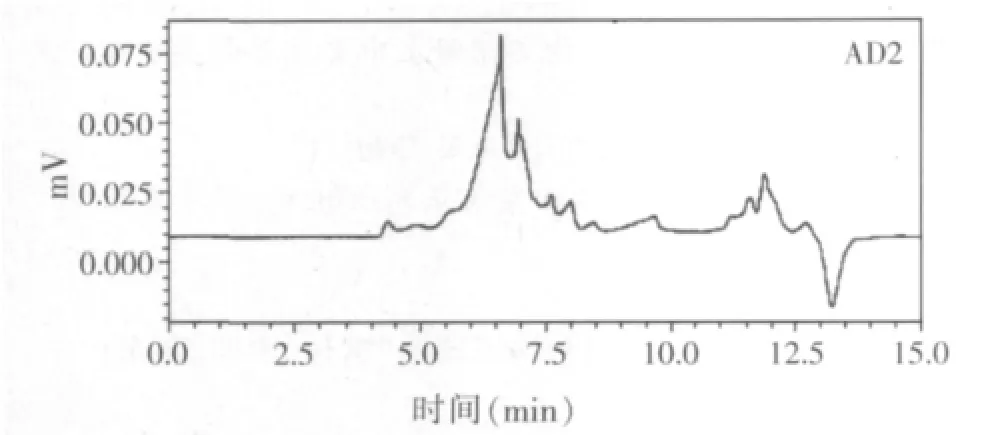
图2 肽素35水提物凝胶色谱仪图谱
3.3.3 标准品和肽素35水提物的图谱对比
通过电脑系统将标准曲线图跟肽素35水提物进样曲线合在一起得到合并图形(见图3)。
从图3我们可以找到标准品响应的点,从而找到肽素35水提物的分子量,以及对应的蜂面积所代表含量,故通过面归一法得到肽素35水提物的分子量分布及含量(见表3)。
由表3我们可以看出10 kD以下分量小分子肽所占比例为70.46%。
4 结论
经过我们分离的菌种发酵后的肽素35,经过水提取,盐析分离,透析除盐后,过硅胶层析分离柱后得出一系列峰,通过面积归一法计算出肽素35分子量范围在5~100 kD之间,分子量10 kD以下的占水溶性小分子肽含量的70%以上。该检测方法是可靠的也是可行的。
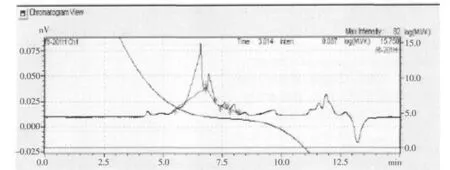
图3 标准品和肽素35合并图
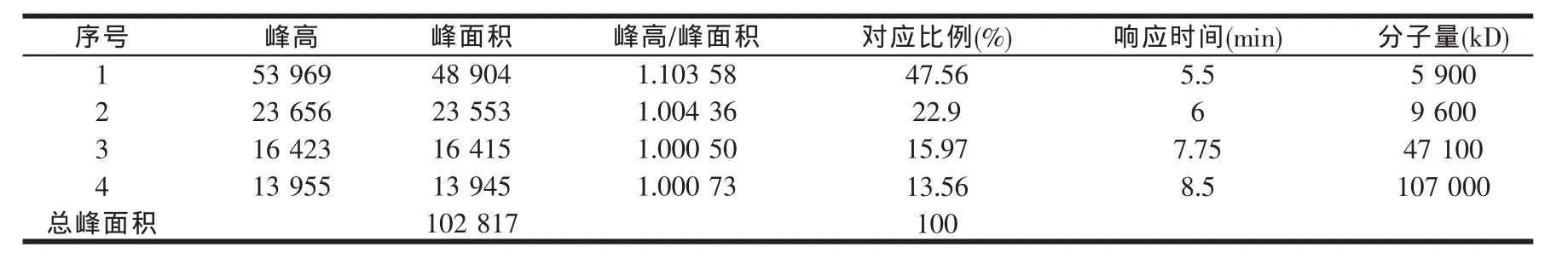
表3 肽素35水提物的分子量分布

