注射用头孢美唑钠与2种药物配伍稳定性考察
陈 瑶,刘青青,肖雨婷(云南省第一人民医院,昆明 650000)
近年来,由于头孢美唑钠(Cefmetazole sodium)对革兰阳性菌和阴性菌(尤其是耐甲氧西林金黄色葡萄球菌(MRSA)、脆弱拟杆菌及厌氧菌[1])均具有良好的抗菌效能,且对各种β-内酰胺酶也有很强的耐受性和稳定性,体内分布好,不良反应少[2],故被广泛应用于临床。经查阅我院门急诊处方,临床常用注射用头孢美唑钠与热毒宁注射液配伍治疗上呼吸道感染所致的高热症,与注射用丹参多酚酸盐配伍治疗冠心病、心绞痛合并感染。本试验依据临床用药剂量,在室温条件下对配伍液的稳定性进行考察,为临床合理用药提供参考依据。
1 仪器与试药
1.1 仪器
1200高效液相色谱仪,包括G1311A四元泵、G1314B可变波长、G1316A柱温箱、G1329A自动控温进样器、G1322A真空脱气机(美国安捷伦公司);BSA224S型电子天平(德国赛多利斯公司);KN-RO-20UPW型超纯水机(深圳市美尔康环保科技有限公司);pHS-W型pH酸度计(上海精密科学仪器有限公司);GWF-8JC型微粒分析仪(天津天河医疗仪器有限公司)。
1.2 试药
注射用头孢美唑钠(四川合信药业有限责任公司,规格:每瓶1 g,批号:11092301);头孢美唑钠对照品(四川合信药业有限责任公司);注射用丹参多酚酸盐(上海绿谷制药有限公司,规格:每瓶50 mg,含丹参乙酸镁40 mg,批号:1107268);热毒宁注射液(江苏康缘药业股份有限公司,规格:每支10 mL,批号:110204);5%葡萄糖注射液(四川科伦药业有限公司,规格:每瓶250 mL,批号:N11090501-1);0.9%氯化钠注射液(四川科伦药业有限公司,规格:每瓶250 mL,批号:N11081709-1);甲醇为色谱纯,其他试剂均为分析纯,水为超纯水。
2 方法
2.1 溶液的制备
2.1.1 对照品贮备液。依据临床用药剂量,分别配制浓度为12.148 mg·mL-1的头孢美唑钠氯化钠溶液(A液)、12.112 mg·mL-1的头孢美唑钠葡萄糖溶液(B液)。
2.1.2 阴性对照贮备液。依据临床用药剂量,分别配制浓度为0.08 mL·mL-1的热毒宁氯化钠溶液(C液)、0.6 mg·mL-1丹参多酚酸葡萄糖溶液(D液)。
2.1.3 配伍贮备液。依据临床用药剂量,分别配制头孢美唑钠与热毒宁的氯化钠溶液(E液)、头孢美唑钠与丹参多酚酸盐的葡萄糖溶液(F液)。
2.1.4 配伍液。分别精密移取E、F液各1 mL,置于25 mL容量瓶中,用0.9%氯化钠注射液、5%葡萄糖注射液分别溶解并稀释至刻度,摇匀。即得G液(头孢美唑钠与热毒宁的0.9%氯化钠配伍液)、H液(头孢美唑钠与丹参多酚酸盐的5%葡萄糖配伍液)。
2.2 外观、不溶性微粒及pH值变化
按“2.1.4”项方法平行配制G、H液,分别在0、1、2、4、6、8 h时取样,考察其外观(溶液澄清度、沉淀、气泡、颜色)、pH值[3]及不溶性微粒数[3]的变化。
2.3 含量测定
2.3.1 色谱条件[2]。色谱柱为Phenomenex Luna C18(250 mm×4.6 mm,5µm),流动相为磷酸二氢铵溶液(5.75 g磷酸二氢铵溶解在700 mL水中)-甲醇-四氢呋喃-10%四丁基氢氧化铵(700∶280∶25∶12.8),流速为1.0 mL·min-1,柱温为30 ℃,检测波长为272 nm,进样量为10µL。
2.3.2 专属性试验。分别精密移取A、B、C、D、G、H液各1 mL,进样测定,记录色谱图。结果,头孢美唑主峰与杂质峰分离度好,且其他2种药物在272 nm波长处无紫外吸收,对头孢美唑的含量测定无影响。色谱图见图1。

2.3.3 线性关系考察。取“2.1.4”项下溶液,按“2.3.1”项色谱条件进样测定,分别自动进样1、2、5、10、15、20 µL,记录色谱,以色谱峰面积(Y)对进样量(X)进行线性回归,分别得回归方程为:Y=1141.4 X+104.34(r=0.9995)、Y=1143.9X-6.965(r=0.9996)。结果表明,在2种溶液中,头孢美唑浓度分别在0.49~9.72 µg·µL-1、0.48~9.69 µg·µL-1范围内线性关系良好。
2.3.4 精密度及稳定性试验。按“2.3.1”项下色谱条件进行测定,分别精密移取A、B液各1 mL,并用相应溶媒各稀释25倍,分别连续6次进样,结果,头孢美唑峰面积的RSD分别为1.37%、1.20%,表明精密度良好。精密移取G、H液各10µL,分别在0、1、2、4、6、8 h时进样,按“2.3.1”项色谱条件测定头孢美唑峰面积,结果头孢美唑峰面积RSD分别为1.25%、1.75%,表明G、H液中头孢美唑钠在8 h内稳定,可满足测定需要。
2.3.5 重复性试验。取同一批号注射用头孢美唑钠各6份,按“2.1.4”项下方法制备溶液,另按“2.3.1”项色谱条件进样测定下,头孢美唑在G、H液中平均含量分别为975.69 mg·g-1、978.81 mg·g-1,RSD分别为 1.46%、1.27%,表明本方法具有较好的重复性。
2.3.6 加样回收率试验。准确称取已知含量的同一批号的样品6份,每份约0.06 g,精密称定,按“2.1.4”项下方法制备溶液,并按“2.3.1”项色谱条件进行测定,计算回收率,结果见表1。

表1 回收率试验结果(n=6)Tab 1 Result of recovery test(n=6)
3 结果
3.1 外观
注射用头孢美唑钠与2种药物配伍后,在0、1、2、4、6、8 h时分别观察外观性状,结果8 h内配伍液G液均为浅黄棕色透明液体,H液均为浅黄色透明液体,无颜色变化,无沉淀或气泡产生。
3.2 pH值和不溶性微粒
0~8 h,配伍液pH值无明显变化,不溶性微粒数则有不同程度的改变,测定结果分别见表2、表3。
3.3 含量测定
在“2.3.1”项色谱条件下分别对配伍液G、H液中头孢美唑的含量进行测定。结果,在8 h内2种配伍液中头孢美唑的含量无明显变化,见表4。
4 讨论
本试验中头孢美唑钠与热毒宁、丹参多酚酸盐配伍,配伍液在8 h内外观、pH值及其中头孢美唑钠含量无明显变化,说明配伍液中头孢美唑钠性质稳定,但配伍液中的热毒宁、丹参多酚酸盐的含量是否有变化还需进一步探讨。
由于紫外分光光度法的选择性差,头孢美唑钠中不可避免地会存在头孢美唑内酯,采用高效液相色谱法可将头孢美唑主峰和头孢美唑内酯峰很好地分离开。本试验考察了2个检测波长214 nm[4~6]和272 nm,结果表明在272 nm波长下,头孢美唑钠峰达到基线分离,此波长更适合于头孢美唑钠的峰面积的测定。
由表2、表3可知,当头孢美唑钠、热毒宁、丹参多酚酸盐分别与0.9%氯化钠注射液、5%葡萄糖注射液配伍时,≥10 μm的微粒在配伍后的4 h内是符合2010年版《中国药典》规定的;而4~8 h其不溶性微粒均呈上升趋势。而2种配伍液中≥10 μ m的微粒在配制时就超出了2010年版《中国药典》规定,≥25 μ m的微粒也在配制4 h后超出了2010年版《中国药典》规定,且所有微粒数在配伍2 h后,均呈增加的趋势。因此不建议注射头孢美唑钠与热毒宁注射液、注射用丹参多酚酸盐配伍使用。
表2 配伍液在0.9%%氯化钠注射液中的pH值、不溶性微粒数的测定结果(±s, n=3)Tab 2 Determination of pH value and the number of insoluble particles of mixture in 0.9%%Sodium chloride injection(±s, n=3)
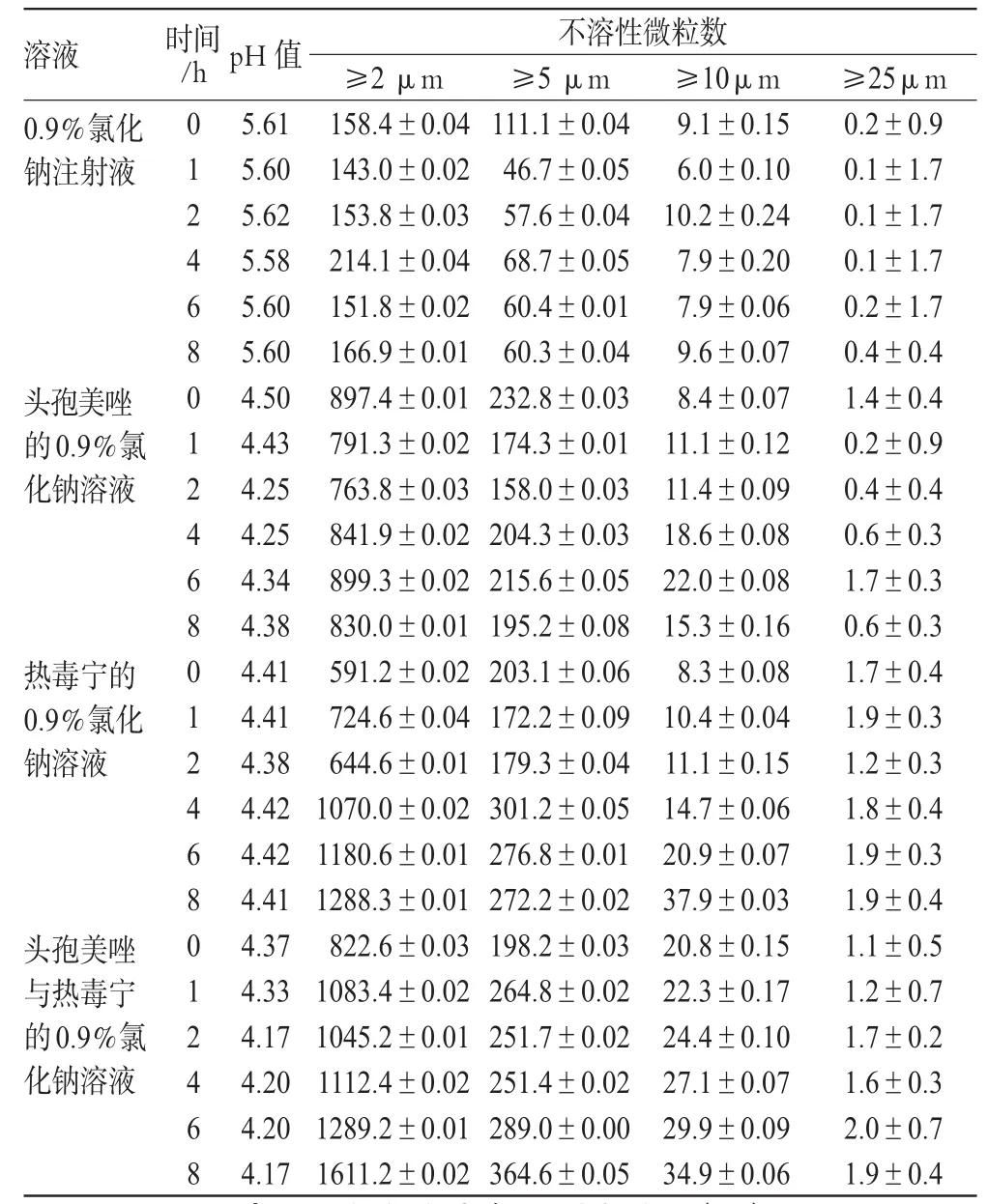
表2 配伍液在0.9%%氯化钠注射液中的pH值、不溶性微粒数的测定结果(±s, n=3)Tab 2 Determination of pH value and the number of insoluble particles of mixture in 0.9%%Sodium chloride injection(±s, n=3)
溶液0.9%氯化钠注射液头孢美唑的0.9%氯化钠溶液热毒宁的0.9%氯化钠溶液头孢美唑与热毒宁的0.9%氯化钠溶液时间/h 012468012468012468012468 pH值5.615.605.625.585.605.604.504.434.254.254.344.384.414.414.384.424.424.414.374.334.174.204.204.17不溶性微粒数≥2 μm 158.4±0.04143.0±0.02153.8±0.03214.1±0.04151.8±0.02166.9±0.01897.4±0.01791.3±0.02763.8±0.03841.9±0.02899.3±0.02830.0±0.01591.2±0.02724.6±0.04644.6±0.011070.0±0.021180.6±0.011288.3±0.01822.6±0.031083.4±0.021045.2±0.011112.4±0.021289.2±0.011611.2±0.02≥5 μm 111.1±0.0446.7±0.0557.6±0.0468.7±0.0560.4±0.0160.3±0.04232.8±0.03174.3±0.01158.0±0.03204.3±0.03215.6±0.05195.2±0.08203.1±0.06172.2±0.09179.3±0.04301.2±0.05276.8±0.01272.2±0.02198.2±0.03264.8±0.02251.7±0.02251.4±0.02289.0±0.00364.6±0.05≥10μm 9.1±0.156.0±0.1010.2±0.247.9±0.207.9±0.069.6±0.078.4±0.0711.1±0.1211.4±0.0918.6±0.0822.0±0.0815.3±0.168.3±0.0810.4±0.0411.1±0.1514.7±0.0620.9±0.0737.9±0.0320.8±0.1522.3±0.1724.4±0.1027.1±0.0729.9±0.0934.9±0.06≥25μm 0.2±0.90.1±1.70.1±1.70.1±1.70.2±1.70.4±0.41.4±0.40.2±0.90.4±0.40.6±0.31.7±0.30.6±0.31.7±0.41.9±0.31.2±0.31.8±0.41.9±0.31.9±0.41.1±0.51.2±0.71.7±0.21.6±0.32.0±0.71.9±0.4
表3 配伍液在5%%葡萄糖注射液中的pH值、不溶性微粒数的测定结果(±s, n=3)Tab 3 Determination of pH value and the number of insoluble particle of mixture in 5%%Glucose injection(±s, n=3)

表3 配伍液在5%%葡萄糖注射液中的pH值、不溶性微粒数的测定结果(±s, n=3)Tab 3 Determination of pH value and the number of insoluble particle of mixture in 5%%Glucose injection(±s, n=3)
溶液5%葡萄糖注射液头孢美唑的5%葡萄糖溶液丹参多酚酸盐的5%葡萄糖溶液头孢美唑与丹参多酚酸盐的5%葡萄糖溶液时间/h 012468012468012468012468 pH值4.374.454.344.334.264.164.504.474.404.304.204.244.774.684.574.534.504.474.674.534.504.464.434.26不溶性微粒数≥2 μm 53.8±0.0454.9±0.0360.8±0.0574.9±0.03124.9±0.07110.1±0.03672.0±0.01651.2±0.05608.2±0.01622.1±0.01690.6±0.03809.2±0.02360.2±0.02399.8±0.02402.4±0.02390.1±0.01465.9±0.01876.1±0.03831.8±0.02837.6±0.02829.4±0.02942.3±0.05821.8±0.02870.2±0.01≥5 μm 12.8±0.058.9±0.2119.0±0.0922.7±0.0437.2±0.1437.3±0.09173.2±0.01154.1±0.06134.7±0.02142.0±0.12182.4±0.02215.9±0.0191.4±0.04116.8±0.09104.4±0.01109.4±0.07127.0±0.06219.6±0.04198.7±0.03216.9±0.05196.8±0.77264.1±0.08205.7±0.06234.0±0.02≥10 μm 2.2±0.090.9±0.222.0±0.173.1±0.067.6±0.137.7±0.049.9±0.0811.0±0.0311.8±0.1420.0±0.2431.4±0.0735.6±0.067.7±0.0810.4±0.0711.8±0.0617.1±0.0818.3±0.0722.4±0.0727.0±0.0627.6±0.0526.7±0.1131.4±0.7930.6±0.0741.4±0.13≥25 μm 0.0±0.000.3±0.000.4±0.430.2±0.870.2±0.870.1±1.730.8±0.650.4±0.870.4±0.870.8±0.251.9±0.571.7±0.200.2±1.730.3±1.000.7±0.000.9±0.221.0±0.331.0±0.670.4±0.430.8±0.251.0±0.581.4±0.271.9±0.272.4±0.28
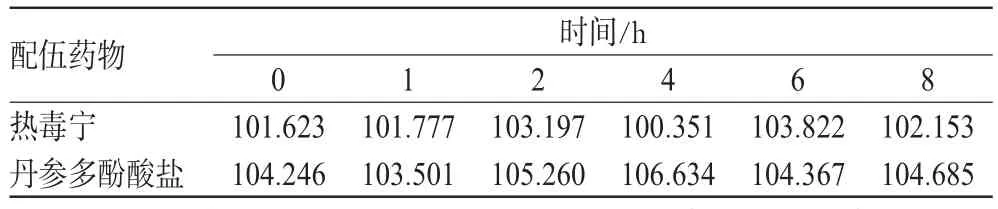
表4 头孢美唑含量测定结果(%%)Tab 4 Results of content determination(%%)
[1]黄兆好,谢翠刁.先锋美他醇的药理与临床应用[J].广东药学,2000,10(1):39.
[2]张春然,唐克慧.头孢美唑钠的质量与稳定性研究[J].国外医药-抗生素分册,2005,26(1):5.
[3]国家药典委员会.中华人民共和国药典(二部)[S].北京:中国医药科技出版社,2010:附录ⅥH、ⅨR.
[4]边 原,何 林,夏祺悦.反相高效液相色谱法测定注射用头孢美唑钠的含量[J].药物鉴定,2010,19(5):26.
[5]徐玉红,梁佳辉.HPLC法测定头孢美唑钠的含量[J].黑龙江医药,2008,21(1):4.
[6]赵 静,范 淼.RP-HPLC法测定注射用头孢美唑钠含量及有关物质[J].河北化工,2010,33(11):57.

