我院药品说明书现状调查及其相关风险分析
刘敏豪,邬倩倩(1.广州中医药大学附属中山市中医院,广东中山58400;.广东药学院,广州510006)
为解决“一药多名”的问题,规范药品说明书和标签,指导公众正确、合理、安全用药,2006年3月15日国家食品药品监督管理局颁布了《药品说明书和标签管理规定》[1],对药品说明书撰写作出详细要求。《药品说明书和标签管理规定》的深入执行以及国家不良反应监测完善发展,督促了各药品生产厂家及时地为经营品种修改药品说明书,使其修改变得频繁。药品说明书的频繁修改及其他因素为医疗机构用药行为构成了新的风险。笔者通过调查广州中医药大学附属中山市中医院(下简称我院)第一门诊经营药品的药品说明书现状,结合其销售量以及日常工作中遭遇的用药行为进行分析,探讨在近几年药品说明书监控体系发展、完善过程中对医疗机构可能增加、激化的各种风险,以推动药品说明书归档管理。
1 我院药品说明书现状
1.1 药品说明书修改频繁
笔者在2010年11月-2011年1月随机收集了我院第一门诊使用的药品说明书25份,对其所标示的“核准日期”、“修改日期”和修改日期数进行统计分析,我院药品说明书修改年份与次数统计结果见表1。
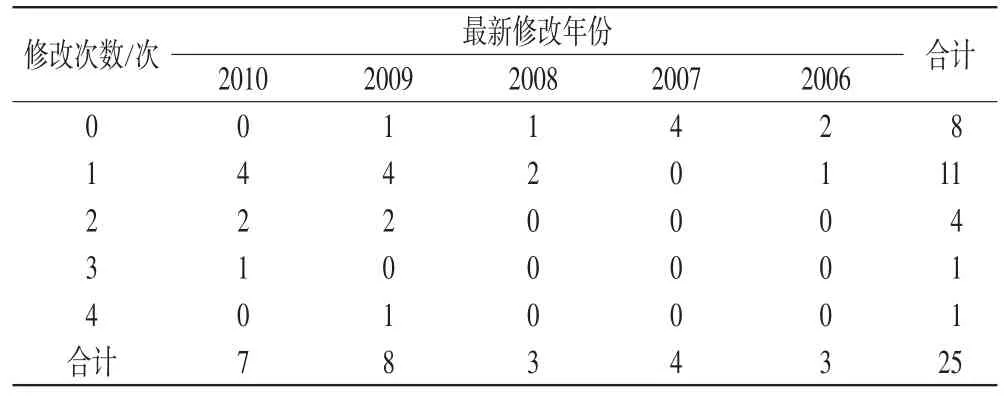
表1 我院药品说明书修改年份与次数统计结果Tab 1 Modification year and frequency chart of package inserts in our hospital
如表1所示,修改年份指最近一次修改的年份,0次代表核准日期。如调查中发生过1次修改的品种,其最近修改年份在2010年有4个品种,2009年4个品种,2008年2个品种,2006年1个品种,故调查中仅出现1次修改的品种有11种。同理,最近修改年份发生在2010年的7个品种中,第1次修改有4个品种,已有第2次修改的有2个品种,还有1个品种已修改过2次,这次为第3次修改。因此,由表1可见,在近2年内(2009-2010年)药品说明书发生修改的品种有15种,占样本总数的60%;2006-2010年间发生过1次修改的有11种(44%);各有1个品种出现过3次和4次修改;0次修改的有6个品种,为近5年才上市的新药。
1.2 不同厂家同品种药品的药品说明书存在差异
笔者在调查中发现,尽管国家对药品说明书的格式和必备项目有一定的要求,但是由于生产厂家之间技术水平的差异,不同厂家同品种的药品说明书可能不完全相同,其中“禁忌证”及“注意事项”等项目的差异应该引起重视。例如,我院使用的口服甲泼尼龙片有进口的“美卓乐”和国产的“尤金”,二者在“禁忌证”的描述上存在明显差异:美卓乐描述为“全身性真菌感染,已知对甲泼尼龙片或甲泼尼龙过敏者,相关禁忌人群(儿童,糖尿病患者、高血压患者和有精神病史的患者,传染性疾病、病毒性疾病患者)”,而尤金的描述仅为“对糖皮质激素过敏者,全身性真菌感染者”。
1.3 高风险药品的药品说明书不够详细
本次调查中,笔者发现部分使用性能不够明确的药品,如中药注射剂、上市时间较短的新药,其药品说明书不够详细,其中“不良反应”、“禁忌证”和“特殊人群(儿童、孕妇及老年人)用法”经常标示为“未知”。例如,山西晋新双鹤药业有限责任公司生产的香丹注射液的药品说明书中“不良反应”、“禁忌证”和“注意事项”的描述均为“尚不明确”,未提及特殊人群的用法、用量;华北制药股份有限公司生产的注射用葛根素的药品说明书中“药物过量”记载为“无相关资料”,在“特殊人群用法”中,则使用“尚未清楚,不建议使用和慎用”等表述;雅安三九药业有限公司生产的参麦注射液的药品说明书中“药物相互作用”一栏中为“尚无本品与其他药物相互作用的信息”,也没有提及特殊人群的用法、用量。
2 医疗机构忽视药品说明书管理可致的风险
国家相关法规对药品说明书进行监控,国家不良反应机构促使药品说明书修改及其记载的信息频繁变化。如果医疗机构未能充分掌握现有信息、及时跟上修改进度、掌握最新的修改信息,将会为医疗机构带来各样的风险,具体如下。
2.1 法律风险
在医疗纠纷仲裁标准中(现版教材、《中国药典临床用药须知》、药品说明书),最不稳定的为药品说明书,且其往往又是最主要的裁决依据[2],具有重要的法律作用[3]。医疗机构若不能及时掌握药品说明书的变化以及经营品种之间的差异,容易导致超药品说明书使用药品。“超药品说明书用法”(Unlabeled uses,Off-label uses,Out-of-label usage或 Out-side of labeling)是指“药品使用的适应证、给药方法或剂量不在国家批准的药品说明书之内的用法”[4]。“超药品说明书用法”在我国并无确切的定义,也少见相关领域的研究,但不按照药品说明书使用药品在门诊调剂工作中相当常见。由于现时我国对“超药品说明书用法”尚无明确立法,故“超药品说明书用法”在没有受到国家法律法规约束的同时,也没得到国家法律法规的保护。从严格的法律角度来看,“超药品说明书用法”对医疗机构来说只存在风险,不存在效益。但在我国,即使是合理的“超药品说明书用法”在原则上也缺乏法律支持,这令医疗机构于近年涉及“超药品说明书用法”医疗纠纷中处于相当不利的位置[5]。笔者调查发现,我院广泛使用的苯磺酸氨氯地平,其国产品种与进口品种的“禁忌证”描述存在明显差异:国产品种(丽珠优可)的“禁忌证”为“对二氢吡啶类药物或本品中任何成分过敏的患者,严重低血压、重度主动脉瓣狭窄患者禁用”;进口品种(络活喜)的“禁忌证”则为“对二氢吡啶类药物或本品中任何成分过敏患者禁用”。在其他品种的调查中,笔者发现口服硝苯地平制剂的“禁忌证”描述也存在类似的情况:山东方明药业股份有限公司生产的硝苯地平片的“禁忌证”为“对硝苯地平过敏者禁用”;广东环球制药有限公司生产的硝苯地平缓释片(圣通平)为“尚不明确”;德国拜耳医药保健有限公司生产的硝苯地平控释片(拜新同)则较为详细:“禁用已知对硝苯地平或本品中任何成分过敏者;心源性休克;有KOCK小囊(直肠结肠切除后作回肠造口)的患者;由于酶诱导作用,与利福平合用时,其达不到有效血药浓度,故不可与利福平合用,仅用于怀孕20周内和哺乳期妇女。”药品说明书的差异容易为医疗机构及广大医务人员所忽视,也少见相关应对策略,而其潜在的法律风险却是显而易见。假设有非专科医师单凭进口品种(络活喜)药品说明书描述的“禁忌证”(“对二氢吡啶类药物或本品中任何成分过敏患者禁用”)为重度主动脉瓣狭窄患者开具国产品种(丽珠优可)治疗高血压,将可能导致医疗纠纷甚至医疗事故。在日常工作中,笔者也常遇到由于病情或者经济原因,考虑在同一成分的进口、国产品种转换的患者,也曾解答过由相关差异所引发的疑问。为规避法律风险以及治疗风险,笔者的答疑一般会倾向遵从药品说明书,故有时会导致患者放弃品种转换。
2.2 治疗风险
在日常工作中,医疗机构往往需要使用一些使用性能不够明确的药品。目前我国化学药品说明书撰写依据主要是引用外国文献,即针对西方人人种的生理数据和实验动物数据;中药注射液的说明书主要是参考实验动物数据[6]。这与实际使用人群将存在相当的差异,因此药品需要在上市后实施质量监控(厂家的监控、政府的监控)来继续确立药品的安全性,以此为依据进一步完善药品说明书。笔者选取我院6种常用抗组胺药物,对其药品说明书中的“禁忌证”、“儿童用药”、“老人用药”、“孕妇及哺乳期妇女用药”、“药物相互作用”5个项目进行比较,详见表2(其中,“+”为存在相关的描述,“-”为“尚不明确”或欠缺相关项目)。
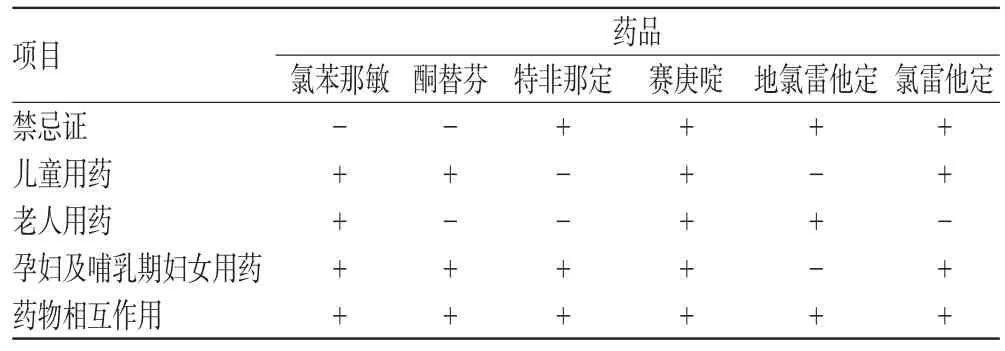
表2 我院6种常用抗组胺药物药品说明书的部分项目比较Tab 2 Comparison of some items of package inserts of 6 kinds of common antihistamines in our hospital
由表2可见,地氯雷他定在上述项目中的药物性能信息较少。在具体的药品说明书的相关项目中,药物性能信息详细程度与其上市时间有关。但笔者发现在日常工作中,可能由于各种复杂的因素影响,医师一般倾向使用新药,导致其使用率大大提高。笔者对上述6种常用抗组胺药物于2010年11月-2011年1月在第一门诊的销售量进行统计,详见表3。
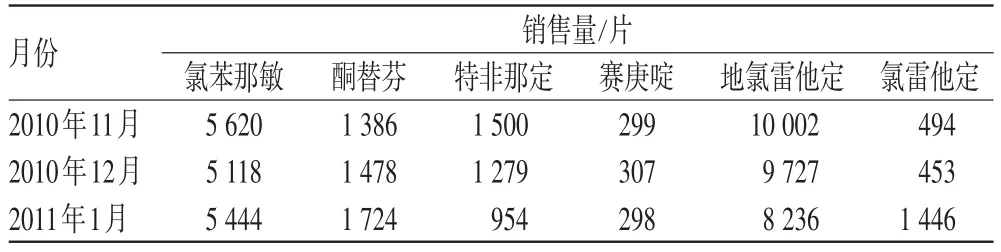
表3 我院6种常用抗组胺药物的销售量统计结果Tab 3 Sales amount of 6kinds of common antihistamines in our hospital
由表3可见,地氯雷他定的销售量明显高于其他品种。药品的使用历史越长,人们对其性能的了解才能越透切全面,才能知道如何规避用药风险,才能将药物的使用风险降到最低,这样的品种无疑更显得安全可靠;反之,将提高药物治疗风险。诚然,地氯雷他定、氯雷他定、特非那定在药效性能方面较之旧药(氯苯那敏)均有较大的提高,但其药品说明书信息不及旧药(氯苯那敏)详细完善,意味着人们对这些药物的性能掌握远远不及旧药。当相关的监控不理想时,药品的使用频率越高,所致的风险越大,加上可能出现的“超药品说明书用法”,将进一步加大药物治疗风险。譬如,笔者注意到地氯雷他定的药品说明书中“儿童用药”描述为“对12岁以下儿童患者的疗效和安全性尚未明确。”但日常工作中,偶见此药用于12岁以下儿童。另一方面,基于上述各种原因,即使新药的药品说明书信息再详细,仍应该对其抱持怀疑态度。同时,医疗机构应该注意收集分析此类品种的相关情报及行政指令,以便在最短时间内作出相关应对。总的来说,笔者认为最大程度规避药物治疗风险,应避免频繁使用新药,应慎重使用新药,比如“尼美舒利”就给我们上了经典的一课。
2.3 经济风险
越来越多医师意识到药品说明书于医疗纠纷中的地位,故药品说明书的修改信息(修改信息基本都是负面的)往往导致相关药品滞销。我院使用的注射用头孢替安的药品说明书著述此品种“最好在注射前做皮肤敏感试验(下简称皮试)”,而我院于2010年12月18日根据该药的说明书发布了关于使用该品种前进行皮肤过敏试验的要求,以确保该药的使用安全。利用Excel表对数据进行统计后得出我院2010年7月-2011年1月注射用头孢替安销售量频率如图1。
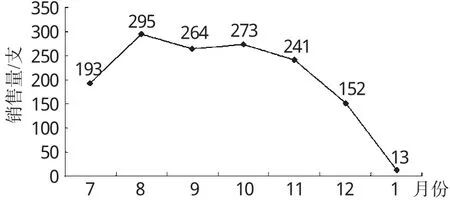
图1 我院2010年7月-2011年1月注射用头孢替安销售量频率图Fig 1 Frequency chart of sales amount of Cefotiam for injection in our hospital during Jul.2010-Jan.2011
由图1可见,我院第一门诊在2010年维持一定数量地使用注射用头孢替安,但是在2010年12月开始,该产品的使用量剧减。引起该品种销售量下滑的原因可能是我院关于此药用前皮试的要求,在一定程度上向医师暗示其存在一定的使用风险,从而导致医师尽量避免使用该品种而使其使用量剧减。在滞销状态下的该品种最后的处理办法,可能是待到期后全部报废,这将为医院带来经济损失。
3 建立药品说明书档案
医疗机构应针对药品说明书现况中的不利因素,建立、健全以药品说明书建档管理为主要手段的应对策略及相应的管理方法,以规避药品说明书带来的风险。可以考虑从以下几方面入手。
3.1 保存所有经营品种药品说明书
收集所有经营药品品种的药品说明书,对其进行详细审核,建立相应数据库,制定相应办法进行监视。
3.2 对比药品说明书
对药品说明书进行对比,当“禁忌证”、“不良反应”、“用法用量”、“注意事项”等敏感项目出现异常者,及时上报医院相关主管部门;可考虑根据相关药品说明书差异作出评价,为选购时提供参考:(1)对比同一品种新、旧厂家的药品说明书;(2)对比同一品种不同厂家药品说明书;(3)对比同一品种不同批次药品说明书。
3.3 重点监视药品说明书
对使用量大及销售量大的药品的药品说明书作重点监视。
3.4 及时提供药品说明书的信息
要求相关生产厂家及药品经销商及时提供其供应品种的药品说明书修改情报。
3.5 其他
对于性能信息不够详细的高风险品种药品,注意收集国家主管部门的相关医药情报及行政指令;针对生产厂家于国家行政指令的反应速度为厂家作评分,留作选购时参考。
4 结论
综上所述,说明书归档管理对减少医疗机构的相关风险的发生具有积极作用。
但由于药品说明书归档管理难以为医疗机构带来直接收益,故开展医疗机构药品说明书档案管理在缺乏现成的执行办法、标准以及技术支援的同时,也难以得到发展所需要的各样资源投入,这导致医疗机构药品说明书的管理方法、应对策略的建立与完善之路变得漫长而艰巨。
[1]国家食品药品监督管理局.药品说明书和标签管理规定[S].国家食品药品监督管理局令第24号,2006.
[2]陈 苏,邓利强,刘长文,等.药物说明书、药典、教科书、指南均涉及药物应用规范临床用药到底有没有“金标准”?[N].中国社区医师,2009-12-01.
[3]徐 蓉.浅析药品说明书的法律地位[J].中国处方药,2007,8(65):38.
[4]黄 亮,申向黎,陈 力,等.正确认识并有效规范超说明书用药行为[J].中国医院药学杂志,2009,29(11):949.
[5]刘 宇.药品说明书之外用法的法律风险提示及对策建议[J].协和医学杂志,2010,1(1):117.
[6]李功戌.中药新药临床安全性评价[J].中药新药与临床药理,2005,16(1):3.

