乳酸提取柠檬皮果胶的工艺
刘义武,孔昭华,王碧,*
(1.内江师范学院化学化工学院,四川 内江 641100;2.果类废弃物资源化省高校重点实验室,四川 内江 641100)
果胶是主要由D-半乳糖醛酸以α-1,4-糖苷键连接聚合而成、呈线性结构的多聚糖类[1-3]。果胶作为一种水溶性膳食纤维,不仅是一种良好的功能性配料,而且还是一种富有营养健康价值的直接食用成分,被广泛应用于食品、化妆、医药等工业[1-6]。果胶被世界称为“人体健康的平衡素”,是人体健康不可或缺的健康因子。果胶分子的结构取决于果胶提取原料的种类、组织类型和提取工艺等[1]。随着人们保健意识的进一步增强,果胶越来越受到研究与加工行业的青睐。据不完全统计,近年我国果胶的年消耗4000 t以上,并以每年4%~5%的速度增长,80%依靠进口,其中柠檬果胶约2000t完全依靠进口。因此,大力开展果胶,特别是柠檬果胶的研究与开发,探索提高果胶产量和质量的新方法和新工艺,不仅能为我国食品加工领域广泛地应用优质果胶提供理论依据,而且将推动国产果胶生产的发展。
果胶原料的来源非常广泛,已报道的提取果胶原料超过40种[7-8],但当前真正具有工业提取价值的是苹果渣和柑橘类果皮[9-10]。国内生产果胶主要是柑桔果胶和苹果果胶,柠檬果胶几乎没有。虽然柠檬皮渣中果胶的含量高达30%[11],是优质的果胶工业生产原料,但国内从柠檬皮渣中提取果胶的报道甚少[12]。目前柠檬皮渣基本上被废弃,并且皮渣极易发霉变臭,对人畜和农作物都极为有害。采用有机酸——乳酸提取柠檬皮中的果胶,以期得到一种优化的用于提取柠檬皮中果胶的工艺,提高柠檬的综合利用价值。
1 材料与方法
1.1 材料与仪器
柠檬购自四川安岳;乳酸、95%乙醇、无水乙醇、氢氧化钠,均为分析纯。
WT5002K电子天平:江苏常州万泰天平仪器有限公司;AE240电子分析天平:中国梅特勒一托利多仪器有限公司;DF-101S集热式恒温加热磁力搅拌器:金坛市医疗仪器厂;PHS-10A数字式pH计:上海日岛科学仪器有限公司;TDL-5A低速大容量离心机:上海安亭科学仪器厂。
1.2 方法
1.2.1 工艺流程
柠檬皮预处理→酸液萃取→趁热离心分离→加醇沉析→抽滤→洗涤→干燥、粉碎→成品
1.2.2 果胶提取
1.2.2.1 柠檬皮预处理
取新鲜柠檬若干,洗净后剥下柠檬皮,将剥下的柠檬皮洗净后切成1 cm左右的小块置于100℃沸水中煮沸5 min,去除果皮中的果胶酶以及还原性可溶糖,用清水漂洗至无色,65℃烘干,粉碎。
1.2.2.2 果胶的提取
准确称取5.00 g经预处理的柠檬皮粉末,加入适量水,用乳酸调节pH为2.0~3.0左右,在80℃~100℃下,萃取1 h~3 h,使原果胶转化为可溶性果胶。趁热将浆状液体置于离心机中离心,收集上清液;用蒸馏水洗涤残渣,将洗液离心,收集上清液,合并上清液。在搅拌下将95%乙醇加入冷至室温的果胶浓缩液中,控制乙醇含量50%左右,果胶呈絮状凝结析出。沉淀物静止后,用真空泵抽滤,用75%乙醇洗涤2次~3次,50℃烘干即得果胶成品。
1.2.3 正交试验
在对单因素分析和实验的基础上,采用L9(34)的正交试验设计,对影响果胶提取效果的主要因素:pH、提取温度、提取时间、液固比进行研究(见表1),以果胶提取率为考察主要指标,确定最佳工艺参数。
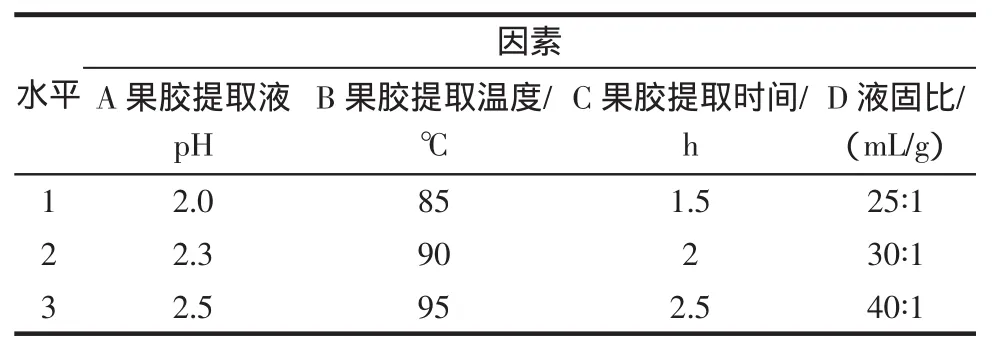
表1 果胶提取实验因素水平表Table 1 Factors and levels table of extracting pectin
1.2.4 果胶提取率和果胶纯度测定方法
果胶中半乳糖醛酸含量、酯化度按GB 25533-2010《食品添加剂果胶》中方法进行。果胶提取率的计算公式如下:
果胶提取率/%=果胶质量×100/柠檬皮粉末质量
2 结果与讨论
2.1 单因素试验结果与分析
2.1.1 pH对果胶提取率的影响
pH对果胶提取率的影响,见图1。

图1 pH对果胶提取率的影响Fig.1 Effect of the pH value on extraction rate of pectin
从图1可知,提取液的pH对果胶提取率的影响非常明显,果胶提取率随pH降低而增加较大,这主要是由于原果胶水解逐渐变强的原因。pH低于2时,乳酸(pka=2.5)的使用量迅速增加,提高果胶生产成本并增加了后处理难度。此外,pH过低,原果胶过度水解,致使果胶脱酯和裂解,使沉淀物外观色泽不合要求;pH过高,原果胶水解不完全,产量低。最佳pH应控制在2.0~2.2左右。
2.1.2 提取温度对果胶提取率的影响
提取温度对果胶提取率的影响,见图2。

图2 提取温度对果胶提取率的影响Fig.2 Effect of extraction temperature on extraction rate of pectin
由图2可知,随着温度升高,果胶提取率增大,当温度达到95℃后,随温度升高,提取率变化很小。这是因为温度较低时,果胶水解不充分,从而导致提取率较低,但温度过高,高温对果胶结构的破坏作用大于果胶溶出速率,造成提取率有所下降。此外,温度过高对果胶胶凝度也有影响,温度宜控制在90℃~95℃。
2.1.3 提取时间对果胶提取率的影响
提取时间对果胶提取率的影响,见图3。

图3 提取时间对果胶提取率的影响Fig.3 Effect of extraction time on extraction rate of pectin
图3表明,随着水解时间的延长,果胶提取率先迅速的增大后减小,当水解时间为2.5 h时果胶提取率最高。时间太短,柠檬中的果胶不能被完全提取出来,使果胶提取率偏低;时间过长,果胶继续水解,生成果胶酸,果胶提取率也偏低,同时还增加了试验能耗。果胶的纯度随着提取时间的延长略有降低,果胶的纯度在80%~83%之间,远高于GB 25533-2010《食品添加剂果胶》中纯度(≥65%)要求,也高于美国药典USP 32-NF27中果胶纯度(≥74%)要求。所以最佳水解时间为2 h左右。
2.1.4 液固比对果胶提取率的影响
液固比直接影响可溶性果胶能否充分转移到液相,同时也影响浸取液过滤的速度,以及蒸发浓缩时的能耗。不同液固比条件下果胶提取率如图4所示。

图4 液固比对果胶提取率的影Fig.4 Effect of liquid-to-solid ratio on extraction rate of pectin
由图4可以看出,液固比在30∶1(mL/g)时提取率最高,液固比过低,难以保证原料中的果胶质全部转移到提取液中,提取不完全,产率低;液固比过大,溶液中的果胶浓度低,乙醇消耗量大,后续处理时会提高操作的能耗和费用,造成不必要的浪费[12]。图4也表明液固比对果胶的纯度影响很小。因此,液固比选择30∶1 为宜。
2.2 正交试验结果与分析
为了得到乳酸提取柠檬皮果胶的最优提取工艺,进行了L9(34)正交试验,提取率的正交试验见表2。

表2 正交试验结果Table 2 The results of orthogonal experiments
由表2可以看出,各因素对柠檬果胶提取率影响的顺序为:B>A>D>C,即提取温度>提取酸度(pH)>液固比>提取时间。根据极差分析,其最优组合为B3A1D3C3,即第 3组:提取温度 95 ℃,pH 2.0,液固比40∶1,提取时间2.5 h,该组合的提取率24.8%。但由于液固比、时间对果胶提取率的影响较小,适当降低液固比和提取时间,能提高提取效率和后期浓缩的效率,液固比可选用30∶1,提取时间可选用2 h。因此,最优组合为:B3A1D2C2,即提取温度95℃,pH 2.0,液固30∶1,提取时间 2 h,3次果胶平均提取率 23.8%,酯化度(果胶分子中酯化的半乳糖醛酸单体占全部半乳糖醛酸单体的百分比)72.7%,属于高酯快凝果胶。
3 结论
经单因素试验和正交试验,得到乳酸提取柠檬皮果胶最佳工艺条件为:pH 2.0,温度95℃,时间2 h,液固比30∶1,果胶提取率23.8%,酯化度72.7%。乳酸提取果胶色泽浅,实验范围内可以不脱色,简化了工艺,降低了生产成本,工艺稳定可行。
[1]Round A N,Rigby N M,MacDougall A J,et al.A new view of pectin structure revealed by acid hydrolysis and atomic force microscopy[J].Carbohyd Res,2010,345:487-497
[2]Willats W G T,Knox P,Mikkelsen J D.Pectin:new insights into an old polymer are starting to gel[J].Trends Food Sci Tech,2006,17:97-104
[3]RidleyBL,O'NeillMA,MohnenDA.Pectins:structure,biosynthesis,and oligogalacturonide-related signaling[J].Phytochemistry,2001,57:929-967
[4]Voragen A G J,Coenen G J,Verhoef R P,et al.Pectin,a versatile polysaccharide present in plant cell walls[J].Struct Chem,2009,20:263-275
[5]Mishra R K,Datt M,Banthia K.Synthesis and characterization of pectin/PVP hydrogel membranes for drug dlelivery system[J].Aaps Pharmscitech,2008,9:395-403
[6]Conrad K.Correlation between the distribution of lignin and pectin and distribution of sorbed metal ions(lead and zinc)on coir(Cocos nucifera L.)[J].Bioresource technol,2008,99:8476-8484
[7]徐汶,张俊峰,王存文,等.豆腐柴叶果胶的提取工艺条件研究[J].天然产物研究与开发,2003,15(2):138-140
[8]韦诗琪,郭璇华.菠萝蜜丝果胶提取工艺优化[J].食品研究与开发,2011,32(6):61-64
[9]May C D.Industrial Pectins-Sources,Production and Applications[J].Carbohyd Polym,1990,12:79-99
[10]May C D.Pectins.In:Imeson,A.(Ed.),Thickening and Gelling Agents for Foods[M].second edition.Aspen Publishers,Maryland,1999:231-261
[11]魏海香,木泰华,孙艳丽,等.果胶制备的研究进展[J].食品研究与开发,2006,27(4):157-160
[12]徐丹,车振明,胡瑞君,等.柠檬皮中高酯果胶提取工艺的研究[J].食品工业科技,2007,28(6):182-184,194

