高效液相色谱法测定果酱中VC含量
王坤,王学楠,刘朝麾,张金鹏
(天津市质量监督检验站第四站,天津 300462)
抗坏血酸(ascorbic acid),又称 VC,是维持机体正常生理代谢的一种重要的有机化合物,具有良好的营养价值,人体严重缺乏时会引起坏血病[1]。但是由于人体自身不能合成VC而必须从食物中摄取,近年来,其作为一种保健功能因子,已经被广泛添加于各种食品中,因此食品中VC含量的测定方法引起了广泛的研究[2]。常用的测定方法有2,6-二氯靛酚滴定法、荧光光度法、2,4-二硝基苯阱比色法等[3]。由于VC具有还原性,容易受空气、光、热、氧化剂等因素的影响[4],上述方法在灵敏度和准确性方面都偏低。目前,对果酱中VC含量测定方法的研究比较少,为此,本文采用高效液相色谱法对果酱中VC含量进行检测,简化了样品前处理步骤,操作简便、快速,具有良好的灵敏度和准确性。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
Agilent 1200 LC高效液相色谱仪,配二极管阵列检测器及色谱工作站:美国Agilent公司;XP 504电子分析天平:精确至0.0001 g,瑞士METTLER公司;GLD-136真空泵:ULVAC KIKO Inc;SB-5200型超声波清洗器:上海必能信超声有限公司;MILLI-QA超纯水器:密里博公司;QL-901旋涡混合仪:海门市其林贝尔仪器制造有限公司。
1.1.2 试剂
甲醇(色谱纯):天津市康科德科技有限公司;冰乙酸(分析纯):天津市天新精细化工开发中心;抗坏血酸(纯度99.0%):购自德国Dr.Ehrenstorfer公司。
1.2 色谱条件
Kromasil 100A C18色谱柱(4.6 mm×250 mm,5μm,天津市特纳迪奥色谱技术有限公司);流动相为0.1%乙酸水溶液∶甲醇=95∶5(体积比);柱温:25 ℃;检测波长:246 nm;流速:0.8 mL/min;进样量:20μL。
1.3 标准溶液的配制
1.3.1 标准储备液
准确称取10 mg(精确到0.1 mg)VC标准品于10 mL棕色容量瓶中,用水完全溶解并定容至刻度,配制成浓度为1 mg/mL的标准储备液,当天配制,需4℃冰箱保存。
1.3.2 标准工作溶液
准确吸取VC标准储备液2.5 mL于25 mL棕色容量瓶中,用水稀释定容至刻度,得到浓度为100 mg/L的标准中间液。分别吸取 0.20、0.50、1.00、2.50、5.00 mL的VC标准中间液于50 mL的棕色容量瓶中,用水稀释并定容至刻度,配制成浓度为 0.4、1.0、2.0、5.0、10 mg/L系列标准工作溶液。
1.4 样品处理
称取约0.5 g试样于50 mL容量瓶中,用水溶解稀释,超声振荡5 min,用水定容至刻度。再吸取1 mL混合溶液于5 mL容量瓶中,用水稀释定容至刻度,0.45μm微孔滤膜过滤,供HPLC进行检测。
2 结果与讨论
2.1 流动相的选择
考虑到VC的特性,在中性和弱酸性条件下较稳定,本试验考察了甲醇-水、甲醇-0.1%乙酸水溶液作为流动性体系,发现VC在酸性流动相的条件下的保留效果和峰形较好,于是又对甲醇与0.1%乙酸水溶液的比例 5∶95,8∶92,10∶90 分别进行比较。试验发现,随着甲醇含量的增加,VC目标峰的峰形更加尖锐对称,但保留时间逐渐缩短,这不利于复杂基体与待测组分的有效分离,因此综合考虑,选择甲醇与0.1%乙酸水=5∶95为最终流动性体系,此时各基质组分能达到基本分离,保留时间为4.1 min。
2.2 样品提取溶液的选择
考虑到VC的水溶性和不稳定性,试验选择水、0.1%乙酸水和0.1%甲酸水溶液做样品提取溶液,分别对添加浓度为0.8 mg/kg的果酱样品进行提取,3份平行,比较两三种提取液的提取效果。试验表明,当用0.1%乙酸水和0.1%甲酸水溶液做提取液时,样品的添加回收率在112%~117%和110%~119%之间,存在明显的基质干扰作用。当用水做样品提取溶液时,样品的添加回收率在105%~110%,基质干扰作用明显降低,因此本试验最终选择水溶液作为果酱样品的提取溶液。
2.3 样品溶液稀释倍数的选择
本试验考察了不同稀释体积对样品回收率的影响。试验称取0.5 g添加浓度为0.8 mg/kg的果酱样品,3份平行,用水溶液稀释定容至50 mL,直接进样,得到样品的回收率为130%~139%。为降低基质干扰效应对回收率的影响,实验再分别吸取1、2、2.5 mL样品稀释液于5 mL容量瓶中,用水定容至刻度,混匀后直接进样。经仪器检测,得到样品的添加回收率在102%~105%、104%~114%和108%~115%之间,并且稀释5倍的样品溶液在仪器检测中得到的色谱图比稀释2.5倍和2倍的基线稳定,同时待测组分与基质得到了良好的分离。因此,为保证结果准确,试验选择将定容后的样品溶液稀释5倍后再进行色谱分析。
2.4 方法性能指标
2.4.1 线性范围和方法的检出限
在选定的色谱条件下,按照1.3.2中配制的标准工作溶液进行检测,以峰面积对浓度进行线性回归,所得线性方程为y=53.50753x-17.1079,相关系数r2=0.9984。结果表明,VC在0.4 mg/L~10 mg/L浓度范围内线性关系良好。以3倍基线噪音所对应的浓度计算,本方法的检出限为30μg/L,具有很高的检测灵敏度。
标准溶液和样品中VC的色谱图分别见图1和图2。
2.4.2 方法的精密度和准确度
在果酱样品种分别添加200.0、400.0、800.0 mg/kg三个浓度水平的VC标准溶液,进行添加回收实验,按照1.4中的操作步骤平行测定,每个浓度重复5次,结果见表1,本法对果酱样品中VC的平均加标回收率为97.4%~107.5%,相对标准偏差(RSD)不大于2.54%,满足食品检测的要求。
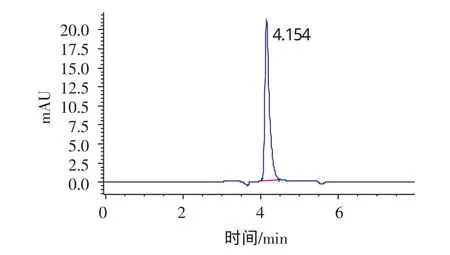
图2 果酱样品色谱图Fig.2 Chromatogram of Jam sample
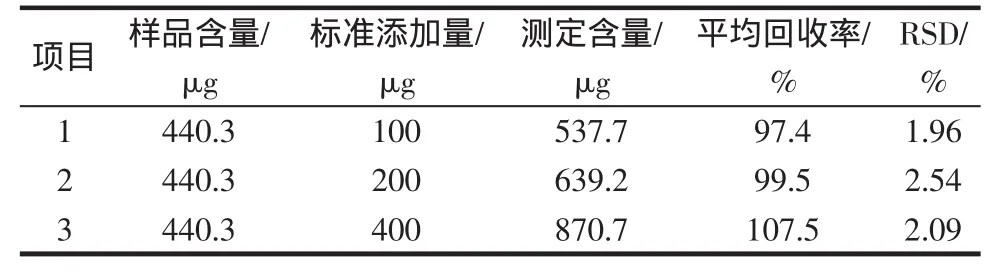
表1 精密度及平均回收率测定结果(n=5)Table 1 Results of precision and average recovery(n=5)
3 结论
该方法以水溶液作为提取溶液,超声提取果酱样品中的VC,操作简单快速,可避免样品中VC被氧化和基质成分的干扰,采用高效液相色谱法进行测定,结果稳定准确,且灵敏度高,适合用于果酱样品中VC的测定。
[1]王艳颖,姜国斌,胡文忠,等.高效液相色谱法测定草莓中VC含量[J].大连大学学报,2006,27(2):21-26
[2]庞燕军,陈靖,曹春英,等.高效液相色谱法测定食品和饮料中VC含量[J].现代中西医结合杂志,2009,18(5):555-556
[3]雍莉,黎源倩,李敏,等.高效液相色谱法快速测定保健食品和果蔬中VitC[J].现代预防医学,2005,32(3):247-248
[4]丁健桦,饶火瑜,王兴祥.HPLC法初步研究VC的稳定性[J].食品工业,2004(1):44-45

