金纳米颗粒制备及应用研究进展
王 莹 焦体峰,2* 谢丹阳 王风彦
(1燕山大学 环境与化学工程学院,河北省应用化学重点实验室,河北 秦皇岛066004;2中国科学院 兰州化学物理研究所,固体润滑国家重点实验室,甘肃 兰州730000)
1 引言
金是研究最早的主题之一,随着时间的推移,科技的进步,人们对金的探索也更加深入与全面。与宏观块状金属不同,当金属进入纳米尺度,会出现明显的性能变化,表现出独特的物理、化学性质,如表面等离子体共振吸收(SPR)、拉曼散射(RS)等,而纳米技术则被誉为21世纪最具有发展前景的技术[1]。
金纳米颗粒是直径为0.8~250nm的缔合胶体,具有表面效应、小尺寸效应及宏观量子隧道效应[2-3],其优良的稳定性、独特的光学及电学性质使其在生物医学等领域有广泛的应用,并且金纳米颗粒独特的性质又很大程度上依赖于其尺寸及形貌,随着尺寸和形态的变化,纳米材料的电磁性质和光学性质表现出了良好的可调控性。因此金纳米颗粒的制备也曾经一度成为人们研究的热点。迄今为止,已经有多种制备金纳米粒子的方法见诸报道。目前合成纳米材料的方法可归纳为两类,即多以物理方法破碎为代表的“自上而下”(Top-down)方法及以湿化学法为代表的化学还原手段合成金纳米粒子的“自下而上”(Bottom-up)方法。显而易见,自上而下的方法可以更好地调控纳米粒子的形貌尺寸和分散性。

图1 Geminis的化学结构及金纳米花的制备示意图Figure 1. Chemical structures of geminis and a schematic diagram of AuNPs Preparation.
2 金纳米颗粒的制备
2.1 化学还原法
柠檬酸钠还原法是合成金纳米粒子的经典方法之一,并且柠檬酸盐为弱的保护剂,可以很轻易地被其他配体所取代,所以可以用作其他基于金纳米颗粒的材料或分子器件[4-5]。Turkevich[6]等 1951年就用此法成功制备了金纳米粒子,其主要原理是柠檬酸钠(citrate sodium)保护性还原四氯金酸(HAuCl4),而 Frens[7]于1973年在此基础上发现了固定Au3+的浓度,通过调节柠檬酸钠的加入量,成功调控了金纳米颗粒的尺寸。近年来有研究表明可以通过时间、pH值、浓度加热方式等来调节柠檬酸盐制备金纳米颗粒。可以用来还原氯金酸合成金纳米粒子的无机盐还包括硼氢化钠,硼氢化钠的还原性较柠檬酸钠的还原性更强一些,并且其在以高分子聚合物或烷基硫醇充当保护剂的条件下可以合成更小尺寸的金胶体[8-9]。同时抗坏血酸(AA)也是一种常用的弱还原剂[10],其参与的反应过程如图1所示。Jang[11]等还利用葡聚糖(dextran)作为还原剂和表面涂覆剂来制备生物相容性的金纳米颗粒,通过葡聚糖的交联和胺化,明显提高了金纳米颗粒胶体的稳定性,使之适应生物耦合。
2.2 Brust-Schiffrin两相法
Brust-Schiffrin法[12]可以在温和的条件下合成金纳米粒子,制备出的金纳米粒子具有热稳定性,在空气中也可稳定存在。离析出来的金纳米粒子也可以再次溶解于有机溶剂中,而不会进一步聚集或分解。此法制备的离子有较强的分散性和可控的尺寸,尺寸分布为1.5~5.2nm,并可以通过调控金与硫醇的摩尔比、反应温度及还原剂加入的量来很好地调控金纳米粒子的尺寸。四辛基溴化铵作为相转移剂把AuCl4-萃取到甲苯中然后在十二烷基硫醇的存在下由NaBH4还原,而烷基硫醇配体可以使生成的金纳米粒子稳定存在于有机相中。其反应方程式如下:AuCl4-(aq)+N(C8H17)4+(C6H5Me)→N(C8H17)4+AuCl4-(C6H5Me)mAuCl4-(C6H5Me)+nC12H25SH(C6H5Me)+3me-→4mCl-(aq)+[Aum(C12H25SH)n](C6H5Me)
制备方式如图2所示。
2.3 晶种生长法
晶种生长法是用晶种合成及晶种长大两个步骤来完成金纳米颗粒合成的。由于在种金长大过程中可以避免新的晶核生成,该方法比一步法得到的粒子粒径 分 布 窄。 例 如,Lubin-Zhong[14]等 人 在 sideby-side,end-to-end和end-to-side金纳米棒的制备过程中就用到了晶种生成法:首先是晶种溶液的合成,0.60mL NaBH4(0.01mol/L)冷溶液加入到0.25mL HAuCl4(0.01mol/L)和7.50mL CTAB(0.1mol/L)的混合溶液中并静置2h做下一步反应用;其次是晶种生长溶液的配制,0.032mL抗坏血酸(0.1mol/L)加入到0.20mL HAuCl4(0.01mol/L)、0.035mL AgNO3(0.01mol/L)和4.75mL CTAB(0.1mol/L)的混合溶液中,最后0.020mL晶种溶液加入到上述晶种生长溶液中,反应混合30s后静置5h晶种便生长为金纳米棒,图3为所制备出的金纳米棒TEM图片。
2.4 模板法
模板法是以模板为主体构型去控制、影响和修饰材料的形貌,控制尺寸进而决定材料性质的一种合成方法。Xia[15]小组用银纳米立方块作为原位牺牲模版在聚乙烯吡咯烷酮的保护下合成金纳米笼,并总结了有关金纳米笼的合成、属性和应用,这就是以内核为模板反应结束后除掉内核而得到中空纳米结构的一种内模板法。而根据反应基底物质的不同,又可以分为硬模板和软模板两种方法。硬模板是以共价键维持产物特定结构,如多孔氧化铝、二氧化硅等,而软模板是基于分子间或分子内部的弱相互作用而维持产物特定结构,其中就包括表面活性剂模板法即微乳液法,有机大分子模板及生物模板法。如Long Jiang[16]等以表面活性剂十八胺为模板制备出粒径分布很窄的金纳米花,并讨论了表面活性剂、还原剂及氯金酸浓度对金纳米花形貌的影响。Ling Zhong[10]等人以gemin型两亲分子表面活性剂所形成的囊泡为模板,合成了金纳米花,并讨论了间隔基对形态的影响及纳米花的光学性质,其实验方法如图4所示。Asma Rehman[17]等人利用牺牲鼠李糖脂为原位生物模板的方法合成了金纳米多空网络结构并讨论了不同热处理温度对金纳米结构的影响。

图2 Brust两相法合成金纳米粒子示意图[13]Figure 2. Scheme for synthesis of a gold nanoparticle by the Brust two-phase approach.

图3 种金生长法制备出的金纳米棒TEM图示Figure 3. TEM images of SS-oriented assembly of AuNRs(a~c).
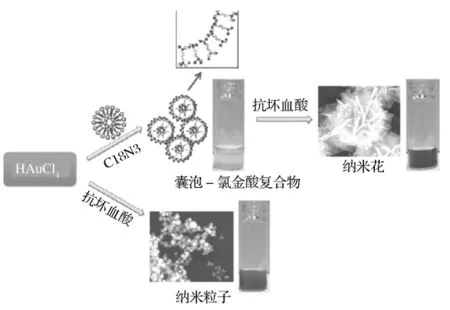
图4 金纳米花制备机制示意图Figure 4. Schematic illustration of the proposed mechanism for formation of flower-like gold nanostructures.
3 金纳米颗粒的应用
3.1 生物医学
金纳米粒子具有突出的表面等离子共振性质,这是由于入射光与金纳米粒子的自由电子相互作用:当入射光的波长与自由电子的振动频率发生共振耦合时,就会产生表面等离子体共振(surface plasmon resonance,SPR)。并且根据纳米粒子的形状大小及聚集程度和所处的环境不同,纳米粒子会由于等离子振子所发出的一定波长而呈现不同的颜色。这就为纳米粒子的生物传感及照影等生物医学方面的应用提供了理论基础。Mukherjee[18]等报道了以金纳米粒子为载体的胰腺癌的靶向治疗,利用了金纳米粒子的独特物理化学性质如生物相容性及易于表面功能化,从而增强了传统化疗的疗效。作者发展了基于金纳米粒子的靶向传递系统,这种传递系统以金纳米粒子作为传送药物的载体在体外和体内都进行了治疗胰腺癌的施用。还概括了金纳米粒子在射频消融治疗及光热法治疗癌症方面所取得积极作用。此外Ambrosi[19]等人报道了纳米金粒子用于乳腺癌的生物标记,这种改进的ELISA免疫测定方法通过纳米金粒子的加入而增强了测定的灵敏性和准确性,纳米金粒子作为一种信号增强剂同时也缩短了检测时间。纳米金作为传送剂载体的报导在诸多文献中都有涉及[20-27]。
3.2 传感器
表面等离子体共振(surface plasmon resonance,SPR)传感技术具有生物样品无需标记,分析样品无需纯化,且可实时检测反应动态过程等优点。然而SPR传感器直接检测小分子式灵敏度不高,由此可用金纳米颗粒来放大信号。王柯敏[28]等人通过异性识别作用在表面等离子体共振传感器的金膜表面构建了伴刀豆球蛋白A/葡聚糖修饰的金纳米颗粒自组装膜。当有葡萄糖存在时,膜被分解,从而实现对葡萄糖的灵敏检测。并且证实了由于金纳米颗粒和金膜之间的等离子体波耦合作用,修饰了金纳米颗粒的自组装膜上,葡萄糖的检测信号有明显增强。抗体在传感平台的有效固定以及传感的增强在设计表面等离子共振免疫传感器过程中至关重要。Sungho Ko[29]等报道了胶体纳米金粒子通过氨乙基硫醇在具有等离子共振性质的金芯片表面直接组装,并使用经基因方法改造过的GBP-ProA融合蛋白标记物做交联剂从而增强了检测免疫传感器系统的信号。该报告指出通过金纳米粒子的组装可以增强生物分子间的相互作用。组装纳米金粒子器件相对于没有组装金纳米粒子的器件检测鼠伤寒沙门氏菌敏感性提高了十倍。这种等离子共振生物传感器同样也可用于其他临床诊断或是环境监测中。
Richard N.Zare[30]等报道了金纳米粒子可以作为色度的传感器用来检测蛋白质构象的变化。根据所接触溶液的不同pH值,Cyt c(cytochrome c)显示出不同的性质,在低pH值的溶液中Cyt c将会舒展开来而在高pH值的溶液中将会有一定程度的皱褶。这种构象的变化可以使得其表面的纳米粒子溶液在颜色上产生可测量的变化从而可以从紫外吸收光谱中测量出来,而折光指数可从金薄膜的表面等离子共振光谱学中检测出来。所有的实验都表明了其对于pH值的同样趋势,提出了以蛋白质覆盖的纳米金粒子在作为一种简单构象变化的颜色传感器上的应用。

图5 以GBP-ProA融合蛋白的方式定向的固定抗体于金纳米粒子组装而成的表面等离子共振免疫传感器Figure 5. Scheme of the oriented immobilization of antibody onto the AuNPs assembled SPR immunosensor chip using GBP(gold binding polypeptides)-ProA(protein A)fusion proteins.
3.3 催化剂
金在很长一段时间以来被认为是化学惰性的,自从1989年日本学者 Haruta[31-33]等报道负载于Co3O4,Fe2O3或TiO2上的纳米金粒子可以作为CO及氢气、氧化的催化剂,并表现出了良好的性能,金纳米粒子开始逐步步入人们的视野中,人们开始研究有关金纳米粒子对于CO及醇类等的催化氧化,及不同载体对于纳米金粒子催化性能的影响。Yanbing Zhang[34]等人介绍了以沉积-沉淀的方式使金以纳米粒子的形式附着在多孔的氧化锆及硅酸盐组成的多孔纳米复合材料上,并且发现这种材料可以很好地氧化消除室内的甲醛。Abdessamad Grirrane[35]等人在甲苯溶液中以金纳米粒子为催化剂用于使苄胺与亚胺在“一锅法”中经两步反应氧化缩合而成二苄胺,而且在此反应过程中金催化剂表现出很高的活性及很好的选择性,如图6所示。该小组发现,此反应是一个结构敏感反应,需要小微晶;负载于石墨上的金可以选择性地使反应向完全氧化缩合反应的方向进行;此法也可用于高效选择性缩合含硫杂环胺;负载与二氧化钛的金能够通过;“一锅法”选择性的催化形成二苄胺,包括两步反应,分别为氧化缩合反应及加氢反应。
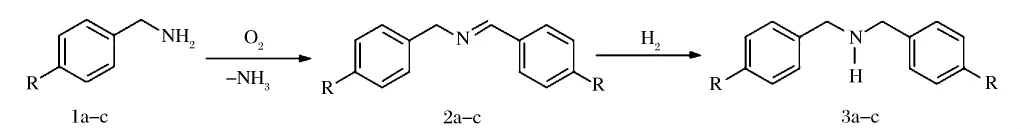
图6 苄胺与亚胺在“一锅法”中经两步反应氧化缩合而成二苄胺Figure 6. Two-steps reaction for formation of Dibenzylamine:oxidative condensation of benzylamines and hydrogen addition reduction of the oxidative condensation product.
3.4 电化学
当不断减小金块的尺寸,我们会发现金的电性能。当单个的纳米粒子在一定的很小纳米尺寸范围内时,就会显现出其电子结构,这种电子结构在大块金属的能带结构与分子的离散能级之间,具有已占电子的能级最高轨道(HOMO)及未占电子的能量最低轨道(LUMO)[36]。Honglai Liu[37]等人研究了基于gemini表面活性剂保护的金纳米粒子修饰的玻璃碳电极的血红蛋白的直接电化学。研究结果显示出GEM16-3-16-Au膜在GC电极可以为血红蛋白及在血红蛋白与电极间电子转移提供一种有利的微环境。Taku Hasobe[38]在 Supramolecular nanoarchitectures for light energy conversion一文中,从光电池捕获光子,电荷分离,载体运输三个步骤中载体的重要性出发,阐述了超分子纳米结构的重要性,并介绍了基于金纳米粒子和树枝状多态结构的卟啉图,如图7(1)所示。富勒烯有高组织结构的超分子纳米组装,此超分子纳米结构在电沉积的方式下沉积于SnO2纳米结构薄膜制成的 OTE/SnO2/(H2PCnMPC+C60)m电极图如图7(2)所示,经测试H2PCnMPC中烷基链长度n影响了此超分子结构的光电性能,并且 OTE/SnO2/(H2PC15MPC+C60)m复合电极的能量转化效率(η=FFIscVoc/Win)45倍于结构仅为卟啉和富勒烯的参比结构,并且高达1.5%。

图7 (1)卟啉及富勒烯与金纳米粒子自组装四级反应示意图及对应的TEM图片(2)光电化学电池图示及纳米粒子组装部分结构示意图Figure 7. (1)An illustration of the quaternary self-organization of porphyrin and C60units with gold nanoparticles,and the TEM images of the products formed in the last three assembly steps:(A)H2PC11MPC,(B)(H2PC11MPC)m,and(C)(H2PC11MPC+C60)m.(2)An illustration of a photoelectrochemical cell and the insertion of C60between two porphyrin rings on H2PC15MPC.
4 结语
通过近年研究可以看出,制备金纳米颗粒不再是以单一的方法完成,而是由各种方法相结合制备出形貌及分散性表现优异的金纳米粒子,这也会是将来金纳米制备的发展趋势。由于纳米粒子的表面效应、小尺寸效应、量子尺寸效应、宏观量子隧道效应及生物亲和性等特性,使纳米材料在现代光学、磁学、纳米电子学和生物医学领域具有良好的应用前景,并且金纳米本身具有特殊的光电性质、良好的生物相容性及低毒性,易于表面功能化,其在可见区有特征等离子体共振吸收(SPR),且其等离子共振吸收峰会随着尺寸的变化而发生频移,所以金纳米粒子可以应用于癌症治疗、生化分析、生物传感器等医学上亟欲进一步解决的问题上。
[1]曾小川,宋武林,周玉华,等.正电子湮没技术在纳米材料中的应用[J].中国无机分析化学,2011,1(2):13-19.
[2]Gleiter H.Nanocrystalline materials[J].Progress in Materials Science 1989,33(4):223-315.
[3]任翠领,陈兴国.纳米材料在光度分析中的应用进展[J].中国无机分析化学,2011,1(1):32-39.
[4]Frens G.Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J].Nature Phys Sci,1973,241(105):20-22.
[5]Ji X ,Song X ,Li J,et al.Size control of gold nanocrystals in citrate reduction:The third role of citrate[J].J Am Chem Soc,2007,129(45):13939-13948.
[6]Turkevich J,Stevenson P C,Hillier J.A study of the nucleation and growth processes in the synthesis of colloidal gold[J].Discuss Faraday Soc,1951,11(c):55-75.
[7]Frens G.Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J].Nature Phy Sci,1973,241:20-22.
[8]Brust M,Walker M,Bethell D,et al.Synthesis of thiol derivatised gold nanoparticles in a two phase liquid/liquid system[J].J Chem Soc Chem Commun,1994,7(7):801-802.
[9]Hostetler M J,Wingate J E,Zhong C J,et al.Alkanethiolate gold cluster molecules with core diameters from 1.5to 5.2nm:core and monolayer properties as a function of core size[J].Langmuir,1998,14(1):17-30.
[10]Zhong L,Zhai X,Zhu X,et al.Vesicle-directed generation of gold nanoflowers by gemini amphiphiles and the spacer-controlled morphology and optical property[J].Langmuir,2010,26(8):5876-5881.
[11]Jang H,Kim Y K,Ryoo S R,et al.Facile synthesis of robust and biocompatible gold nanoparticles[J].Chem Commun,2010,46(4):583-585.
[12]Brust M,Walker M,Bethell D,et al.Synthesis of thiolderivatized gold nanoparticles in a two phase liquid-liquid system[J].J Chem Soc Chem Commun,1994,7(7):801-802.
[13]Sardar R,Funston A M,Mulvaney P,et al.Gold nanoparticles:past,present,and future[J].Langmuir,2009,25(24):13840-13851.
[14]Zhong L,Zhou X,Bao S,et al.Rational design and SERS properties of side-by-side,end-to-end and endto-side assemblies of Au nanorods[J].J Mater Chem,2011,21(38):14448-14455.
[15]Skrabalak S E,Chen J,Sun Y,et al.Gold nanocages:synthesis,properties,and applications[J].Acc Chem Res,2008,41(12):1587-1595.
[16]Jia W,Li J,Li G,et al.Two-step synthesis of narrow size distribution nanoflowers using a tree-type multi-amine-head surfactant as a template[J].Cryst Growth Des,2011,11(9):3822-3827.
[17]Rehman A,Raza Z A,Saif-ur-Rehman,et al.Synthesis and use of self-assembled rhamnolipid microtubules as templates for gold nanoparticles assembly to form gold microstructures[J].J Colloid Interface Sci,2010,347(2):332-335.
[18]Patra C R,Bhattacharya R,Mukhopadhyay D,et al.Fabrication of gold nanoparticles for targeted therapy in pancreatic cancer[J].Adv Drug Deliv Rev,2010,62(3):346-361.
[19]Ambrosi A,Airo F,Merkoci,A.Enhanced gold nanoparticle based ELISA for a breast cancer biomarker[J].Anal Chem,2010,82(3):1151-1156.
[20]Veiseh O,Gunn J W,Zhang M.Design and fabrication of magnetic nanoparticles for targeted drug delivery and imaging[J].Adv Drug Deliv Rev,2010,62(3):284-304.
[21]Ghosh P,Han G,De M,et al.Gold nanoparticles in delivery applications[J].Adv.Drug Deliv.Rev,2008,60(11):1307-1315.
[22]Kim C,Ghosh P,Rotello V M.Multimodal drug delivery using gold nanoparticles[J].Nanoscale,2009,1(1):61-67.
[23]Park C,Youn H,Kim H,et al.Cyclodextrin-covered gold nanoparticles for targeted delivery of an anti-cancer drug[J].Mater Chem,2009,19(16):2310-2315.
[24]Ghosh P,Yang X,Arvizo R,et al.Intracellular delivery of a membrane-impermeable enzyme in active form using functionalized gold nanoparticles[J].J Am Chem Soc,2010,132(8):2642-2645.
[25]Cheng Y,Samia A C,Li J,et al.Delivery and efficacy of a cancer drug as a function of the bond to the gold nanoparticle surface[J].Langmuir,2010,26(4):2248-2255.
[26]Dhar S,Daniel W L,Giljohann D A,et al.Polyvalent oligonucleotide gold nanoparticle conjugates as delivery vehicles for platinum(IV)warheads[J].J Am Chem Soc,2009,131(41):14652-14653.
[27]Song W,Du J,Sun T,et al.Gold Nanoparticles capped with polyethyleneimine for enhanced siRNA delivery[J].Small,2009,6(2):239-246.
[28]黎振华,羊小海,王柯敏,等.伴刀豆球蛋白A/葡聚糖修饰的金纳米颗粒自组装膜增强信号的表面等离子体共振葡萄糖传感器[J].化学传感器,2007,27(1):23-27.
[29]Ko S,Park T J,Kim H S,et al.Directed self-assembly of gold binding polypeptide-protein A fusion proteins for development of gold nanoparticle-based SPR immunosensors[J].Biosens Bioelectron,2009,24(8):2592-2597.
[30]Chah S,Hammond M R,Zare R N.Gold nanoparticles as a colorimetric sensor for protein conformational changes[J].Chem Biol,2005,12(3):323-328.
[31]Haruta M,Daté M.Advances in the catalysis of Au nanoparticles[J].Appl Catal A:Gen,2001,222(1-2):427-437.
[32]Hayashi T,Tanaka K,Haruta M J.Selective vapor-phase epoxidation of propylene over Au/TiO2catalysts in the presence of oxygen and hydrogen[J].Catal,1998,178(2):566-575.
[33]Haruta M,Tsubota S,Kobayashi T,et al.Low-temperature oxidation of CO over gold supported on TiO2,Fe2O3and Co3O4[J].Journal of Catalysis,1993,144(1):175-192.
[34]Zhang Y.Shen Y,Yang X.Gold catalysts supported on the mesoporous nanoparticles composited of zirconia and silicate for oxidation of formaldehyde[J].Journal of Molecular Catalysis A:Chemical,2010,316(1-2):100-105.
[35]Grirrane A,Corma A,Garcial H.Highly active and selective gold catalysts for the aerobic oxidative condensation of benzylamines to imines and one-pot,two-step synthesis of secondary benzylamines[J].Journal of Catalysis,2009,264(2):138-144.
[36]Homberger M,Simon U.On the application potential of gold nanoparticles in nanoelectronics and biomedicine[J].Phil Trans R Soc A,2010,368(1915):1405-1453.
[37]Li J,Zhou L,Han X,et al.Direct electrochemistry of hemoglobin based on gemini surfactant protected gold nanoparticles modified glassy carbon electrode[J].Sensors and Actuators B,2008,135(1):322-326.
[38]Taku H.Supramolecular nanoarchitectures for light energy conversion[J].Phys Chem Chem Phys,2010,12(1):44-57.

