甲砜霉素及氟苯尼考胺单克隆抗体的制备及特性鉴定
金银珍,刘智宏,王鹤佳,黄耀凌,张聪敏
(中国兽医药品监察所,北京 100081)
酰胺醇类抗生素除其代表药物——氯霉素外,还有甲砜霉素和氟苯尼考(氟甲砜霉素)。但是由于氯霉素存在严重的副作用,国际上相继禁止或严格限制使用氯霉素,目前出现了用甲砜霉素和氟苯尼考替代氯霉素使用的趋势[1-2]。甲砜霉素和氟苯尼考属广谱抑菌药物,具有较高的抗菌活性,主要用于治疗畜、禽肠道、呼吸道等细菌性感染[3],尤其在水产养殖中广泛使用。但是甲砜霉素仍有免疫抑制作用,其使用有引起耐药性细菌存在的风险,除我国和日本外,欧盟和美国均将甲砜霉素禁用于食品动物。我国规定甲砜霉素在各种动物组织中的最高残留限量(MRL)为50 μg/kg,氟苯尼考残留标示物为氟苯尼考胺,其在不同动物肌肉组织中的 MRL 为 100 ~300 μg/kg[4]。
已报道的动物组织中甲砜霉素和氟苯尼考残留检测方法有气相色谱法[5-6]、气相色谱 - 质谱法[7]、高效液相法和高效液相色谱-串联质谱法[8]及甲砜霉素和氟苯尼考胺酶联免疫检测方法[9-11]。本研究以本试验室建立的甲砜霉素、氟苯尼考和氟苯尼考胺多残留酶联免疫检测方法为基础,应用能稳定分泌抗甲砜霉素单克隆抗体的杂交瘤细胞株,可为甲砜霉素及氟苯尼考胺检测试剂盒提供长期稳定的单克隆抗体。
1 材料与方法
1.1 材料
1.1.1 主要仪器和试剂 酶标读数仪,SUNRISE,TECAN公司;台式高速冷冻离心机,Biofuge stratos,Heraeus公司;漩涡振荡器,MS2,IKA公司;电子天平,Sartorious公司;倒置显微镜,Olympus公司;甲砜霉素标准品,中国兽医药品监察所制备;氟苯尼考胺,TRC公司;聚乙二醇(PEG)4000、氟苯尼考、弗氏完全佐剂、弗氏不完全佐剂、Giemsa染料、秋水仙素、HRP标记羊抗鼠IgG及羊抗鼠IgG亚类抗体,Sigma公司;DMEM干粉培养基、胎牛血清、HAT及HT,Gibco公司;其他所有化学试剂均为分析纯;检测抗原为本实验室自制。
1.1.2 溶液 洗液:0.05 mol/L磷酸盐缓冲液,0.05%Tween -20,pH 7.2。封闭液:5% 脱脂奶洗液。包被缓冲液:0.05 mol/L碳酸盐缓冲液,pH 9.5。标准溶液:0、0.2、1、5、25、125 μg/L 甲砜霉素标准品溶液。底物溶液:0.01%TMB,以0.1 mol/L磷酸盐-柠檬酸缓冲液(pH 5.0)配制。
1.1.3 动物及细胞系 Balb/c小鼠,北京实验动物中心提供;Sp2/0骨髓瘤细胞由本实验室保存。
1.2 方法
1.2.1 酰胺醇类药物免疫抗原制备和免疫 免疫抗原的制备及鉴定按文献[11]进行。以免疫抗原免疫6~8周龄雌性Balb/c小鼠20只,首次免疫用2 mg/mL免疫抗原(以载体蛋白计)1 mL,加等量弗氏完全佐剂乳化,免疫剂量为100 μg/只,于小鼠颈部、背部皮下多点注射。以后与首次免疫相同的剂量加弗氏不完全佐剂进行加强免疫3次,每次间隔2周。于末次免疫后7 d采血,用间接ELISA测定血清效价。选择抗血清效价高及竞争抑制强的小鼠脾脏进行细胞融合,融合前3 d腹腔注射加强免疫。
1.2.2 间接竞争ELISA方法的建立 将检测抗原用碳酸盐缓冲液稀释,包被酶联板,每孔150 mL,4℃放置过夜。倾去孔内液体,拍干,加入洗液250 mL,洗板3次。加入封闭液每孔250 mL,室温放置2 h,洗液洗板3次。酶标板单数列加入0浓度标准溶液50 mL,双数列加入100 ng/mL浓度甲砜霉素标准溶液50 mL,取1000倍稀释的小鼠血清(或细胞上清液)50 mL分别加到两浓度的酶标板中,室温孵育1 h。洗液洗板3次,每孔加入羊抗鼠IgG溶液100 mL,室温孵育30 min。洗液洗板3次。加入底物溶液100 mL,避光显色10~30 min。加入终止液100 mL,在450 nm波长处测定吸光度值。
1.2.3 细胞融合、克隆及腹水制备[12]免疫小鼠的脾细胞与骨髓瘤细胞Sp2/0以5~10∶1的比例混合,用50%PEG作融合剂将两种细胞融合,将融合细胞悬于含20%胎牛血清的2%HAT选择性培养基内,加到96孔细胞培养板中,37℃下于5%CO2培养箱中培养,在融合后第7~12天,细胞生长达1/3~1/4视野时,取融合细胞的上清液进行筛选。以筛选到与0浓度标准溶液有反应,与100 ng/mL浓度甲砜霉素有明显抑制的细胞孔进行亚克隆。一般亚克隆后第7~10天再次进行单克隆孔的ELISA筛选,如此亚克隆3~5次,至阳性率达100%为止。然后进行扩大培养,并将细胞于液氮下保存。
选取20~22 g雌性Balb/c小鼠20只,腹腔注射0.5 mL液体石蜡7 d后,腹腔注射杂交瘤2×106细胞,7~14 d后待小鼠腹部显著膨隆,抽取小鼠腹水,5000 r/min离心5 min,吸出上清液备用。
1.2.4 单克隆抗体类型的鉴定 用1%琼脂糖磷酸盐缓冲液制备平板,取小鼠腹水10 mL加到中心孔,加羊抗鼠IgG各亚类抗体10 mL到周边孔中进行琼脂扩散试验,37℃湿盒孵育过夜。
1.2.5 杂交瘤细胞的染色体分析 按实验室常规方法进行[12]。
1.2.6 抗体效价及灵敏度测定 用洗液系列稀释杂交瘤细胞上清液及小鼠腹水,按1.2.2项方法操作,取0浓度标准溶液OD值为1.5~1.8的抗体稀释倍数作为抗体效价。选择系列稀释的甲砜霉素药物浓度,选择最佳抗体浓度,按基本间接竞争ELISA进行测定。以甲砜霉素浓度的对数值为X轴,以各浓度的OD值除以0浓度的OD值(B/B0)为Y轴,绘制标准曲线,确定IC50浓度范围。
1.2.7 交叉反应率 选择酰胺醇类药物氯霉素、甲砜霉素、氟苯尼考和氟苯尼考胺,分别配成系列浓度,按1.2.2项方法测定,确定IC50浓度。用下式计算各药物对该抗体的交叉反应率。交叉反应率=甲砜霉素IC50/待测药物IC50×100%。
2 结果
2.1 杂交瘤细胞株的建立 免疫5次后,采集免疫小鼠血清,用间接竞争ELISA测定小鼠抗血清对药物的抑制程度,选择抑制最明显的2-1号小鼠进行细胞融合,2块96孔细胞培养板全部有杂交瘤细胞形成,融合率为100%。用间接竞争ELISA检测细胞上清液,其中有抑制的为26孔,选其中OD值较高的2个孔进行亚克隆,通过3次克隆化后获得IC50较低的杂交瘤细胞株1E及5C,通过传代、冻存及复苏,其杂交瘤细胞生长良好并能稳定分泌单克隆抗体。
2.2 单克隆抗体特性鉴定结果
2.2.1 杂交瘤核型鉴定结果 本试验获得的杂交瘤1E染色体数目为96~102条,平均98条。
2.2.2 抗体类型鉴定 本试验所制的单克隆抗体杂交瘤1E及5C所分泌的抗体类型为IgG2b。
2.3 灵敏度及效价测定 杂交瘤1E第一代细胞上清抗体效价为1∶5×103;将细胞冻存及复苏传代,第二代细胞上清效价为1∶5×103,腹水抗体效价为1∶1×106。
标准曲线浓度为 0.2、1、5、25、125 μg/L,相应的对数值分别为 -0.7、0、0.7、1.4 及 2.1。IC50变动范围为15~25 μg/L。标准曲线如图1所示。
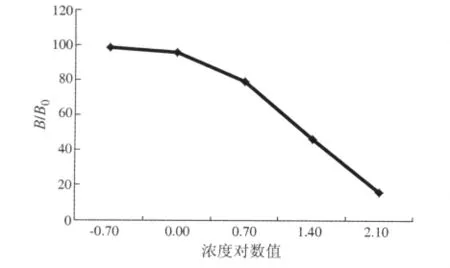
图1 标准曲线
2.4 杂交瘤1E分泌的抗体交叉反应率 测定4种药物的IC50,得出系列交叉反应率,结果见表1。

表1 交叉反应试验结果
3 讨论
目前甲砜霉素和氟苯尼考胺残留检测主要以仪器方法为主,样品一般经过有机溶剂提取、旋转蒸发、除脂肪,再经固相萃取柱净化等步骤进行处理,样品处理方法比较复杂,不适合大量样品检测的需要。近几年来,免疫检测技术在抗生素、农药、毒素等小分子化合物残留分析中的应用越来越广泛,而抗体的制备则是建立免疫检测技术的关键。甲砜霉素、氟苯尼考与氯霉素化学结构的区别是在基本结构中用甲磺基取代了毒性较强的硝基。为了获得能抗甲砜霉素及氟苯尼考胺,但不与氯霉素有交叉的抗体,本试验用碳二亚胺法将氟苯尼考胺与载体蛋白偶联作为免疫抗原[11],将苯环上的甲磺基暴露在外作为主要的抗原决定簇,通过小鼠免疫、细胞融合、筛选、克隆和腹水制备,获得了抗甲砜霉素、氟苯尼考胺的特异性的单克隆抗体。尽管单克隆抗体的研究技术比较成熟,但小分子药物的单克隆与大分子物质的抗体制备有明显区别,主要因为抗原的免疫原性较弱,且筛选方法不仅要考虑到抗体效价,而且要考虑抑制率高低等因素。合理的筛选程序对能否获得高亲和力的单抗细胞株非常重要,本实验选用自制的检测抗原,用0浓度及高浓度甲砜霉素标准液进行筛选,获得了抗甲砜霉素单克隆抗体的杂交瘤细胞株。尽管该抗体灵敏度不如本实验室同期制备的多克隆抗体,但该单克隆抗体效价高,特异性及灵敏度基本能满足实际检测要求,可以为今后检测试剂盒的研发及生产提供长期稳定的抗体。
[1] 李秀波,石 波,梁 萍.新型广谱抗菌药一氟苯尼考[J].国外畜牧科技,1999,26(3):50 -52.
[2] 张建民,钟超平.兽用广谱抗生素氟苯尼考的合成[J].国外医药抗生素分册,1999,20(2):68 -71.
[3] 中华人民共和国兽药典委员会.中华人民共和国兽药典二○○五年版一部[M].北京:中国农业出版社,2006:14-16.
[4] 中华人民共和国农业部公告第235号.动物性食品中兽药最高残留限量[S].
[5] 农业部958号公告-13-2007.《水产品中氯霉素、甲砜霉素和氟苯尼考残留量的测定——气相色谱法》[S].
[6] Alien P,Pfenning Jose E,Roybal Heidi S Rupp,et al.Simultaneous Determination of Residues of Chloramphenicol,Florfenicol,Florfenicol Amine,and Thiamphenicol in Shrimp tissue by Chromatography with Electron Capture Detection[J].Journal of AOAC International,2000,83(1):26 -30.
[7] 农业部958号公告-14-2007.《水产品中氯霉素、甲砜霉素和氟苯尼考残留量的测定——气相色谱-质谱法》[S].
[8] GB/T 207056-2006.《可食动物肌肉、肝脏和水产品中氯霉素、甲砜霉素和氟苯尼考残留量的测定——LC-MS-MS》[S].
[9] 郝 凯,过世东,胥传来,等.水产品中甲砜霉素残留的CELISA检测方法研究[J].食品工业科技,2006,2:186 -188.
[10] Jin - E Wu,Chao Chang,Wen - ping Ding,et al.Determination of Florfenicol Amine Residues in Animal Edible Tissues by Indirect Competitive ELISA[J].J Agric Food Chem,2008,56:8261 -8267.
[11]刘智宏,黄耀凌,汪 霞,等.水产品中甲砜霉素、氟苯尼考和氟苯尼考胺酶联免疫多残留测定[J].中国兽药杂志,2010,44(12):1 -5.
[12] Heddy Zola.单克隆抗体手册[M].周宗安.译.南京:南京大学出版社,1991.

