趋化因子CXCL5启动子区-156G/C基因多态性与2型糖尿病的关系
赵艳茹 刘 波 齐曦明 尹福在
胰岛素抵抗是2型糖尿病(T2DM)的核心机制,有研究证实胰岛素抵抗与慢性低水平的炎症状态和一些细胞因子相关[1]。在T2DM发生发展中,炎症因子可能具有重要作用[2]。CXCL5/ENA-78即上皮细胞来源的中性粒细胞活化肽,是趋化因子超家族的CXC亚族成员,参与多种炎症反应。本研究旨在探讨CXCL5基因启动子区-156 G/C位点多态性与T2DM的关系。
1 对象与方法
1.1 研究对象 选取2009年2月—10月在我院内分泌科住院的T2DM患者210例为T2DM组,男女各105例,年龄(54.09±12.43)岁,体质量指数(BMI)为(25.38±3.67)kg/m2,诊断符合1999年WHO糖尿病诊断标准,排除伴有急慢性感染性疾病、严重心脑血管病变、肝肾功能不全及严重T2DM急性代谢并发症者。选取同期我院体检中心的健康体检者171例为对照组,男88例,女83例,年龄(52.64±11.46)岁,BMI为(25.16±3.48)kg/m2,2组间性别(χ2=0.283)、年龄(t=1.175)、BMI(t=0.601)比较差异无统计学意义(均 P>0.05)。
1.2 主要仪器试剂 PCR扩增仪Mastercycler T-Gradinet(德国Eppendorf公司),DYCZ-28A型电泳槽(北京市六一仪器厂),恒温孵育箱。人全血DNA提取试剂盒(北京天根生物有限公司),Taq-DNA聚合酶、NruⅠ限制性内切酶(Promega公司)。
1.3 研究方法 2组均采空腹外周静脉血2 mL,提取白细胞基因组DNA。采用聚合酶链式反应限制性片段长度多态性(PCR-RFLP)方法检测CXCL5基因启动子区-156 G/C基因多态性。引物序列均查基因库并参考文献[3]设计,上游引物5′-CTCCTCCTGGCCACCCTCGC-3′,下游引物 5′-TCAAGCTTTG GGATGCTGGGGAA-3′(上海捷瑞生物工程有限公司合成)。PCR扩增片段长度114 bp,分离纯化扩增产物,测序并与GenBank中CXCL5基因比较。以限制性内切酶NruⅠ进行消化,酶切产物用经15%聚丙烯酰胺电泳溴乙锭染色,凝胶自动成像系统观察结果并成像。
1.4 统计学方法 采用SPSS 11.5软件完成,计量资料用±s表示,两个样本比较采用t检验,偏态分布资料做自然对数转换成正态分布后再行t检验。遗传平衡吻合度检验用Hardy-Weinberg平衡法。各组间基因频率、等位基因频率比较采用行×列表χ2检验,并对基因型及等位基因频率分布进行相对发病风险分析,计算比值比(odds ratio,OR)及其95%可信区间。以P<0.05为差异有统计学意义。
2 结果
2.1 扩增产物基因测序结果 扩增产物片段为114bp,将产物测序并与GenBank中CXCL5基因启动子区-156 G/C的基因序列进行比较,与相应序列完全一致,见图1~3。
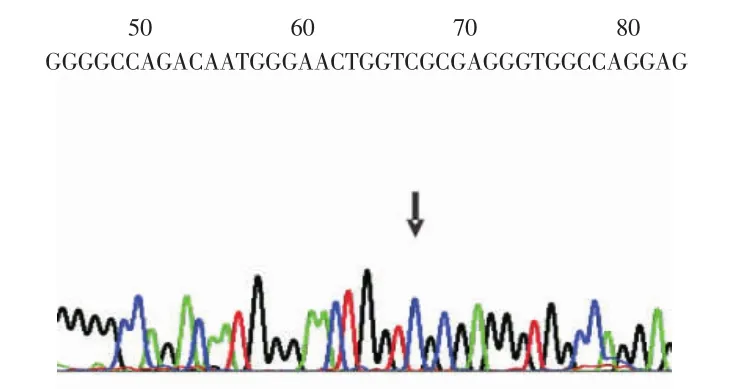
Figure 1 G/G homozygous genotype图1 G/G基因型
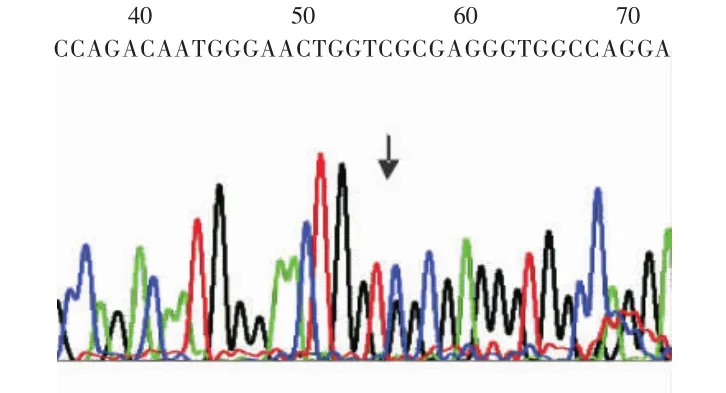
Figure 2 G/Cheterozygous genotype图2 G/C基因型
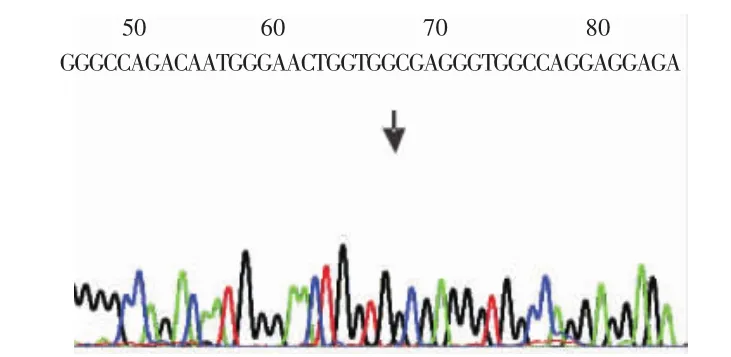
Figure 3 C/Chomozygous genotype图3 C/C基因型
2.2 2组CXCL5启动子-156G/C位点基因型及等位基因频率分布 CXCL5基因启动子-156G/C的基因型分布分符合Hardy-Weinberg平衡,见表1。T2DM组和对照组基因型和等位基因分布上差异无统计学意义(均P>0.05),见表2。
Table 1 Hardy-Weinberg analysis表1 Hardy-Weinberg基因平衡检验(实际观察值/理论值)
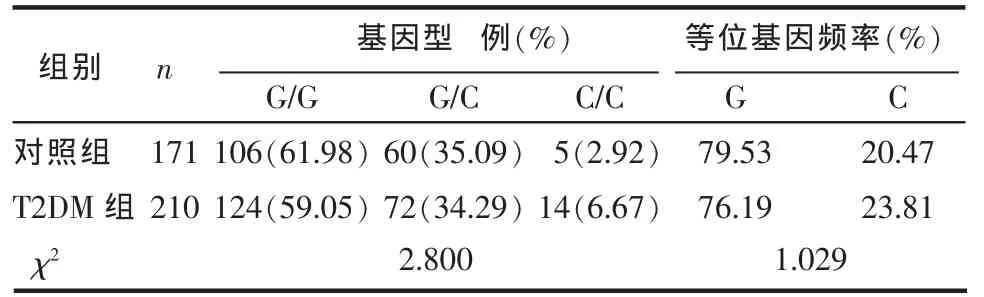
Table 2 CXCL5 polymorphism genotype and allelotype frequency in two groups表2 2组CXCL-5基因型及等位基因频率分布
2.3 CXCL5-156G/C位点多态性 G/G基因型可被酶切为95 bp和19 bp片段,G/C基因型可被酶切为114 bp、95 bp和19 bp片段,C/C基因型不可被酶切,可见1条114 bp的电泳带,见图4。
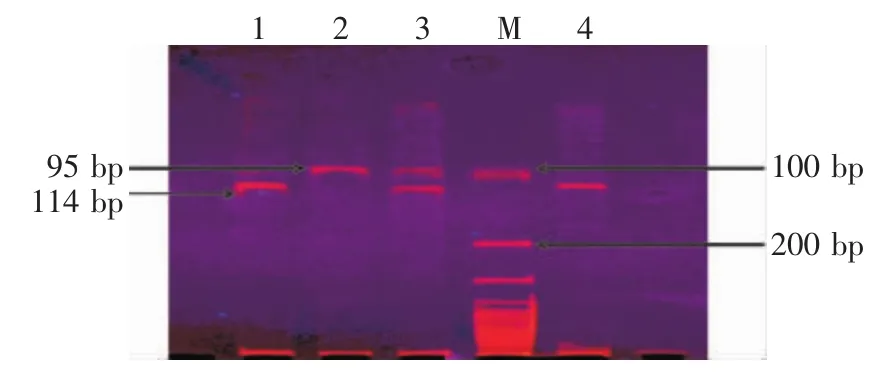
Figure 4 The CXCL5-156G/CSNPgenotyping by PCR-NRUI digestion and PCR production图4 CXCL5-156G/C基因扩增产物酶切电泳图
3 讨论
趋化因子能通过炎症反应参与糖尿病与胰岛素抵抗的发生发展,与其他机制共同加快糖尿病病程的进展。CXCL5/ENA-78参与炎症、肿瘤、自身免疫病、超敏反应及获得性免疫缺陷综合征多种疾病的发生发展过程。CXCL5基因位于染色体4q13~q21,其中有2个单核苷酸多态性位点:启动子区域的-156G>C(rs352046),外显子 398G>A(rs425535),而启动子区域-156G/C的基因多态性影响基因表达水平[4]。并且Zineh等[5]的研究表明-156位点携带C等位基因者其血浆CXCL5浓度显著升高,并直接影响白细胞产生CXCL5。目前国内外关于CXCL5与2型糖尿病的相关性研究较少,Alfadda等[6]研究证实糖尿病患者血清CXCL5水平明显高于对照组。
本研究显示2型糖尿病组和对照组基因型和等位基因分布上差异无统计学意义,C等位基因并不增加糖尿病的发病率,提示CXCL5酶切位点基因多态性与T2DM发病有较弱的遗传关联性,研究结果与近期国外报道不一致。分析其可能的原因有:(1)样本量有限,有待进一步扩大样本量;在缺乏更大样本的临床研究资料之前,评价两者之间的关系应慎重。(2)CXCL5在T2DM发病中所起的作用比较弱。(3)不同种族、地区和群体在遗传和表型上存在异质性,CXCL5酶切位点的基因型在不同种族和群体中分布频率不一。(4)T2DM是复杂性的多基因遗传病,是遗传因素与环境因素相互作用的结果。CXCL5单个基因多态性只能改变个体对疾病的易感性,其可能需与其他基因或环境因素共同影响疾病的发生。
CXCL5-156G/C位点的基因多态位点在国内文献少见报道,因而笔者不能断言CXCL5酶切位点的多态性与T2DM的发病无关。有待进一步加大样本量,开展多地区、多种族人群的大规模前瞻性研究和谱系研究。
[1]Tilg H,Moschen AR.Inflammatory mechanisms in the regulation of insulin resistance[J].Mol Med,2008,14(3-4):222-231.
[2]李秀钧,邬云红.糖尿病是一种炎症性疾病[J]?中华内分泌代谢杂志,2003,19(4):251-253.
[3]Hasani Ranjbar S,Amiri P,Zineh I.CXCL5 gene polymorphism association with diabetes mellitus[J].Mol Diagn Ther,2008,12(6):391-394.
[4]Amoli MM,Larijani B,Thomson W,etal.Two polymorphisms in the epithelial cell-derived neutrophil-activating peptide(ENA-78)gene[J].Dis Markers,2005,21(2):75-77.
[5]Zineh I,Aquilante CL,Langaee TY,etal.CXCL5 genepolymorphisms are related to systemic concentrations and leukocyte production of epithelial neutrophil-activating peptide (ENA-78)[J].Cytokine,2006,33(5):258-263.
[6]Alfadda AA,Alzoghaibi MA.Circulatory neutrophil chemokines in statin-treated diabetic patients[J].Saudi Med J,2008,29(4):584-588.

