代文、阿托伐他汀和匹格列酮对肾上腺髓质素和补体因子H表达的影响
钟继娟 缪 珩
糖尿病肾病(diabeticn ephropathy,DN)是糖尿病晚期最主要的并发症之一。DN主要表现为肾脏肥大、肾小球及肾小管基底膜增厚、肾小球内高灌注、高跨膜压并逐渐进展为肾小球细胞外基质增生、肾小球硬化,最终发展为肾功能衰竭[1],已成为糖尿病患者最主要的死亡原因之一。DN发生发展的危险因素除高血糖之外,还与高血压、高血脂、胰岛素抵抗(IR)等有关。目前常用的治疗DN的药物有代文、阿托伐他汀和匹格列酮,有研究表明这3种药物均具有独立于其基本的降压、降脂、改善IR作用之外的肾脏保护作用[2-5],但其作用机制尚不明确。本研究采用体外培养的方法,分别观察3种药物对高糖条件下培养的大鼠肾脏系膜细胞转化生长因子(TGF)-β1、纤维连接蛋白(Laminin,LN)、Ⅳ型胶原(Type Ⅳ Collagen,C-Ⅳ)、TGF-β1mRNA、肾上腺髓质素 (adrenomedullin,AM)mRNA以及补体因子H (complement factor H,Cfh)mRNA 表达的影响,并探讨其作用机制。
1 材料与方法
1.1 材料及试剂 大鼠肾小球系膜细胞(HBZY-1)购自中国典型培养物保藏中心(武汉大学保藏中心)。RPMI-1640培养基(美国Sigma公司)、胰蛋白酶(美国GIBCO BRL公司),新生胎牛血清 (NCS,杭州四季青公司),4-羟乙基哌嗪乙磺酸(HEPES,美国 Sigma公司),二甲基亚砜(DMSO,美国 Sigma公司)。匹格列酮标准品系恒瑞公司惠赠,TGF-β1酶联免疫吸附(ELISA)测定试剂盒(美国 Genzyme公司),LN和C-Ⅳ放免测定试剂盒(上海海军医学研究所生物技术中心),Trizol(美国Promega公司)。
1.2 方法
1.2.1 药品配制 代文、阿托伐他汀和匹格列酮均用DMSO溶解,然后用不完全RPMI-1640培养基配成0.03 mmol/L母液,-20℃冰箱保存备用。
1.2.2 细胞培养 (1)将HBZY-1细胞培养于含10%FCS的RPMI-1640培养液中,置37℃、5%CO2培养箱,实验共分为:低糖对照(5.6 mmol/L,LG)、高糖对照(30 mmol/L,HG)、高糖+代文(10 μmol/L,HD)、高糖+阿托伐他汀(10 μmol/L,HL)、高糖+匹格列酮(10 μmol/L,HP)5 组。(2)细胞传代 48 h(传代前每瓶细胞数约5×104/mL,每瓶细胞悬液6 mL),弃去上清液,加入 LG、HG、HD、HL或HP的培养液,置 37℃、5%CO2培养箱继续培养,干预48 h后分别取细胞上清液分装于 Eppendorf管,-20 ℃冰箱保存,用于 TGF-β1、LN、Ⅳ型胶原蛋白测定,并立即提取系膜细胞总RNA用于逆转录聚合酶链反应(RT-PCR)。
1.2.3 细胞总RNA提取及RT-PCR (1)采用Trizol一步法抽提细胞总RNA,RNA浓度用比色法测定光密度 (OD)值,RNA完整性用甲醛变性胶电泳验证。(2)用RT-PCR方法半定量测定药物剌激对体外培养大鼠系膜细胞TGF-β1mRNA、AM mRNA和Cfh mRNA表达的影响,以GAPDH为内参照。TGF-β1引物序列:上游 5′-CTTCAGCTCCACAGAG AAGAACTG-3′,下游 5′-CACGATCATGTTGGACAACTGCTC C-3′,产物 298 bp;AM 引物序列:上游 5′-GAAGCTGGTTTC CATCGCCC-3′,下游 5′-TGCCACCCGCACCTATAACC-3′,产物568 bp;Cfh引物序列: 上游 5′-AAGTTATCTGTCCCTCCC T-3′,下游 5′-CATACTCCTGCTTTTGTCTA-3′,产物 256 bp;GAPDH引物序列:上游5′-CACCCTGTTGCTGTAGCCATAT TC-3′, 下游 5′-GACATCAAGAAGGTGGTGAAGCAG-3′,产物196 bp。逆转录反应体系为20μL,取RNA样本4.0μL加入随机引物及AMV逆转录酶3μL进行逆转录。以GAPDH检测阳性的cDNA为模板,用特异性引物扩增cDNA。PCR反应体系为25μL,逆转录产物(cDNA)2.0μL,上、下各游引物0.5μL,Taq酶0.4μL进行PCR扩增。取PCR产物10μL在2%琼脂糖凝胶(含溴化乙锭)上电泳,用天能GIS-2010数码凝胶图像处理系统扫描电泳结果,测定OD值并计算TGF-β1/GAPDH、AM/GAPDH和Cfh/GAPDH的 OD比值。
1.2.4 细胞上清测定 TGF-β1采用ELISA试剂盒,LN和Ⅳ型胶原采用RIA试剂盒,均按说明书操作。
1.3 统计学方法 数据应用SPSS 13.0统计分析软件处理,计量资料以±s表示,2组间比较用t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 3种药物对TGF-β1、LN、Ⅳ型胶原表达的影响 高糖对照组细胞上清TGF-β1、LN、Ⅳ型胶原的表达显著高于低糖对照组(均P<0.001)。高糖条件下予以药物干预后,与高糖对照组比较,HD组、HL组及HP组细胞上清TGF-β1、Ⅳ型胶原、LN的表达显著下降 (均P<0.001),且HD组作用更明显,见表1。
Table 1 Effects of TGF-β1,LN,typeⅣ collagen expressions in mesangial cells cultured under high glucose in five groups表1 各组大鼠肾脏系膜细胞TGF-β1、LN、Ⅳ型胶原表达水平影响 (n=4,μg/L,±s)
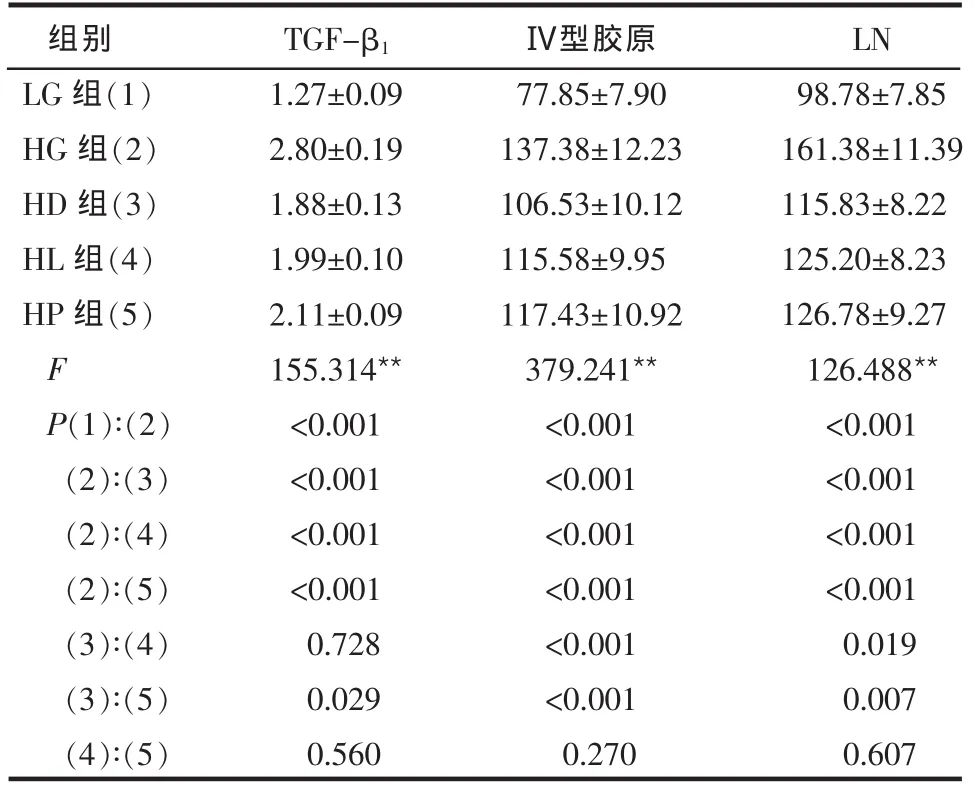
Table 1 Effects of TGF-β1,LN,typeⅣ collagen expressions in mesangial cells cultured under high glucose in five groups表1 各组大鼠肾脏系膜细胞TGF-β1、LN、Ⅳ型胶原表达水平影响 (n=4,μg/L,±s)
**P<0.01
?
2.2 3种药物对 TGF-β1mRNA、AM mRNA和 Cfh mRNA表达的影响 高糖条件下系膜细胞TGF-β1mRNA、AM mRNA和Cfh mRNA的表达较低糖对照组显著增高 (均P<0.001)。应用药物干预后,TGF-β1mRNA、AM mRNA 和 Cfh mRNA 的表达较高糖对照组显著下降(P<0.05或P<0.01),见图1~3、表2。
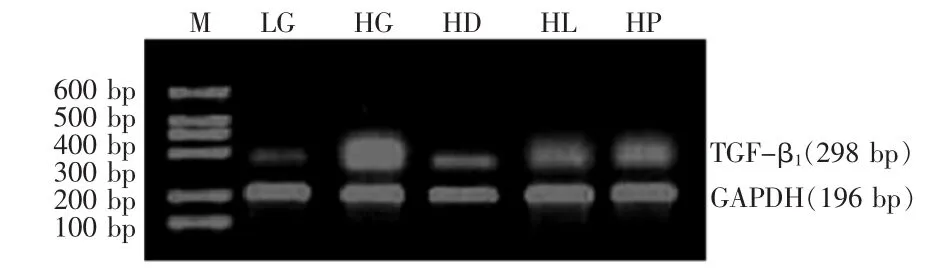
Figure 1 The electropherogram of TGF-β1mRNA expression in different groups of mesangial cells图1 各组大鼠肾脏系膜细胞TGF-β1 mRNA表达电泳图
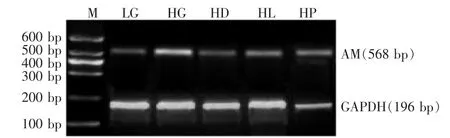
Figure 2 The electropherogram of AM mRNA in different groups of mesangial cells图2 各组大鼠肾脏系膜细胞AM mRNA表达电泳图
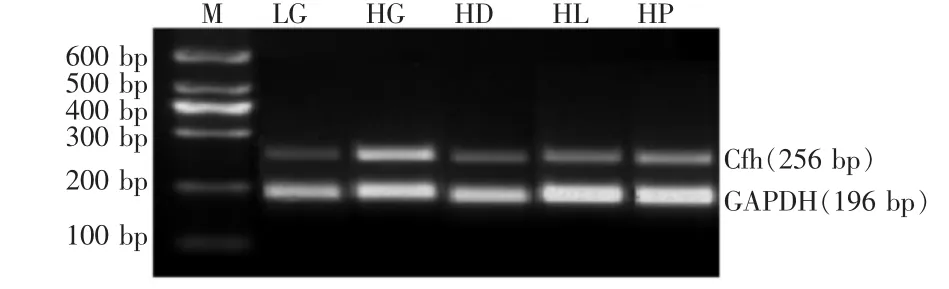
Figure 3 The electropherogram of Cfh mRNA in different groups of mesangial cells图3 各组大鼠肾脏系膜细胞Cfh mRNA表达电泳图
Table 2 Comparison of expressions of TGF-β1 mRNA,AM mRNA and Cfh mRNA in different groups of mesangial cells表2 各组大鼠肾脏系膜细胞TGF-β1 mRNA、AM mRNA和Cfh mRNA表达水平的比较 (n=4,OD 值,±s)
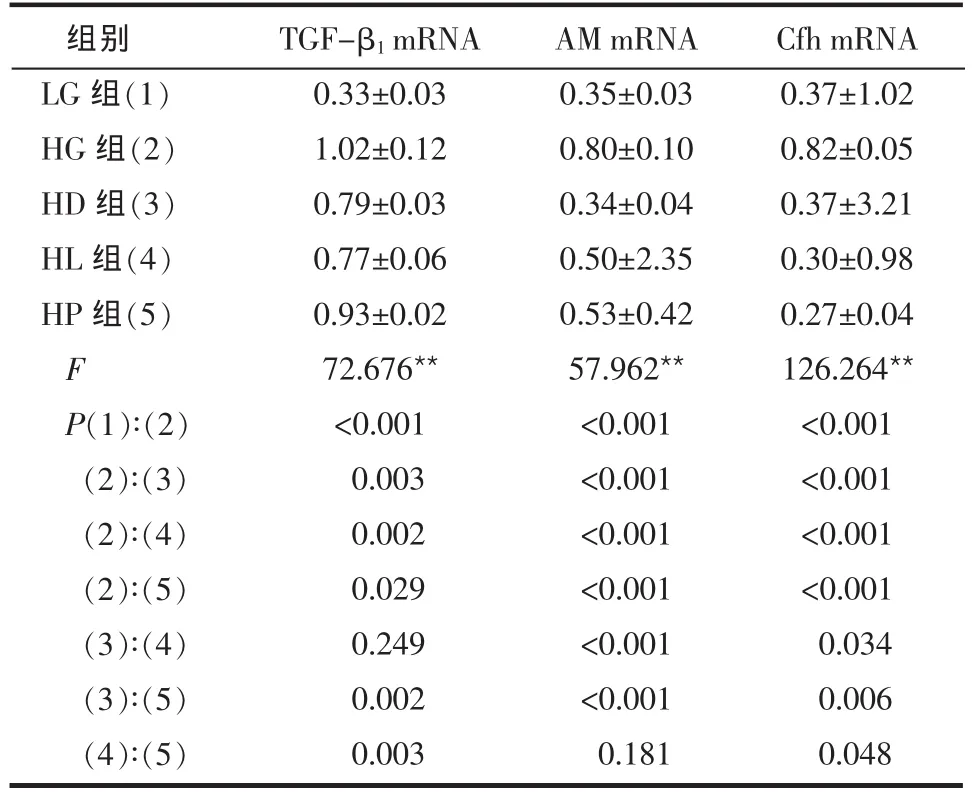
Table 2 Comparison of expressions of TGF-β1 mRNA,AM mRNA and Cfh mRNA in different groups of mesangial cells表2 各组大鼠肾脏系膜细胞TGF-β1 mRNA、AM mRNA和Cfh mRNA表达水平的比较 (n=4,OD 值,±s)
**P<0.01
?
3 讨论
DN是糖尿病最主要的慢性并发症之一,其发病机制复杂,主要包括肾小球系膜细胞的增厚扩张、细胞外基质(extracellular matrix,ECM)的沉积、间质病变和肾小管病变等,其中TGF-β1改变在DN进行性肾小球硬化过程中起着重要作用。临床资料显示,除基本的影响因素如糖尿病患者年龄、病程长以及血糖控制情况之外,肥胖、高血压及高血脂等胰岛素抵抗症候群在DN的发生发展中起到了非常重要的作用[6]。代文、阿托伐他汀和匹格列酮是目前临床上常用的降压、降脂及改善IR的药物,本研究结果显示这3种药物均能显著降低高糖诱导的TGF-β1、LN及Ⅳ型胶原的表达水平,呈现出一定的肾脏保护作用。
AM是一种强有力的血管舒张性多肽,属降钙素基因相关肽超家族,广泛分布于心血管系统、肺以及肾脏中[7],最主要的作用是通过扩血管、利尿而维持心血管和肾功能稳态。AM在肾小管上皮细胞有拮抗TGF-β1和促ECM沉积的效应,从而抑制肾小球硬化的发展[8]。此外,AM还可抑制血管紧张素(angiotensin,Ang)Ⅱ的释放,拮抗 AngⅡ的缩血管和平滑肌细胞增殖的作用[9]。本课题组以往研究发现用外源性AM干预时,AngⅡ和TGF-β1的水平下降,提示AM有抑制AngⅡ和TGF-β1的作用,因此DN患者AM合成释放增多是机体对肾脏的代偿性保护作用[10]。Cfh是一种糖蛋白,是补体系统激活中的一个重要的调节因子。近来研究表明Cfh是AM的一种结合蛋白[11]。本课题组以往的研究发现AM对DN具有一定的保护作用,而Cfh可通过增强AM的作用,从而发挥对糖尿病肾脏的保护作用[12]。
肾内肾素-血管紧张素系统 (RAS)活性在DN早期即有所升高,而这一系统在DN的发生发展中扮演着十分重要的角色,过度激活的RAS系统通过促进TGF-β1的表达诱发肾脏病变。高血糖、高循环张力、AngⅡ、糖基化终末产物以及前列腺素类物质等均可以刺激肾脏系膜细胞过度分泌TGF-β1,而TGF-β1又可进一步促进ECM的沉积[13]。目前AngⅡ受体拮抗剂类药物防治DN的大型临床研究已经取得了可喜的结果,然而该类药物的肾脏保护作用机制尚未完全明了。本研究用代文干预高糖培养的大鼠肾脏系膜细胞,结果显示代文能有效降低高糖诱导的TGF-β1表达,同时LN和Ⅳ型胶原的含量也相应下降,并且伴有AM和Cfh的反应性下降。因此笔者认为,代文的肾脏保护作用可能是由于其抑制TGF-β1的表达并进一步降低ECM的沉积而介导的。
近年的研究发现,他汀类药物有着广泛的调脂之外的作用,如抑制细胞增生、促进肿瘤细胞凋亡[14]以及免疫调节等[15]。Kim等[16]报道洛伐他汀能显著改善链脲佐菌素(streptozocin,STZ)诱导的糖尿病大鼠的肾小球硬化和白蛋白尿,这种保护作用可能为血脂改善的结果。由于本实验是体外培养研究,不存在高脂因素的影响,因此笔者认为阿托伐他汀的肾脏保护作用是独立于其降脂作用之外的,其机制可能是由于其抑制TGF-β1的表达并进一步降低ECM的沉积而介导的。
噻唑烷二酮类(thiazolidinediones,TZDs)是一类新型的胰岛素增敏剂,其主要作用是改善IR及相关代谢紊乱。TZDs的靶分子过氧化物酶体增殖活化受体(PPAR)-γ是一类由配体激活的核转录因子,属于Ⅱ型核受体超家族的成员,主要表达于脂肪细胞和脾细胞,在肾脏系膜细胞也有一定数量的表达,在脂肪细胞分化和脂质代谢中起着重要作用。Isshiki等[17]报道TZDs能抑制甘油二酯-蛋白激酶C-胞外信号调节激酶(Diacylglycerol-Protein kinase C-Extracellular signal-regulated kinase,DAG-PKC-ERK) 途径激活,且指出TGF-β1的表达受蛋白激酶C-胞外信号调节激酶 (Protein kinase C-Extracellular signal-regulated kinase,PKC-ERK)途径的调控。因此认为,匹格列酮的肾脏保护作用至少部分是由于其抑制TGF-β1的表达并进一步降低ECM的沉积所致。
综上所述,代文、阿托伐他汀和匹格列酮干预后TGF-β1、AM和Cfh的表达较高糖对照组均显著下降,机制可能与其抑制TGF-β1的表达并进一步降低LN和Ⅳ型胶原的沉积有关。
[1]Nicholas SB.Advances in pathogenetic mecha nisms of diabetic nephropathy[J].Cell Mol Bio(Noisy-le-grand),2003,49(8):1319-1325.
[2]Lee MY,Lee EY,Lee BJ,etal.Beneficial effects of Thiazolidinediones on diabetic nephropathy in OLETF rats[J].Yonsei Med J,2007,48(2):301-307.
[3]Sarafidis PA.Obesity,insulin resistance and kidney disease risk:insights into the relationship[J].Curr Opin Nephrol Hypertens,2008,17(5):450-456.
[4]Toblli JE,Ferrini MG,Cao G,etal.Antifibrotic effects of pioglitazone on the kidney in a rat model of type 2 diabetes mellitus[J].Nephrol Dial Transplant,2009,24(8):2384-2391.
[5]Tanaka M.Beneficial effect of atorvastatin on renal function in patients with type 2 diabetes[J].JInt Med Res,2011,39(4):1504-1512.
[6]Chung S,Park CW,Shin SJ,etal.Tempol or candesartan prevents high-fat diet-induced hypertension and renal damage in spontaneously hypertensive rats[J].Nephrol Dial Transplant,2010,25(2):389-399.
[7]Zudaire E, Cuttitta F, Martynez A.Regulation of pancreatic physiology by adrenomedullin and its binding protein[J].Regulatory Peptides,2003,112(1-3):121-130.
[8]Plank C, Hartner A,Klanke B,etal.Adrenomedullin reduces mesangial cell number and glomerular inflammation in experimental mesangioproliferative glomerulonephritis[J].Kidney Int,2005,68(3):1086-1095.
[9]Liu HC,Ma YX, He J, etal.Effects of adrenomedullin on angiotensin II-induced collagen synthesis in vascular adventitial fibroblasts[J].Zhonghua Xin Xue Guan Bing Za Zhi,2007,35(9):848-853.
[10]李慧敏,蒋秀琴,缪珩.肾上腺髓质素对高糖培养人肾系膜细胞的作用[J].实用老年医学,2004,18(4):195-197.
[11]Elsasser TH,Pio R,Martinez A,etal.Identification,characterization,and physiological actions of factor H as an adrenomedullin binding protein present in human plasma[J].Microsc Res Tech,2002(57):23-27.
[12]耿厚法,缪珩,鲁一兵,等.补体因子H和肾上腺髓质素对高糖培养的HBZY-1大鼠系膜细胞的调节作用[J].中华内分泌代谢杂志,2008,24(3):319-321.
[13]Hilliard LM,Russo LM,Comper WD.Hypertension-mediated albuminuria is associated with reduced lysosomal activity in the kidney and the heart[J].Am JNephrol,2009,29(5):454-464.
[14]Hindler K,Cleeland CS,Rivera E,etal.The role of statins in cancer therapy[J].Oncologist,2006,11(3):303-315.
[15]Pocathikorn A,Taylor RR,Mamotte CD.Atorvastatin increases expression of low-density lipoprotein receptor mRNA in human circulating mononuclear cells[J].Clin Exp Pharmacol Physiol,2010,37(4):471-476.
[16]Kim SL,Han DC,Lee HB.Lovastatin inhibitis transforming growth factor-β1 expression in diabetic rat glomeruli and cultured rat mesangial cells[J].JAm Soc Nephrol,2000,11(1):80-87.
[17]Isshiki K,Haneda M,Kaya D,etal.Thiazolidinedione compounds ameliorate glomerular dysfunction independent of their insulin sensitizing action in diabetic rats[J].Diabetes,2000,49(6):1022-1032.

