链脲佐菌素诱导糖尿病恒河猴胰岛细胞数量的变化
朱 华,徐艳峰,刘 颖,黄 澜,秦 川
(卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
胰腺分为外分泌腺和内分泌腺两部分。外分泌腺分泌胰液,内分泌腺由大小不同的细胞团—胰岛所组成,主要分泌胰岛素,调节糖代谢。人和大、小鼠等实验动物的胰岛细胞按其染色和形态学特点,主要分为A细胞、B细胞、D细胞及 PP细胞,但各种细胞的比例不同。链脲佐菌素(STZ)能选择性破坏B细胞而诱导不可逆糖尿病。本文在小剂量多次注射STZ成功诱导恒河猴糖尿病动物模型的基础上,用免疫组化方法显示各种胰岛细胞的形态和数量变化,结果报道如下。
1 材料和方法
1.1 模型制备
成年恒河猴5只,购自军事医学科学院实验动物中心,年龄4~6岁,体重(5.5~6.5)kg。动物合格证号:SCXK-(军)2007-001。动物使用许可证号:SYXK(京)2010-0030。模型制作方法见参考文献[1]。
1.2 标本制备
模型动物中的3只在给予STZ 19个月,1只动物在给予STZ 20个月时处于濒死状态。动物经戊巴比妥麻醉后股动脉放血处死。取胰腺在10%中性甲醛固定,组织经常规脱水,石蜡包埋。樱花IVS410切片机进行连续切片,厚度4 μm,每隔5片取连续的4片贴在防脱载玻片上,50℃烤箱内烘烤过夜。取毒性试验正常对照组动物胰腺作为对照,切片处理与模型动物相同。
1.3 免疫组化染色
切片经脱蜡、水化、蒸馏水洗,进行 SP法免疫组化染色。步骤:(1)3%H2O2消除内源性过氧化物酶,室温 10 min,PBS洗。(2)正常血清封闭 15 min,滴加第一抗体(rabbit anti-insulin,Santa公司产品,货 号 SC-9618,稀 释 度 1∶300;mouse antiglucagon,福建迈新,货号 BM1621,稀释度 1∶200;rabbit anti-somatostatin,北京中杉金桥,货号 ZA-0232,稀释度 1∶150;rabbit anti-polypeptide,北京中杉金桥,货号 ZA-0211,稀释度 1∶100),4℃ 过夜,PBS洗。(3)滴加第二抗体(辣根过氧化物酶标记山羊抗小鼠、山羊抗兔IgG聚合物,北京中杉金桥,货号 PV-9001,PV-9002),室温孵育 30 min,PBS 洗。(4)DAB显色1~5 min(北京中杉金桥,货号 ZLI-0001),显微镜下控制显色程度,蒸馏水终止显色。(5)苏木素衬染后脱水、透明、中性树胶封片。
1.4 细胞计数与统计学方法
切片光镜下观察后用Aperio切片扫描系统对切片进行扫描,随机截取5个高倍视野(400×),采用Image-Pro PLUS图像分析系统对阳性细胞数和光密度值(IOD)进行分析。每只动物计数3张切片,取平均值。数据用SPSS16.0统计软件处理,两组间比较使用t检验,P<0.05有统计学意义。
2 结果
2.1 各种细胞的比例
对照组组 A、B、D、PP四种细胞的比例约为21%、73%、5%、1%。模型组四种细胞的比例为58% 、32% 、8% 、2%(图 1)。
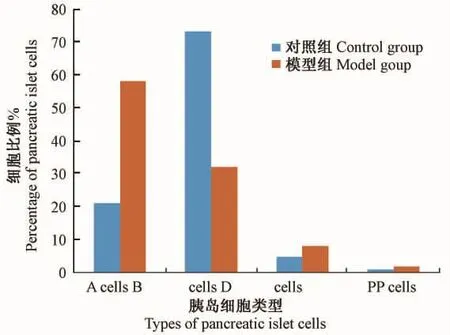
图1 胰岛各细胞比例Fig.1 Percentage composition of the pancreas islet cells in the control and model groups.
2.2 免疫组化
结果可见B细胞胞质在对照组中呈深棕色,分布在胰岛中央区。模型组中B细胞胞质着色变浅(图2A,C),胰岛素表达减少。细胞核蓝色。剩余细胞肥大,分布杂乱。模型组A细胞增生,细胞变密集,分布于胰岛周边部位,在模型组与对照组中均呈现为较深的棕色颗粒(图2B,D,见彩插1)。对照组D细胞数量较少,分布在胰岛 A、B细胞中间。模型组 D细胞增生,生长抑素表达增多(图3A,C)。对照组PP细胞体积较小,数量极少,分布在胰岛周边部位。模型组PP细胞增生,胰多肽表达增多(图3B,D,见彩插2)。
2.3 阳性细胞数及光密度值
模型组B细胞阳性细胞数及光密度值较对照组显著减少(P<0.01)。模型组A细胞阳性细胞数量及光密度值比对照组显著增高(P<0.01)。D细胞阳性细胞数量及光密度值比对照组增高,但差异无显著性。模型组动物PP细胞显著增生,阳性细胞数量及光密度值较对照组显著增加(P<0.05)(表 1)。
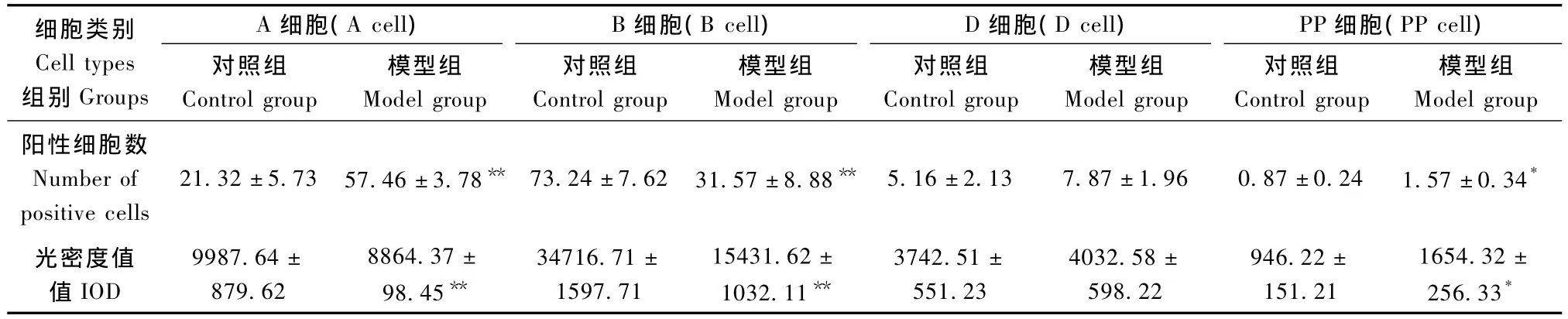
表1 胰岛细胞表达情况及细胞光密度值Tab.1The expression of pancreatic islet cells and IOD of the two groups(ˉx±s,n=4)
3 讨论
自80年代以来1型糖尿病的自身免疫学说已确立[2]。根据多方面的综合研究,已知它是由T淋巴细胞介导的自身免疫性疾病。胰岛B细胞受到自身免疫攻击而选择性地被破坏,胰岛B细胞功能受损,胰岛素分泌绝对或相对不足[3-5]。STZ是一种广谱抗菌素,对大小鼠的胰腺B细胞具有选择性毒性作用,可引起血糖升高及胰岛萎缩等改变,但其发病机制及病理生理改变与人类糖尿病差别较大[6]。小剂量多次注射 STZ通过激活自身免疫过程导致B细胞损伤[7],与 I型糖尿病的发病机理学说类似。本实验的结果显示,小剂量STZ作用于恒河猴胰腺18个月后,胰岛B细胞数量明显减少(P<0.01),胰岛素表达降低,合成和分泌胰岛素的功能减弱较正常动物明显减弱。从组织学上证实此模型与人类糖尿病的相似性。
啮齿类动物的胰腺中,A细胞占15% ~20%,B细胞占60% ~80%,D细胞少于10%,PP细胞不足1%[8]。而在人类胰岛中,A、B、D、PP 四种细胞比例分别为20% ~25%,60% ~75%,5%和少于1%[9]。本实验中,恒河猴胰岛 D细胞、PP细胞比例与啮齿类相差不大,而B细胞比例减少,A细胞比例增多,其细胞比例与人类更接近。
生理情况下,A细胞分泌的高血糖素与B细胞分泌的胰岛素相互拮抗和协调维持了血糖的稳定。正常情况下胰岛素作用占优势。胰岛素绝对或相对不足时,胰高血糖素作用加强而且可以直接作用于B细胞。反映在组织学上即表现为A细胞的增生和胰高血糖素的表达增加。胰岛D细胞分泌的生长抑素是一种含14个氨基酸的肽类激素,可通过旁分泌发挥抑制糖吸收,调节糖代谢的作用。有文献报道给予外源性生长抑素可预防STZ引起的胰岛素分泌障碍[10]。胰岛素分泌不足时,D细胞代偿性增生。本实验结果显示恒河猴胰岛A细胞数量显著增加,胰高血糖素表达增多(P<0.01)。D细胞的数量级表达情况虽然没有统计学意义,但与对照组相比仍有上升趋势。与文献报道相符。
本文在使用STZ成功诱导恒河猴糖尿病动物模型后,利用免疫组化方法显示恒河猴动物模型胰岛各种细胞的数量和激素表达情况,证实其数量及表达与人类糖尿病类似,为模型的应用提供参考。
[1] 朱华,刘颖,马春梅,等.STZ诱导恒河猴糖尿病动物模型的建立[J].中国比较医学杂志,2012,22(6):53-56.
[2] Roland T.Insulin dependent diabetes mellitus[J].Cell,19968,5:291-297.
[3] Eizirik DL,Colli ML,Ortis F.The role of inflammation in insulitis and B-cell loss in type-I diabetes[J].Nat Rev Endocrinal,2009,5(4):219 -226.
[4] Yoon JW, Jun HS. Cellular and molecular pathogetic mechanisms of insulin-dependent diabetes mellitus[J].Ann N Y Acad Sci,2001,928:200 -211.
[5] Mandrup-Poulsen T,Zumsteg U,Reimer J,et al.Invovement of interleukin-1 and interleukin-1 antagonist in pancreatic B-cell destruction in insulin-dependent diabetes mellitus [J].Cytokine,1993,5(3):185-191.
[6] Litwak KN,Cefalu WT,Wagner JD.Streptozotocin-induced diabetes mellitus in cynomolgus monkeys: changes in carbohydrate metabolism,skin glycation,and pancreatic islets[J].Lab Anim Sci.1998,48(2):172 -178.
[7] El-Mahmoudy A, Shimjzu Y, Shiim T, etal.Successful abrogation by thymoquinone against induction of diabetes mellitus with streptozotocin via nitric oxide inhibitory mechanism[J].Int Immunopharmacol,2005,5(1):195 -291.
[8] Brissova M,Fowler MJ,Nicolson,et al.Assessment of human pancreatic isletarchitecture composition by laser scanning confocal microscopy [J].J Histol Cytol,2005,53:1083-1097.
[9] Cabrea O, BermanDM, KenyonNS, etal. Theunique cytoarchitecture human pancreatic islet has implications for islet cell function[J].PNAS,2006,103:2334 -2339.
[10] 张芳林,张闿珍.生长抑素和糖尿病[J].国外医学内分泌分册,2001,21(1):1-3.

