仙台病毒RT-PCR检测方法的建立及灰仓鼠中流行情况调查
李晓波,付 瑞,王 吉,卫 礼,邢 进,冯育芳,岳秉飞,贺争鸣
(中国食品药品检定研究院实验动物资源研究所,北京 100050)
仙台病毒属于副粘病毒科,副粘病毒属,核酸型为单股负链 RNA,基因组全长 15 384 bp[1],编码6 个结构蛋白(L,P,NP,HN,F,M)和一个非结构蛋白C,其基因排序次序为:3'-Leader-NP-P+C-M-FHN-L-Leader-5'[2]。仙台病毒传染性强,容易扩散,是啮齿类实验动物最难控制的病毒之一。啮齿类实验动物感染SeV会对其免疫系统、致瘤作用及繁殖等产生影响,从而影响实验结果[3],动物一旦感染很难清除,严重影响幼鼠生长发育并降低成年鼠的繁殖率[4]。
现有的实验动物种属和品系已越来越不能满足科学快速发展的要求,迫切需要开发更多适应不同要求的新型实验动物,灰仓鼠(Cricetulus migratorius)就是在包虫病研究中筛选出来的一种鼠类。灰仓鼠属于啮齿目,仓鼠科,仓鼠亚科,仓鼠属。广泛分布于中亚地区,栖息生境从荒漠平原至海拔3 000 m以上的高山草甸均有分布。已查明该鼠在自然界参与土拉伦、森林脑炎、鼠疫等多种自然疫源性疾病传播[5,6],并且对仙台病毒易感。目前我国还没有关于灰仓鼠仙台病毒感染的报道,也没有可用于灰仓鼠SV的检测方法。我们针对仙台病毒L基因设计引物,建立了仙台病毒 RT-PCR检测方法,并对60只采自我国新疆地区的灰仓鼠,进行SV感染的检测。
1 材料
1.1 试剂
AMV逆转录酶、随机引物购自 Promega公司;RNA酶抑制剂购自庄盟公司;Taq Hs DNA酶、dNTP、100 bp DNA marker购自宝生物工程(大连)有限公司,RNA提取试剂盒购自Qiagen公司。
1.2 病毒毒株及疫苗
仙台病毒、猴副流感病毒(SV5)、犬瘟热病毒、小鼠肺炎病毒、呼肠孤病毒III型均为本实验室保存。腮腺炎病毒减毒活疫苗来自本院病毒一室。SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
1.3 灰仓鼠
由新疆地方病防治研究所提供。普通级环境饲养,60只,成年,体重在(40~50)g之间,雌雄各半。
2 方法
2.1 病毒的培养
用8~13日龄的鸡胚,SeV毒种接种绒毛尿囊腔,接种后第4天收获尿囊液,冻-70℃备用。
2.2 RNA的提取
取0.5 mL上述上清液按试剂盒的操作说明提取RNA,最后用40 μL去RNA酶的无菌水溶解。
2.3 RT-PCR方法建立
2.3.1 逆转录:25 μL反应体系中含5×RT buffer 5 μL,d NTP(2.5 mmol/L)4 μL,随机引物(500 μg/mL)1 μL,AMV(10 U/μL)0.5 μL,RNA 酶抑制剂(40 U/μL)0.5 μL,病毒 RNA 8 μL,反应条件:37℃90 min,72℃ 15 min,4℃ 5 min。
2.3.2 PCR引物设计:参照NCBI发表的仙台病毒(gi:9627219)基因组序列设计引物,引物信息见表1,由生工生物工程(上海)有限公司合成,使用时用灭菌超纯水稀释为10 μM,PCR产物长度为197 bp。
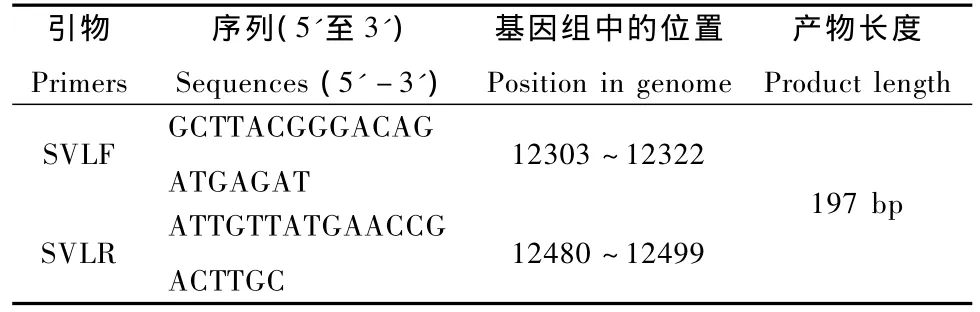
表1 SeV RT-PCR引物Tab.1 Primers for the SeV RT-PCR
2.3.3 PCR扩增:反应体系包括,10×PCR buffer 2.5 μL,dNTP(2.5 mmol/L)2 μL,引物(10 μmol/L)各 1μL,cDNA 2 μL,Taq Hs酶(5 U/μL)0.5 μL,灭菌 dH2O 16 μL。反应条件:94℃ 变性 45 s,56℃ 退火45 s,72℃延伸30 s,共35个循环,最后72℃延伸7 min。
2.4 RT-PCR方法的验证
2.4.1 敏感性:紫外分光法测定SV cDNA浓度,将cDNA10倍系列稀释后进行PCR扩增,测定方法的最大检出限。
2.4.2 特异性:分别提取小鼠肺炎病毒、呼肠孤病毒III型、猴副流感病毒、腮腺炎病毒、犬瘟热病毒、正常鸡胚尿囊液及小鼠肺脏组织 RNA,用建立的RT-PCR法进行检测,测定方法的特异性。
2.5 灰仓鼠的检测
每一份样本按以下方法处理:取灰仓鼠肺脏约100 mg,加入900 μL 灭菌 PBS,匀浆后12 000 r/min 离心10 min,上清液用0.2 μm 滤膜过滤,取400 μL 过滤后的上清,用Qiagen公司的RNA提取试剂盒提取RNA。
3 结果
3.1 RT-PCR结果及测序
3.1.1 RT-PCR结果:SeV毒株提取RNA后经RTPCR扩增,2%琼脂糖电泳,可见在197 bp处有预期的目标条带(图1)。
3.1.2 RT-PCR产物测序:PCR产物直接送上海生工公司测序,测序结果与NCBI数据库比对,与SeV(dbj∣ AB275416.1∣)相应序列符合率达98%(图 2)。
3.2 灵敏性测定
紫外分光光度法测得SeV cDNA的浓度为968.6 μg/mL,将 cDNA 进行 10-1~10-6稀释,随后进行PCR扩增,由图3可见,在10-4稀释的时候仍可见目的条带,说明本研究建立的PCR技术方法能检测的SV cDNA最低浓度是96.8 ng/mL。

图1 SeV毒种RT-PCR扩增Fig.1 RT-PCR amplification for SeV.

图2 SeV毒种RT-PCR产物测序比对结果Fig.2 The BLAST results of sequencing of SeV RT-PCR products.
3.3 特异性测定
分别以小鼠肺炎病毒、呼肠孤病毒III型、猴副流感病毒、腮腺炎病毒、犬瘟热病毒及正常的鸡胚尿囊液和小鼠肺脏组织为对照,用建立的PCR方法进行扩增。电泳结果表明:仅有SV毒株有197 bp的目的条带,而其他对照均没有任何条带(图4),说明本方法有较好的特异性。
3.4 灰仓鼠中SV的检测
3.4.1 取灰仓鼠肺组织,提取总 RNA,采用 RTPCR方法进行检测,结果检测到2份样本阳性(图5只显示部分结果),阳性率为3.33%(2/60)。
3.4.2 SeV阳性样本测序:阳性样本的 PCR产物送上海生工测序,测序结果与NCBI发表的SeV(gb∣DQ219803.1∣)基因组相应序列的符合率为98%,证实为仙台病毒感染(图6)。
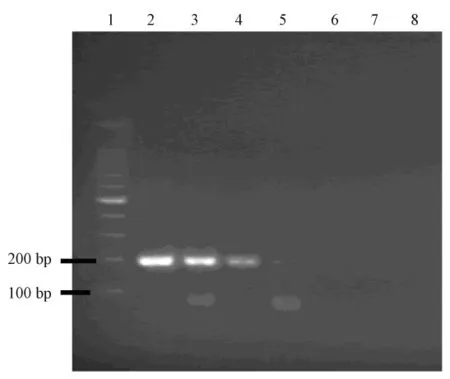
图3 敏感性试验结果1:DNA marker 2~7:SeV cDNA 分别 10-1~10-6稀释 8:阴性对照Fig.3 The results of sensitivity test of the RT-PCR products.Lane 1:DNA marker;2~7:10-1~10-6 dilution of SeV cDNA;8:Negative control

图4 特异性试验结果Fig.4 Results of specificity test of the detection technique for Sendai virus.

图5 60份灰仓鼠样本部分检测结果1:仙台阳性对照 2~11:样本12:阴性对照 M:DNA markerFig.5 Some results of RT-PCR assay for sixty Cricetulus migratorius samples.Lane 1:SeV positive control;2~11:Samples;12:Negative control;M:DNA marker
4 讨论

图6 灰仓鼠SeV阳性样本测序比对结果Fig.6 The BLAST results of RT-PCR products sequencing of SeV-positive samples of Cricetulus migratorius.
本实验的灰仓鼠来自新疆地方病防治研究所,廖立夫教授等早在上世纪90年代就开始从事野生灰仓鼠的驯化繁殖工作,现在已经成功繁育出具有一定规模的动物种群[7],虽然目前已有灰仓鼠用于各种实验研究的报道,但作为一种实验动物,其标准化程度还较低。
实验啮齿类动物是SV的自然宿主,自然条件下SV能感染小鼠、大鼠、仓鼠和豚鼠。灰仓鼠作为新的实验动物品种,迫切需要对其微生物携带情况进行调查,灰仓鼠与实验常用的地鼠同属仓鼠科,仓鼠属,实验动物国标将SV列为SPF地鼠的必检项目[8],因此,我们对灰仓鼠中携带 SeV的情况进行了调查。
血清学调查显示仙台病毒在小鼠等啮齿类实验动物中感染率较高,但国内外还没有灰仓鼠中SV感染率调查的相关报道。病毒的分离鉴定是仙台病毒诊断的金标准,除鸡胚外,SV也可在BHK21或Vero细胞上进行增殖[3],但病毒分离鉴定周期较长,费时费力;目前,国内主要采用ELISA方法检测动物血清中的SV抗体,ELISA虽然具有较高的敏感性,但需要纯度很高的纯化检测抗原,并不适用于检测乳鼠和免疫缺陷动物,同时对抗体的检测不能反应当前病毒的感染情况。PCR技术作为分子生物学检测的重要方法,具有快速、敏感、简便等优点,国内外已有 SV RT-PCR检测方法的相关报道[9-11]。与之相比,我们建立的 SV RT-PCR 检测方法具有更好的特异性和敏感性(结果未显示),适用于对动物当前的病毒感染情况进行调查。
虽然本次检出的灰仓鼠SV感染率较低,阳性动物也无明显临床症状,但是该病毒可通过直接接触和空气传播的方式扩散,给整个种群SV感染的控制带来很大困难,需要引起我们的重视。本实验建立的SV RT-PCR检测方法,也为今后制定灰仓鼠质量标准提供了一定的基础数据。
致谢:感谢新疆地方病防治研究所廖立夫教授等对本课题的大力支持!
[1] Itoh M,Isegawa Y,Hotta H,et al.Isolation of an avirulent mutant of Sendai virus with two amino acid mutations from a highly virulent field strain through adaptation to LLC-MK2 cells[J].J Gen Virol,1997,78:3207 -3215.
[2] 范文平.仙台病毒的分子生物学研究进展[J].中国实验动物学杂志,1999,2:115-119.
[3] 田克恭.实验动物病毒性疾病[M].北京:农业出版社.1991:57- 64.
[4] 吴惠英,卫礼,贺争鸣,等.不同方法检测鼠群Sendai抗体的研究[J].北京实验动物科学,1989,6(1):12-16.
[5] 廖立夫.灰仓鼠实验动物化研究[J].中国实验动物学杂志,2002,12(3):183-185.
[6] 王思博,杨赣源.新疆啮齿动物志[M].乌鲁木齐:新疆卫生出版社.1982.165.
[7] 廖立夫,黎唯.灰仓鼠的室内繁殖研究[J].中国实验动物学报,1998,6(2):33-35.
[8] 实验动物国家标准[S].GB/T14926.23-2001
[9] Hayase Y,Tobita K,Kii M,at al.Detection of nucleoprotein gene of Sendai virus in the lungs of rats by touchdown nested reverse transcriptase ploymerase chain reaction[J].Exp Anim,1997,46(4):307-310.
[10] Bootz F, Sieber I, Popovic D, etal. Comparison ofthe sensitivity of in vivo antibody production tests with in vitro PCR-based methods to detect infectious contamination of biological materials[J].Lab Animals,2003,37(4):341- 351.
[11] 王宗耀,谢建云,邵伟娟,等.仙台病毒 RT-PCR检测方法的建立与应用[J].中国比较医学杂志,2008,18(1):49-53.

