大蒜辣素(二烯丙基硫代亚磺酸酯)性质及相关研究进展
李新霞,林守峰,陈 坚,2
1新疆医科大学药学院药化有机教研室,乌鲁木齐830054;2新疆埃乐欣药业有限公司,乌鲁木齐,830011
大蒜辣素(二烯丙基硫代亚磺酸酯)性质及相关研究进展
李新霞1,2*,林守峰1,陈 坚1,2
1新疆医科大学药学院药化有机教研室,乌鲁木齐830054;2新疆埃乐欣药业有限公司,乌鲁木齐,830011
大蒜辣素作为大蒜的主要生物活性物质因其不稳定性使用受到很大限制,本文综述了大蒜辣素的理化性质及稳定性和大蒜辣素制备及分析方法等研究的相关进展。
大蒜辣素;理化性质;稳定性
大蒜是多年生百合科葱属植物蒜(Allium sativum L.)的地下鳞茎,是历史悠久的药食两用植物。大蒜中公认的标志性成分是蒜氨酸(alliin)和大蒜辣素(allicin)[1],大蒜辣素作为大蒜的主要生物活性物质,由Cavallito和Bailey在1944年首先从碾碎的大蒜中分离得到,并由Cavallito第一个阐明碾碎大蒜有气味成分的物理性质和化学结构,并命名为“allicin”,化学结构为CH2=CH-CH2-S(O)-S-CH2-CH=CH2[2,3]。大蒜辣素是大蒜被粉碎后生成的一个含氧硫化物,它的前体化合物蒜氨酸是稳定的,与蒜酶(蒜氨酸裂解酶,Alliinase)分处大蒜细胞的不同部位,大蒜经粉碎后,蒜氨酸与蒜酶相遇,快速反应产生大蒜辣素(图1)。因此完整、新鲜的大蒜中并没有大蒜辣素,大蒜辣素不稳定,可进一步分解为一系列含硫的化合物。

图1 蒜酶催化裂解蒜氨酸生成大蒜辣素、丙酮酸和氨Fig.1 Alliinase catalytic enzymolysis alliin to generated allicin,pyruvate and amonia
国外大量文献报道大蒜辣素的药理作用,但因其不稳定性,对进一步深入进行大蒜辣素的药学研究等带来一定困难。
1 大蒜辣素的理化性质
大蒜辣素(allicin,Diallyl thiosulfinate),化学名为二烯丙基硫代亚磺酸酯(2-propene-1-sulfinothioic acid,S-2-propenyl ester),分子式C6H10OS2,分子量162.23,纯大蒜辣素为无色油状液体,比重1.112 (20℃,d20),折射率(n20D)1.561,无旋光性,10℃时在水中的溶解度约为2.5%,溶于乙醇、苯、乙醚等有机溶剂[4]。
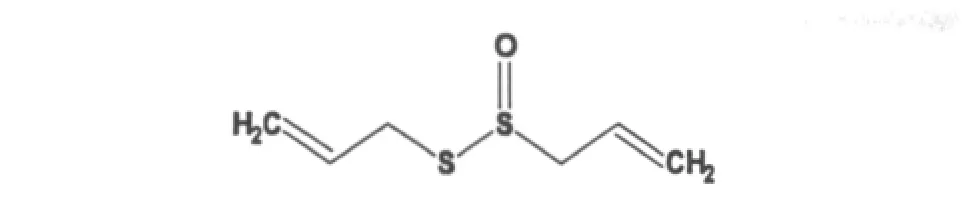
图2 大蒜辣素(Allicin)的化学结构Fig.2 The chemical structure of allicin
纯大蒜辣素对皮肤有刺激性,与其他烯丙基硫化物相比更具有蒜香味[5]。大蒜辣素水溶液的pH值约为6.5,静止可见油状沉淀,随着少量二氧化硫的形成,酸性略有增加,加入碱后烯丙基二硫化物沉淀立即失活,并形成碱性亚硫酸盐[2]。对热和碱不稳定,对酸较稳定[6]。
德国Herwig Jansen[7]等1987年报道大蒜辣素纯品为淡黄色油状液体,采用高效液相的二极管阵列检测器检测大蒜辣素的UV光谱,最大吸收波长为202 nm,特征肩峰接近240 nm,与大蒜辣素水溶液的光谱数据一致(图3)。将大蒜辣素于铝镜表面成膜,采用反射技术测定了大蒜辣素的红外光谱(图4)。
2 大蒜辣素的稳定性研究
大蒜辣素化学性质不稳定,遇光、热或有机溶剂降解成各种含硫有机化合物(图5)。Brodnitz发现大蒜辣素在20℃ 经20小时后几乎完全分解为二烯丙基二硫化物(diallyl disulfide,66%)、二烯丙基三硫化物(diallyl trisulfide,9%)、二烯丙基硫化物(diallyl sulfide,14%)、二氧化硫(sulfur dioxide)及微量的大蒜辣素脱水产物(4和5)[8]。
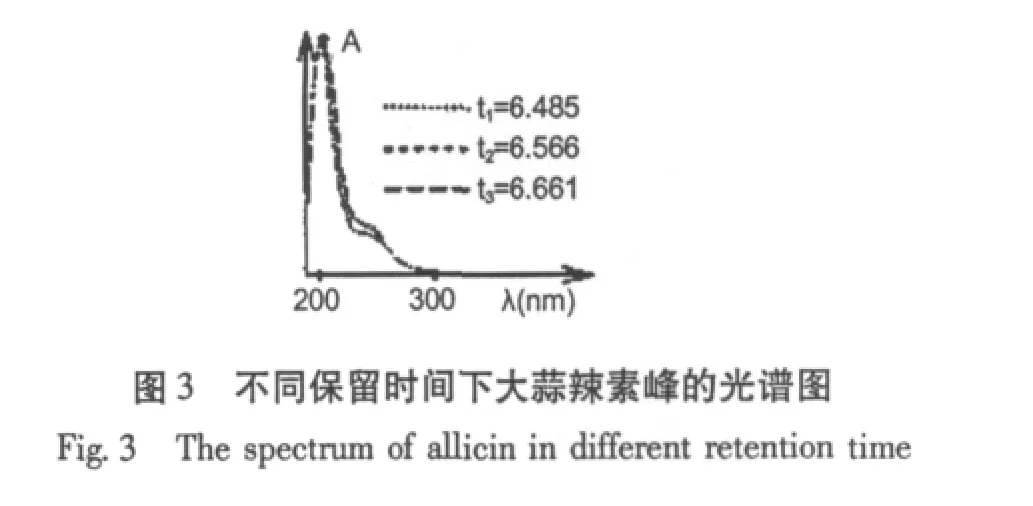
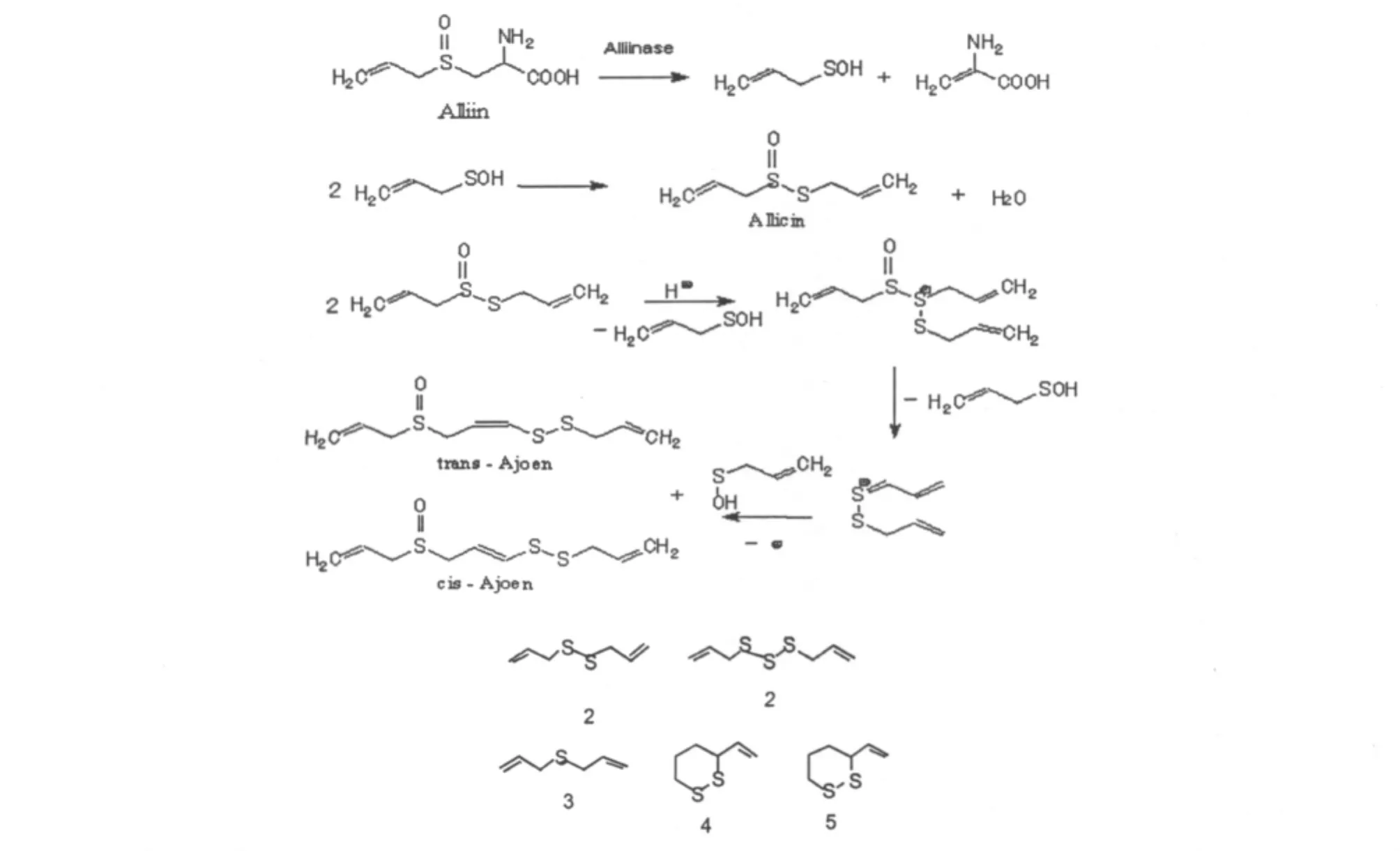
图5 蒜酶催化裂解蒜氨酸生成大蒜辣素及大蒜辣素进一步分解过程及产物Fig.5 Alliinase catalytic enzymolysis alliin to generate allicin and the further decomposed product of allicin
Lawson[9]课题组将大蒜粉碎后提取大蒜辣素,研究结果显示23℃时16 h后被分解,半衰期为30~40 d,但大蒜辣素稀的水溶液更稳定一些。该课题组后期又报道,室温下纯大蒜辣素半衰期是2~16 h;在大蒜汁或破碎大蒜中其半衰期是2.4 d;1∶1大蒜汁和水的稀释液中半衰期是22 d。冷冻干燥可以使大蒜辣素的寿命延长20 d[10]。
日本研究人员Hiroyuki[11]等以美国LKT实验室(LKT Laboratories,MN,USA)提供的含量为99.39%的大蒜辣素对照品(需在-70℃保存,用时开启),研究大蒜水提取物中的大蒜辣素的稳定性,实验时间30 d,在一定温度,大蒜辣素的减少与时间的关系符合一级动力学:Nt=N0e-kt。Nt与N0分别为第t天与第一天大蒜辣素的量,并根据获得的稳定性曲线获得k值后计算半衰期,半衰期t1/2=ln1/ 2/k=-0.693/-k。实验结果,4℃时大蒜辣素的半衰期约为1年(浓度从1.8 mg/mL降至0.9 mg/mL),15℃时的半衰期为32 d,37℃时的半衰期仅为1 d (浓度从2.0 mg/mL降至1.0 mg/mL)。23℃时的半衰期为9.4 d,此数据结果与Lawson课题组研究结果不一致,Hiroyuki认为稳定性与大蒜辣素溶液的浓度有关,差异是浓度不相同所致。
3 大蒜辣素的制备方法
文献报道大蒜辣素的制备方法主要有生物合成法[12]和化学合成法[13]。
Herwig Jansen[7]等以二烯丙基二硫化物、间氯过氧苯甲酸为原料化学合成大蒜辣素,用氯仿、水、乙醚多步提取后减压除去溶剂,得到大蒜辣素的粗品。以Sephadex LH-20(26×580 mm)进行柱分离,粗品中加入150℃干燥的硅胶,于室温干燥的空气流除去乙醚。硅胶-大蒜辣素吸附物于干燥器中以98%硫酸干燥,置于-24℃贮存,三个月大蒜辣素对照品的含量和纯度没有明显减少。硅胶吸附前与吸附干燥后之差为大蒜辣素的量,使用时以流动相提取吸附的大蒜辣素,可作为大蒜辣素对照品,以HPLC测定纯度大于99%,IR、MS对结构进行了确认。
美国专利[14]报道生物合成法制备大蒜辣素,专利中特别指明蒜酶为天然来源,蒜氨酸采用天然来源或人工合成,制成一定浓度水溶液后与蒜酶反应转变为大蒜辣素。以低沸点非极性溶剂提取大蒜辣素。可得到的大蒜辣素纯品,但必须保存在-70℃,以防止大蒜辣素分解。
Gregorio[13]采用另一种化学合成法:称取1 g二烯丙基二硫化物,50 mL二氯甲烷溶解;称取1.69 g单过氧邻苯二甲酸镁(3.42 mmol)(MMPO)和232 mg(0.68 mmol)的(Bu)4NHSO4,用50 mL水溶解后,用0.1 M NaOH中和,用冰醋酸调节pH至4.6,将两溶液加入500 mL的烧瓶中,在室温下,搅拌反应1 h,移走水相,有机相再加50 mL pH 6.6的0.1 mol/L的碳酸铵进行清洗,放入-20℃冰箱1 h,迅速真空抽滤,滤液放在-80℃保存。取12 mL滤液,用N2气流吹去溶剂使成4 mL,用制备型TLC进行分离(条件:硅胶G,正己烷-异丙醇(92∶8)为展开剂),刮下Rf=0.3处的硅胶,用二氯甲烷提取,提取液用旋转蒸发仪浓缩后,得油状残渣,用50 mL水溶解后,用C18小柱进行固相萃取,得纯度相对较高的大蒜辣素。
Rabinkov[15]课题组使用N,N'-二琥珀酰亚胺基碳酸酯(DSC)或者对硝基苯基氯甲酸酯活化载体生成稳定的固定化蒜酶,固定化的蒜酶在室温下被装入柱中,蒜氨酸溶液以7 mL/h流速注入柱中,连续产生大蒜辣素,大蒜辣素生产的效率与固定化酶的比活力有直接的比例。以合成或天然提取的高含量蒜氨酸为原料,蒜酶催化蒜氨酸反应可生成纯度较高的大蒜辣素,一般以有机溶剂提取时可能会使蒜酶失活,美国专利[14]报道正戊烷、乙醚和氯仿不会使蒜酶失活,但甲醇水溶液中甲醇含量大于80%时,会抑制蒜酶活力。
4 大蒜辣素的分析方法
Fujiwara[16]等1955年报道了大蒜辣素纸层析色谱鉴别大蒜辣素的方法,详细描述了展开系统、显色剂及Rf值。
第一个定量测定大蒜辣素的方法是根据丙酮酸的专属性反应,即丙酮酸与2,4-二硝基苯肼的反应[17],之后还有采用丙酮酸与亚硝基铁氰化钠和叠氮碘、N-乙基顺丁烯二酰亚胺及氢氧化钾的2-丙醇溶液[18-20]。这些测定方法均为比色法,最大的缺陷是产生的物质不稳定,此外由于蒜酶裂解大蒜中所有的烷基半胱氨酸亚砜均能生成丙酮酸,所以测定值比实际值偏高。
由于大蒜辣素对热不稳定,有研究采用GC或GC-MS研究了大蒜辣素分解产物,如二硫化物和三硫化物[21,22]来确定大蒜辣素的量。
HPLC法是直接定性和定量测定大蒜辣素及大蒜中的其他成分的方法,由于大蒜辣素对照品来源有限,大多采用内标法定量测定大蒜辣素含量[23,24]。
Marta de Diego[25]等采用RP-C18(4×125 mm)色谱柱,流动相:甲醇-水(50/50,v/v),检测波长220 nm。羟苯乙酯作为内标物,用来检测大蒜粉和大蒜片剂中潜在大蒜辣素的含量。
目前欧洲药典6.0[26]收载的“garlic powder”中大蒜辣素的含量测定也是以羟苯丁酯为内标物,采用C18柱(4×250 mm,5 μm),甲醇-1%甲酸(60∶40)为流动相,检测波长254 nm。测定大蒜辣素峰面积,按1 mg羟苯丁酯相当于8.65 mg的大蒜辣素计算含量。
袁耀佐[27]对欧洲药典中测定大蒜辣素的方法进行了改进。采用羟苯乙酯作为内标物,检测波长改为242 nm,确定1 mg羟苯乙酯相当于4.71 mg的大蒜辣素。
Herwig Jansen[7]等化学合成了大蒜辣素对照品,直接用外标法HPLC反相色谱,流动相为甲醇: 0.1%甲酸水=60∶40,大蒜辣素得到很好分离,以二极管阵列检测器,测定多个波长处的峰高比例,得到对照品的纯度,并测定了地中海区域鲜蒜中的大蒜辣素潜在含量。
Rabinkov[28]研究小组采用高效液相色谱法RPC18柱,甲醇∶0.1%甲酸=60∶40同时测定蒜氨酸和大蒜辣素,并建立一种衍生化光谱法测定大蒜辣素的含量。
5 展望
大蒜辣素是大蒜发挥药效的主要活性成分之一,将其开发为治疗药物是国内外研究的热点,并且愈来愈受到关注。早在1944年Cavallito[1]就报道了小鼠毒性试验表明,大蒜辣素水溶液的静脉给药LD50为 60 mg/kg、皮下给药 LD50为 120 mg/kg。Rabinkov[29]课题小组进行大蒜辣素药物研究在2004年进入研发二期(Phase II),应用类别为抗菌,抗真菌,抗感染治疗,抗血小板治疗,凝血功能障碍治疗,血液学药物,脂蛋白质紊乱治疗,代谢药物。由于大蒜辣素不稳定,动物试验所用的大蒜辣素为临用前由蒜氨酸与蒜酶反应制备,但蒜氨酸为合成品。
国内外学者已经对大蒜辣素形成的两个关键因素蒜酶和蒜氨酸作了大量深入的研究,同时也对大蒜辣素的药用活性和检测方法进行了大量研究,但由于大蒜辣素极不稳定,为从分子水平研究大蒜辣素作用机制带来一定困难。对大蒜辣素理化性质的充分认识,有利于进一步分离、提取、纯化、分析检测和保存大蒜辣素,使大蒜中的这一有效成分的开发和利用取得突破性进展。
1 Iberl B,et al.Quantitative determination of allicin and alliin from garlic by HPLC.Planta Med,1990,56:320-326.
2 Cavallito CJ,Bailey JH.Allicin,the antibacterial principle of Allium sativum.Ⅰ:isolation,physical properties and antibacterial action.J Am Chem Soc,1944,66:1950-1951.
3 Cavallito CJ,et al.Allicin,the antibacterial principle of Allium sativum.Ⅱ:determination of the chemical structure.J Am Chem Soc,1944,66:1952-1954.
4 Merck.Merck Index,13th Edition.New York:Chapman and Hall,2001.49.
5 Eric B,et al.Antithrombotic organosulfur compounds from garlic:structural,mechanistic,and synthetic studies.J Am Chem Soc,1986,108:7045-1055.
6 Block E.The chemistry of garlic and onion.Sci Am,1985,252:94-98.
7 Jansen H,et al.Allicin characterization and its determination by HPLC.Planta Med,1987,53:559-562.
8 Brodnitz MH,et al.Flavor components of garlic extract.J Agric Food Chem,1971,19:273-275.
9 Hahn G,et al.Garlic:the science and therapeutic application of Allium sativum L.and related species.Baltimore:Williams and Wilkins,1996.1-24.
10 Lawson LD.Garlic:A review of its medicinal effects and indicated active compounds.in:phytomedicines of Europe:chemistry and biological activity,ACS symposium series#691.Lawson LD,Bauer R.Eds.Washington DC:American Chemical Society,1998.176-209.
11 Hiroyuki F,et al.Thermostability of allicin determined by chemical and biological assay.J Biosci Biotechnol Biochem,2008,72:2877-2883.
12 Jansen H,et al.Alliinlyase from garlic,Allium sativum,investigations on enzyme/substrate,enzyme/inhibitor interactions,and on a new coenzyme.Planta Med,1989,55:440-445.
13 Gregorio CV.Synthesis of allicin and purification by solidphase extraction.J Anal Biochem,2001,290:376-378.
14 Williams DM,Pant CM.Process for the production of allicin.Pat.US2004247711,2004.
15 Miron T,et al.A method for continuous production of allicin using immobilized alliinase.J Anal Biochem,2006,351:152-154.
16 Fujiwara M,et al.“Allithiamine”,a newly found derivative of vitamin B1 III:On the allicin homologues in the plants of the Allium species.J Biochem,1955,42:591-601.
17 Jager H.Quantitative bestimmung von allian in frischer knoblauch.J Arch Pharm,1955,288:145.
18 Carson JF,Wong FF.A colour reaction for thiosulphinates.Nature,1959,183:1673.
19 Schwimmer S,Mazelis M.Characterization of alliinase of Allium cepa(onion).Arch Biochem Biophys,1963,100:66-73.
20 Nakata C,et al.An improved colorimetric determination of thiolsulfinate.J Anal Biochem,1970,37:92-97.
21 Saghir RA,et al.Determination of aliphatic mono-and disulfides in Allium by gas chromatography and their distribution in the common food species.J Proc Amer Soc Hort Sci,1964,84:386-398.
22 Vernin G,et al.GC-MS computer analysis of volatile sulfur compounds in garlic essential oils.Planta Med,1986,52:96-101.
23 Miething H.Allicin and oil in garlic bulbs HPLC quantitative determination.Deut Apotheker-Zeitung,1985,125:2049-2050.
24 Voigt M,Wolf E.HPLC-bestimmung von.knoblauchwirkstoffen in extrakten,pulver und fertigarzneimitteln.Deut Apotheker-Zeitung,1986,126:591-593.
25 Diego M,et al.Validated liquid chromatographic method for quantitative determination of allicin in garlic powder and tablets.J Sep Sci,2007,30:2703-2707.
26 European Pharmacopoeia Commission.European Pharmacopoeia 6.0.Strasbourg:Council of Europe,2006.1651.
27 Yuan YZ(袁耀佐),et al.High performance liquid chromatographic method for the determination of allicin using ethylparaben as substitute of allicin reference standard.Chin J Anal Chem(分析化学),2008,8:1083-1088.
28 Miron T,et al.A spectrophotometric assay for allicin and allinase activity:reaction of 2-Nitro-5-thiobenzoate with thiosulfinates.Anal Biochem,1998,265:317-325.
29 Eilat S,et al.Allicin.Drugs Fut,1996,21:1101-1111.
Research Advances on Properties of Allicin (Diallyl-thiosulfinate)and Its Relevant Study
LI Xin-xia1,2*,LIN Shou-feng1,CHEN Jian1,21Department of Medicinal and Organic Chemistry,School of Pharmacy,Xinjiang Medical University,Urumqi 830054,Xinjiang,China;2Xinjiang Ailexin Pharmaceutical Co.,Ltd,Urumqi 830011,Xinjiang,China
Allicin is the main bioactive substance of garlic.This paper reviewed the research advances of the physicchemical property and the stability of allicin and preparative and analytical method.
allicin;physic-chemical property;stability
1001-6880(2012)01-0132-05
2010-01-06 接受日期:2010-06-04
国家科技支撑计划(2007BA130B02-4);科技部国家中小企业创新基金(07C26216502091);自治区科技支疆计划(200891124)
*通讯作者 Tel:86-991-4365034;E-mail:lxx6668@163.com
R284.1;R284.2;R284.3
A

