犬干扰素α制备工艺的优化
殷玉和,李莹莹,刘新涛,吴丛梅
(长春工业大学化学与生命科学学院,长春 130012)
犬干扰素α(CaIFN-α)具有广谱抗病毒活性,可治疗犬细小病毒病、犬瘟热等高致死性病毒病[1]。2009年陈红英等[2]利用PCR技术从藏獒犬肝脏基因组DNA中扩增了犬干扰素α全基因,并对该基因进行了克隆和测序。2010年项黎丽等[3]克隆、表达了 CaIFN-α,目的蛋白表达量约为20%。目前还没有关于CaIFN-α大规模生产工艺的系统性研究报道。本文对CaIFN-α序列进行了密码子优化,并设计合成编码CaIFN-α的基因片段,着重对CaIFN-α包涵体的破碎,CaIFN-α蛋白的变性、复性及纯化的方法进行了研究,从而优化CaIFN-α大规模生产工艺。
1 材料与方法
1.1 材料 大肠杆菌E.coli BL21和表达载体pBV220均为本实验室保存;限制性内切酶EcoRⅠ和SalⅠ为英国NEB公司产品;琼脂糖凝胶DNA快速回收试剂盒为德国QIAGEN公司产品;MDCK(犬肾细胞)、VSV(水疱性口炎)病毒为实验室保存;AKTA explorer100蛋白纯化系统(GE Healthcare);发酵罐(BioFlo5000)。
1.2 方法
1.2.1 CaIFN-α基因片段的合成 参照Genbank中CaIFN-α基因序列,使用Codon Usage Database分析大肠杆菌使用密码子偏好性,在不改变氨基酸序列的前提下,替换了除构成mRNA二级结构密码子外的利用率低于15%的密码子,对密码子进行了优化,设计EcoRⅠ和SalⅠ酶切位点,并由上海生物工程有限公司合成,得到优化的CaIFN-α基因片段。
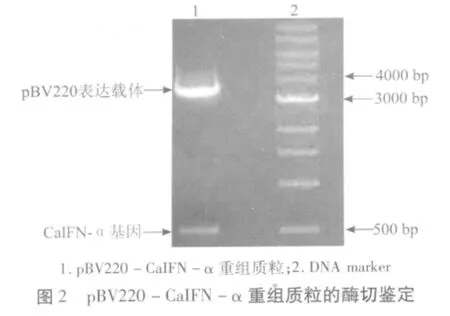
1.2.2 构建pBV220-CaIFN-α重组表达质粒将pBV220温度诱导型表达载体,用EcoRⅠ、SalⅠ双酶切,切下表达载体片段进行胶回收,用T4连接酶连接合成的CaIFN-α基因片段与pBV220表达载体,构建 pBV220-CaIFN-α重组质粒,经EcoRⅠ、SalⅠ双酶切鉴定,证实构建正确。
1.2.3 重组质粒pBV220-CaIFN-α的诱导表达将重组质粒pBV220-CaIFN-α转化表达菌E.coli BL21,按1%接种量将E.coli BL21工程菌接种于200 mL含氨苄青霉素(50 μg/mL)的LB培养液中,30℃振荡培养过夜。将培养物按5%接种量接种于1 L含氨苄青霉素(50 μg/mL)LB培养液中,30℃培养。至 OD600=0.6时,将二代培养物按10%接种量接种于40 L发酵罐中,30℃培养,至OD600=1~2时,快速升温至42℃,菌体表达,过程中适量添加补料(30%葡萄糖),控制pH值为7,培养5 h,4000 r/min离心30 min,收集表达菌体,用SDS-PAGE检测表达结果。
1.2.4 CaIFN-α包涵体的制备 将发酵收集菌体按1∶10悬浮于TE缓冲液中,冰浴条件下超声破碎30 min(超声仪频率20 kHz,超声5 s,间隔5 s),镜检,菌体破碎率90%停止破碎,10000 r/min离心15 min,弃上清,即得CaIFN-α包涵体粗品。
1.2.5 CaIFN-α包涵体的洗涤、变性及复性 将CaIFN-α包涵体粗品按1∶5悬浮于4 mol/L尿素(pH=8.5)中,吹打均匀,10000 r/min离心15 min,弃上清,收集沉淀;将沉淀按1∶5溶于7 mol/L盐酸胍(pH=11)中,混合均匀,裂解作用2~3 h,10000 r/min离心15 min,收集上清,得 CaIFN-α包涵体的溶解液;将包涵体溶解液用2.5 mol/L盐酸胍(pH=11)按1∶3稀释后,按1∶8加入到0.15 mol/L硼酸溶液(pH=9.6)中,4℃复性作用18 h后,得到复性液。
1.2.6 CaIFN-α目的蛋白疏水层析 在复性液中加入(NH4)2SO4至终浓度为1.5 mol/L,上载疏水层析(HIC)柱,柱料为 Phenyl Sepharose 6FF(LS),平衡液为50 mmol/L PB、1.5 mol/L(NH4)2SO4(pH 7.8),洗脱液为 50 mmol/L PB、1 mol/L(NH4)2SO4(pH 7.8),利用AKTA蛋白纯化系统控制,收集洗脱蛋白样品。样品进行SDSPAGE纯度检测,Lowry法测定蛋白浓度,鲎试剂检测内毒素。再生液为0.5 mol/L NaOH,再生色谱柱。
1.2.7 CaIFN-α目的蛋白分子筛层析 将上述收集样品上载分子筛层析(Sephacryl-S-100),洗脱液为20 mmol/L PB、0.85%NaCl(pH 7.4),利用AKTA蛋白纯化系统控制,收集洗脱蛋白样品。样品进行SDS-PAGE纯度检测,Lowry法测定目的蛋白浓度,鲎试剂检测内毒素。再生液为0.1 mol/L NaOH,再生色谱柱。
1.2.8 CaIFN-α活性测定 采用细胞病变抑制法[4-5],依据抑制 VSV(水疱性口炎)病毒攻击MDCK(犬肾细胞)细胞病变的方法,测定重组犬干扰素的活性。将MDCK接种于96孔板,5%CO2、37℃培养为单层,加倍比稀释的重组犬干扰素作用24 h,每孔再加入含100 TCID50的VSV病毒,设计标准品对照和空白对照组,24 h后用结晶紫染液染色细胞,酶标仪上检测测定波长为570 nm,参比波长为630 nm,经SOFT max PRO软件分析输入稀释倍数后,以标准品校正生物活性值。
1.2.9 制备三批CaIFN-α蛋白 按上述工艺制备三批CaIFN-α蛋白,记录不同批次CaIFN-α蛋白的质量检测数据。
2 结果
2.1 CaIFN-α目的基因片段的合成 经密码子优化得到的CaIFN-α基因,由上海生物工程有限公司合成。琼脂糖凝胶电泳,紫外灯下观察鉴定,结果如图1所示。由图1可见,CaIFN-α基因大小约为510 bp,与理论大小相符。
2.2 pBV220-CaIFN-α重组质粒的酶切鉴定pBV220-CaIFN-α重组质粒经EcoRⅠ、SalⅠ双酶切,有明显的pBV220表达载体条带和CaIFN-α基因条带,说明pBV220-CaIFN-α重组质粒构建成功,结果如图2所示。
2.3 pBV220-CaIFN-α重组质粒诱导表达结果鉴定 诱导条件:30℃培养,升温42℃诱导。诱导后每隔1 h取样1次,经SDS-PAGE检测,结果如图3所示,诱导后在18000处出现明显CaIFN-α蛋白条带,说明重组质粒有表达。随诱导时间增加,CaIFN-α蛋白表达量增大,诱导5 h CaIFN-α蛋白表达效果最佳,蛋白表达量(目的蛋白与总蛋白的百分比)为25%。


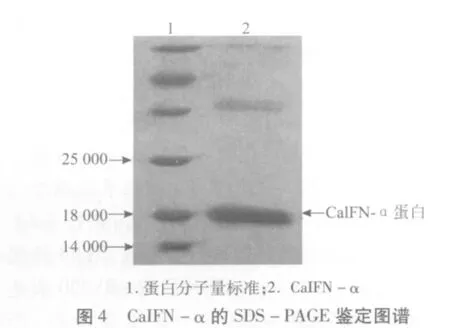
2.4 pBV220-CaIFN-α包涵体破碎、变性及复性表达菌体经过超声破碎得到包涵体,再经7 mol/L盐酸胍变性和0.15 mol/L硼酸复性作用后,可得到初步纯化的CaIFN-α蛋白。复性后CaIFN-α蛋白SDS-PAGE鉴定结果如图4所示,在18000处出现明显CaIFN-α蛋白条带。
2.5 CaIFN-α目的蛋白疏水层析 样品用50 mmol/L PB、1 mol/L(NH4)2SO4(pH 7.8)洗脱液,经疏水层析柱纯化,图5为AKTA蛋白纯化系统紫外检测记录,洗脱峰为CaIFN-α蛋白峰。图6为疏水层析纯化后样品的SDS-PAGE检测结果,在相对分子质量18000处出现一条明显的特异性蛋白条带。


2.6 CaIFN-α目的蛋白分子筛层析 收集的洗脱样品用20 mmol/L PB、0.85%NaCl(pH 7.4)洗脱液,经分子筛层析柱纯化,图7为AKTA蛋白纯化系统紫外检测记录,洗脱峰为CaIFN-α蛋白峰,纯度较高。图8为分子筛层析纯化后样品的SDS-PAGE检测结果,在相对分子质量18000处出现一条明显的特异性蛋白条带,且几乎没有其他杂蛋白条带。
2.7 制备工艺各步骤质量检测 表1中显示为包涵体复性、疏水层析和分子筛层析三个纯化步骤的质量检测数据,总产率为20%。
2.8 不同批次制备CaIFN-α的质量检测 如表2所示,制备的三批CaIFN-α质量检测结果表明,CaIFN-α纯度均≥96%,产率均≥20%,内毒素均≤10 EU/mg,且都具有较好的生物活性,说明本制备工艺稳定性好,可重复性高。

图7 分子筛层析的紫外检测

图8 CaIFN-α纯化蛋白的SDS-PAGE鉴定图谱

表1 不同纯化步骤质量检测

表2 不同批次CaIFN-α的质量检测
3 讨论
本研究使用Codon Usage Database对大肠杆菌的密码子偏好性进行了分析[6-7],在不改变氨基酸序列的前提下,将低利用率的稀有密码子替换为表达菌常用的密码子,对CaIFN-α基因进行了优化改造,提高了CaIFN-α基因的表达水平。选择将CaIFN-α基因与pBV220温控型原核高效表达载体[8]连接构建重组质粒,转化表达菌E.coli BL21,培养时间为4 h,升温诱导表达时间为5 h,整个发酵培养周期较短,且表达体系具有抗污染能力强的特点[9]。
由于疏水层析介质具有疏水性弱的特点[10],并以高盐的水溶液作为流动相,使得与蛋白质的作用过程比较温和。CaIFN-α蛋白以包涵体形式存在,具有较强的疏水性,所以本研究选用疏水层析的方法进行纯化,可以更好保持CaIFN-α蛋白的天然结构和生物活性。疏水层析纯化的CaIFN-α样品上载分子筛层析柱进一步纯化,可以实现更替CaIFN-α样品缓冲液的目的。分子筛层析纯化得到的CaIFN-α样品缓冲液为对动物体无害的磷酸盐体系,便于目的CaIFN-α蛋白的进一步制剂应用。
采用上述生产工艺制备了三批CaIFN-α蛋白,计算其总产率均≥20%,目前所报道的CaIFN-α产率为13.75%[11],与之相比产率有所提高。工艺中采用常规蛋白质色谱分离方法和常见的无机盐试剂,使得制备过程简单易行且更为安全。质量检测结果表明该CaIFN-α生产工艺适合大规模生产,且具有收率高、稳定性好的特点。
[1]刘宇鹏,吴 琼,任晓慧,等.兽用干扰素的研究进展[J].现代农业科技,2007,(11):131-132.
[2]陈红英,董海聚,崔保安,等.藏獒犬α干扰素全基因的克隆与序列分析[J].安徽农业大学学报,2009,36(1):124-127.
[3]项黎丽,闫若潜,盛 敏,等.犬α干扰素的克隆、表达及纯化[J].中国动物检疫,2010,27(1):35-38.
[4]吴艳花,汪 明,吴志光.德国牧羊犬γ干扰素基因克隆表达与抗病毒活性测定[J].中国兽医杂志,2008,44(6):3-5.
[5]陈忠广,张桂红,夏春丽,等.犬干扰素-γ的稀释复性及活力测定[J].东北农业大学学报,2008,39(9):82-86.
[6]王 侃,刘次全,曹 槐,等.大肠杆菌mRNA编码区长度、形成二级结构倾向与密码子偏好性的关系[J].微生物学报,2006,46(6):895-899.
[7]周红梅,陈 哲,蔡兆伟,等.秀丽隐杆线虫fat-1基因密码子优化、克隆及家兔表达载体构建[J].江苏农业科学,2010,(6):27-31.
[8]陈金中,薛京伦.载体学与基因操作[M].北京:科学出版社,2007:54-69.
[9]屈 伸,刘志国.分子生物学实验技术[M].北京:化学工业出版社,2007:190-200.
[10]郭立安,常建华.蛋白质色谱分离技术[M].北京:化学工业出版社,2011:258-259.
[11]任玉莹,范泉水,邱 薇,等.基因工程犬干扰素α的制备及纯化工艺[J].生物技术通讯,2009,20(1):47-49.

