槲皮素对大鼠脑胶质瘤抑瘤作用的体内实验研究
郭二坤 郝亮 梁朝辉 申海龙 李玉萍 马东进 焦保华
脑胶质瘤是神经系统最常见的原发性肿瘤,其发病率占颅内原发肿瘤的 44.7%[1],其恶性程度高,手术治疗后易复发,且致死、致残率均较高,对患者生命及生活质量造成极大威胁。化疗是脑胶质瘤治疗的重要补充,槲皮素作为一种黄酮类化合物,多项研究[2-4]显示槲皮素对多种肿瘤的生长具有抑制作用,是目前最强的抗肿瘤药物之一。增殖细胞核抗原 (proliferating cell nuclear antigen,PCNA)作为一种调节细胞增生的核蛋白,直接参与肿瘤细胞增殖过程中的DNA复制,能够准确有效的反映肿瘤细胞的增殖能力,在肿瘤增殖活性的研究中被广泛应用[5]。 国内学者[6]有报道槲皮素对大鼠脑胶质瘤C6细胞具有抑制增殖及促进凋亡的作用,但槲皮素对C6大鼠体内脑胶质瘤是否具有抑制增殖的作用?本实验通过建立C6大鼠脑胶质瘤模型,探讨槲皮素对C6大鼠脑胶质瘤的抑瘤作用及其作用机制。
1 材料与方法
1.1 研究对象 雄性SD大鼠35只(河北医科大学试验动物中心);C6脑胶质瘤细胞株 (天津医科大学总医院提供)。药品和试剂:槲皮素注射液(河北医科大学药学院);顺铂(CDDP,山东齐鲁制药厂);PCNA鼠抗 IgG单克隆抗体 (Santa Cruze公司);MRI扫描仪(MiniMR⁃60实验动物核磁共振成像仪,上海纽迈电子科技有限公司)。
1.2 细胞培养及细胞悬液制备 将大鼠C6脑胶质瘤细胞复苏,加入含10%已灭活胎牛血清的RPMI⁃1640 培养基(含 NaHCO32 g/L,青霉素 100 U/mL,链霉素 100 U/mL)中,将培养瓶放入含 5%CO2,37℃恒温密闭细胞培养箱中培养,取10 μL对数生长期C6细胞,用红细胞计数板光镜下计数,调节浓度使毎10 μL含1×106个细胞,然后按1∶9加入0.4%台盼蓝等渗盐溶液,1 min内确认C6胶质瘤细胞存活率>95%。
1.3 大鼠脑胶质瘤模型的制作 鼠龄7周雄性大鼠,水合氯醛腹腔内麻醉,大鼠脑立体定向仪头架固定头部,两耳针深入外耳道,剪去头顶部毛发,消毒,铺洞巾。剪开头皮,逐层暴露至颅骨,确定前囟位置。囟中点前1 mm,矢状缝右侧旁开3.0~3.5 mm,接种部位为大鼠右侧尾状核,自接种点垂直进针,从接触硬膜开始计算,进针深度约6 mm,后退1 mm,将微量注射器内10 μL细胞悬液 (含有约1.0×106C6细胞),缓慢注入,拔针后用骨蜡封闭,逐层缝合头皮。给予3 d含抗生素的饮用水预防感染。接种后10 d,行强化头部MRI,确定是否有肿瘤形成。将荷瘤鼠随机分3组:对照组,槲皮素组,顺铂组。分别给予以下处理:①对照组:腹腔内注射二甲基亚砜(Dimethyl sulfoxide,DMSO)0.2 mL,生理盐水1 mL,每日1次,共7次;②槲皮素组:每天腹腔内注射槲皮素50 mg/kg,生理盐水1 mL,每日1次,共7次;③顺铂组:腹腔内注射DMSO 0.2 mL,顺铂1 mg/kg(溶于1 mL生理盐水),每日1次,共7次。
1.4 抑瘤率的计算 每组大鼠行头颅MRI检查,记录肿瘤体积。然后断头处死大鼠,切取肿瘤组织,4%多聚甲醛固定,测量肿瘤长短径,按照公式计算各组抑瘤率。抑瘤率= (空白对照组肿瘤体积-治疗组肿瘤体积)/空白对照组肿瘤体积 ×100%,抑瘤率≥30%为肿瘤对药物敏感。其中肿瘤体积=a×b×π/6(a为测量的肿瘤短径,b为肿瘤长径)。
1.5 HE染色观察 肿瘤组织10%甲醛固定,常规包埋蜡块,切片进行HE染色,光镜下观察肿瘤细胞数量、密度及坏死情况。
1.6 透射电镜观察 4%戊二醛固定肿瘤组织,逐步固定、漂洗、脱水干燥后,超薄切片,在透射电子显微镜下观察肿瘤组织超微结构。
1.7 免疫组化测定PCNA 常规包埋蜡块,切片进行免疫组化 SP法染色,一抗浓度(1∶100),DAB显色,苏木精复染,封片,光镜下观察,结果以胞核或(和)胞质中出现棕黄色或褐色颗粒为阳性,光镜高倍视野下(400×)阳性细胞数所占总肿瘤细胞数的百分率为PCNA标记指数。
1.8 统计学分析 应用SPSS 11.0,实验所得数据以均数±标准差()表示,采用t检验、方差分析及两两比较SNK⁃q检验进行统计学处理,检查水准α=0.05。
2 结果
2.1 肿瘤体积和抑瘤率的比较 实验中有3只大鼠死于脑出血,1例死因不详,1例死于颅内感染,模型建立成功率85.7%(30/35),对存活的30只荷瘤鼠随机分为3组继续实验。槲皮素组、顺铂组及对照组肿瘤体积分别为 (59.6 ± 5.4)mm3,(66.2 ±5.9)mm3和(101.1 ± 9.6)mm3(图 1),槲皮素组治疗效果优于顺铂组,具有统计学差异(t=10.61,P<0.01)。计算槲皮素组和顺铂组的抑瘤率分别为 41.3%和 34.8%,均 >30%,显示肿瘤对两种治疗均敏感。
2.2 HE染色观察 对照组C6胶质瘤内可见生长活跃的肿瘤细胞密集成群,瘤细胞异型性明显,细胞核大深染,核分裂像多见。顺铂治疗组肿瘤细胞数量较对照组减少,围绕增生小血管或坏死灶云集在一起呈花环状。槲皮素组C6胶质瘤细胞生长密度较对照组降低,细胞体积变小,细胞核形态相对规则,有大片坏死,并可见核固缩的凋亡细胞(图 2)。
2.3 透射电镜观察 对照组C6胶质瘤细胞核呈不规则形状,细胞核大,可见核切迹,细胞胞膜结构完整。顺铂和槲皮素组C6胶质瘤细胞核固缩,染色质趋边聚集,排列于核膜内侧,呈早期凋亡改变,细胞胞膜结构消失(图3)。
2.4 免疫组化观察 PCNA阳性颗粒着色于细胞核,呈棕黄色。槲皮素组、顺铂组、对照组肿瘤细胞阳性细胞数分别为 42.2% ± 5.1%,50.0% ± 6.7%,79.6%±8.6%,治疗组与对照组比较,具有统计学差异(F = 416.12,P < 0.01),两治疗组间相比较,槲皮素组效果优于顺铂组 (q = 55.12,P < 0.05)(图4)。
3 讨论
胶质瘤是最常见的颅内原发性肿瘤,呈浸润性、扩展性生长,手术难以根除,且多数胶质瘤对放射线不敏感,化疗药物又难以透过血脑屏障,目前尚缺乏满意的治疗手段,因此如何有效的控制甚至治愈胶质瘤仍是亟待解决的难题。
槲皮素是一种常见的黄酮类化合物,具有清除自由基及通过细胞内信号调节来减轻细胞氧化损伤的作用[7]。 国内学者[8]发现槲皮素对大鼠癫痫持续状态所造成的神经元损伤能够起到保护作用。研究者[2-4]发现槲皮素的抗肿瘤活性除基于上述机制之外,还参与基因表达、胞内信号级联放大及酶活性调节等诸多机制,从而达到抑瘤作用。而最近的研究发现[9],槲皮素能够减弱肝脏炎症反应,降低肝脏纤维化进程及防治肝癌的发生具有重要作用,并发现这一机制可能与槲皮素能够使双调蛋白及/表皮生长因子受体信号传导机制失调有关。因此,发挥槲皮素潜在的抑瘤作用,成为人们进行抗肿瘤治疗研究的热点课题。
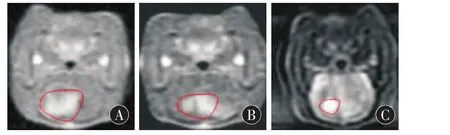
图1 经头颅MRI观察各实验组大鼠肿瘤大小
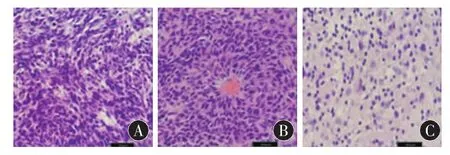
图2 各实验组荷瘤鼠HE染色比较(标尺20 μm;HE 100×)

图3 透射电镜观察各实验组荷瘤鼠超微结构

图4 免疫组织化法检测各实验组肿瘤组织PCNA表达 (示阳性物质着色于细胞核,标尺 20 μm;DAB显色 ×100)
文献报道槲皮素可显著抑制HeLa细胞增殖并诱导其凋亡,槲皮素与顺铂联合应用具有协同效应[10]。本实验中,我们通过给予荷瘤鼠不同的干预措施,结果显示治疗组胶质瘤体积较对照组显著减小,电镜及HE染色观察到对照组胶质瘤细胞仅有轻度凋亡以及坏死,肿瘤细胞密集,增生毛细血管较多,而经槲皮素和顺铂治疗后,瘤细胞增殖受到抑制,瘤细胞密度减小,且出现多量的凋亡细胞,并可见大片状坏死灶。这说明了槲皮素对胶质瘤的生长的确存在抑制作用,在那么,它是通过什么机制来发挥抗肿瘤作用的?研究者将PCNA表达用于评估脑胶质瘤增殖活性的研究,并发现随病理分级的增加,PCNA阳性表达率增高,表明PCNA的表达程度是评估脑胶质瘤增殖活性及其恶性程度的良好指标[11]。
另外,PCNA做为细胞周期内源性组织标记物,在正常脑组织中不表达,却在胶质瘤中呈高表达,能够反映肿瘤细胞增殖活性,对分析判断胶质瘤增殖、分化及预后有重要意义[12]。因此,我们选取PCNA作为研究对象,对槲皮素抗肿瘤的可能作用机制进行了初步探讨,结果显示经槲皮素和顺铂治疗后的胶质瘤组织中PCNA表达明显降低,槲皮素组疗效优于顺铂组,据此,我们可以推测槲皮素对大鼠颅内胶质瘤的抑制作用可能是通过抑制肿瘤细胞增殖及诱导肿瘤细胞凋亡作用实现的,但槲皮素抗胶质瘤生长的确切靶点及其更深入的分子生物学机制仍需要进一步探索。
[1]王忠诚,神经外科学[M].武汉:湖北科学技术出版社,1998,391-396.
[2]Choi JA,Kim JY,Lee JY,et al.Induction of cell cycle arrest and apoptosis in human breast cancer cells by quercetin[J].Int J Oncol,2001,19(4):837-844.
[3]Fridrich D,Teller N,Esselen M,et al.Comparison of delphinidin,quercetin and (- )-epigallocatechin-3-gallate as inhibitors of the EGFR and ErbB2 receptor phosphorylation[J].Mol Nutr Food Res,2008,52(7):815-822.
[4]Jung JH,Lee JO,Kim JH,et al.Quercetin suppresses HeLa cell viability via AMPK induced HSP70 and EGFR down-regulation[J].J Cell Physiol,2010,223(2):408-414.
[5]龙江,朱贤立,杨志敏,等.PTEN/MMAC1基因表达与星形细胞瘤细胞增殖的相关性研究[J].中国临床神经外科杂志,2004,19(5):341-334
[6]周立祥,罗毅男,付双林,等.槲皮素对大鼠脑胶质瘤C6细胞增殖调控的作用[J].吉林大学学报(医学版),2006,32(2):251-253.
[7]Mercer LD,Kelly BL,Horne MK,et al.Dietary polyphenols protect dopamine neurons from oxidative insults and apoptosis:investigations in primary rat mesencephalic cultures[J].Biochem Pharmacol,2005,69(2):339-345.
[8]李蜀渝,肖波,毕方方,等.槲皮素对大鼠癫痫持续状态后海马XIAP mRNA与蛋白表达的影响[J].中国神经精神疾病杂志,2008,34(9):542-545.
[9]Cuevas MJ,Tieppo J,Marroni NP,et al.Suppression of Amphiregulin/EpidermalGrowth FactorReceptorSignalsContributes to the Protective Effects of Quercetin in Cirrhotic Rats[J].J Nutr,2011,5(1):1-7.
[10]杨洋,张蔚,黄丽琼,等.槲皮素联合顺铂对宫颈癌HeLa细胞增殖及凋亡的影响[J].武汉大学学报(医学版),2009,30(3):334-336.
[11]Kayaselcuk F,Zorludemir S,Gumurduhu D,et al.PCNA and Ki-67 in central nervous system tumors:correlation with the histological type and grade[J].J Neurooncol,2002,57(2):115-121.
[12]Marinovic J,Ljubkovic M,Stadnicka A,et al.Role of sarcolemmal ATP-sensitive potassium channel in oxidative stress induced apoptosis: mitochondrial connection[J].Am J Physiol Heart Circ Physiol,2008,294(3):1317-1325.

