桑肠杆菌VL4-3转化阿魏酸生产香兰素
喻林,魏敏,陈义坤,罗诚浩,宋旭艳,王洁,陈勇
(1.湖北大学中药生物技术省重点实验室,湖北 武汉 430062;2.湖北中烟工业有限责任公司技术中心,湖北 武汉 430040)
香兰素(Vanillin)又名香草醛,化学名为3-甲氧基-4-羟基苯甲醛.是一种以奶油香草为特征的风味物质,广泛用于冰淇淋、巧克力、乳制甜点、奶油糖果、焙烤食品、豆奶、可乐饮料和烟酒等食品制造中[1].香兰素年用量很大,多数为化学合成[2],其中以愈创木酚和木质素为原料合成的香兰素为主[3].天然香兰素主要是从香荚兰豆荚中提取,由于香荚兰植物的种植受地域和气候环境的限制,产量极少,远远不能满足市场的需求[4].但是大多数化学合成的香兰素在纯度、香气、安全性等方面都亚于天然提取的香兰素,并且化学工艺产生的废弃物对环境存在很大危害.近年来,美国和欧洲的法律认可采用生物活细胞或其中的组成部分所生产的物质为天然产物[5].因此,利用微生物转化法生产天然香兰素成为目前的研究热点[6].本实验室从香荚兰茎中筛选得到的一株桑肠杆菌VL4-3,并首次发现其能转化阿魏酸生产香兰素,对其发酵转化阿魏酸生产香兰素的发酵工艺进行了研究.
1 材料与方法
1.1菌种与培养基桑肠杆菌VL4-3:从香荚兰植物的茎中筛选得到,并经过生理生化分析、16SrDNA扩增和序列分析鉴定为桑肠杆菌(Enterobactermori).斜面培养基(马铃薯葡萄糖琼脂培养基):马铃薯浸液200 mL/L,葡萄糖20 g/L,琼脂13 g/L.原始种子培养基(牛肉膏蛋白胨培养基):牛肉膏5 g/L,蛋白胨10 g/L,氯化钠5 g/L.发酵原始培养基(高氏一号培养基):可溶性淀粉20 g/L,KNO31 g/L,NaCl 0.5 g/L,K2HPO40.5 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.01 g/L.麦芽糖蛋白胨培养基:麦芽糖50 g/L,蛋白胨10 g/L,氯化钠5 g/L.
1.2试剂与仪器试剂:甲醇(色谱纯);冰乙酸(分析纯);香兰素(Sigma-Aldrich 公司,99.99%);阿魏酸(陕西森弗生物技术有限公司,98%)及其储备液(称取一定量的阿魏酸,在热水中加热至完全溶解,用1 mol/L的氢氧化钠调pH到7.0,定容到30 g/L,然后用过滤法灭菌,4 ℃避光保存).香兰素(Sigma-Aldrich 公司,99.99%). 仪器:Aglient 1100 高效液相色谱仪,柜式恒温摇床(武汉中科科仪技术发展有限公司,HQL 300 B),无菌操作台(苏净集团安泰公司,SW-CJ-1FD).
1.3培养方法初始种子液培养方法:用接种环挑取一环L4-3到装有200 mL液体种子培养基的500 mL三角瓶中,30 ℃,150 r/min培养24 h.
初始发酵方法:将L4-3菌种以10%(V/V)的接种量接入到发酵培养基中,30 ℃,150 r/min培养24 h,加入2.7 g/L的阿魏酸,30 ℃,150 r/min培养12 d.
1.4样品含量测定方法取一定量的发酵液,按1∶4的比例加入甲醇,震荡30 min,11 000 r/min离心5 min取上清,0.22 μm滤膜过滤(过滤时弃掉首先滤出的3 mL).经上述处理的发酵液用高效液相色谱检测香兰素含量,色谱条件为:Agilent Eclipse XDB-C8色谱柱 (5 μm,4.6 mm*150 mm),甲醇/0.5%冰乙酸(30/70,V/V)流动相,流速 1 mL/min,检测波长280 nm,进样量 10 μL,检测时间 40 min.用50%甲醇溶液配制1 g/L的标准样品溶液,稀释成一系列不同浓度,每次进样10 μL,以峰面积对标准样品浓度作图,绘制标准曲线.香兰素浓度和摩尔转化率计算方法为:C香兰素=(A香兰素峰面积-23.948)/40.989;摩尔转化率/%=(n香兰素/n阿魏酸)×100.
2 结果及分析
2.1 发酵培养基对香兰素产量的影响
2.1.1 碳源对香兰素产量的影响 以高氏一号培养基为基础培养基,固定氮源和无机盐,分别以淀粉、葡萄糖、蔗糖、D-果糖、麦芽糖、麦芽浸粉、麸皮和谷壳作为碳源,浓度均为20 g/L,考察不同碳源对香兰素产量的影响.由图1可知,不同碳源对香兰素产量影响由高到低依次是谷壳、麸皮、蔗糖、淀粉、麦芽浸粉、麦芽糖、葡萄糖和果糖.实验结果表明缓效碳源(麸皮和谷壳)比速效碳源更易于桑肠杆菌VL4-3将阿魏酸转化为香兰素,这可能是由于缓效碳源中含有微生物生长所必需的生长因子(硫胺素、核黄素、尼克酸等)、多糖(戊聚糖)等[7-8],故选择麸皮作为桑肠杆菌VL4-3产香兰素的最佳碳源.
2.1.2 氮源对香兰素产量的影响 以高氏一号培养基为基础培养基,固定碳源和无机盐,分别以酵母粉、黄豆饼粉、牛肉膏、大豆蛋白胨、动物蛋白胨、硫酸铵、硝酸铵、磷酸铵和豆粕作为氮源,浓度均为1 g/L,考察不同氮源对香兰素产量的影响.由图2可知,不同氮源对香兰素产量的影响由高到低依次是豆粕、黄豆饼粉、牛肉膏、动物蛋白胨、酵母粉、大豆蛋白胨、硝酸钾、硫酸铵、硝酸铵、磷酸铵.实验结果表明以豆粕、硝酸铵、牛肉膏、酵母粉和硝酸钾为氮源时香兰素产量较高,但考虑到生产成本和产物香兰素的天然性,选择豆粕作为桑肠杆菌VL4-3产香兰素的最佳氮源.
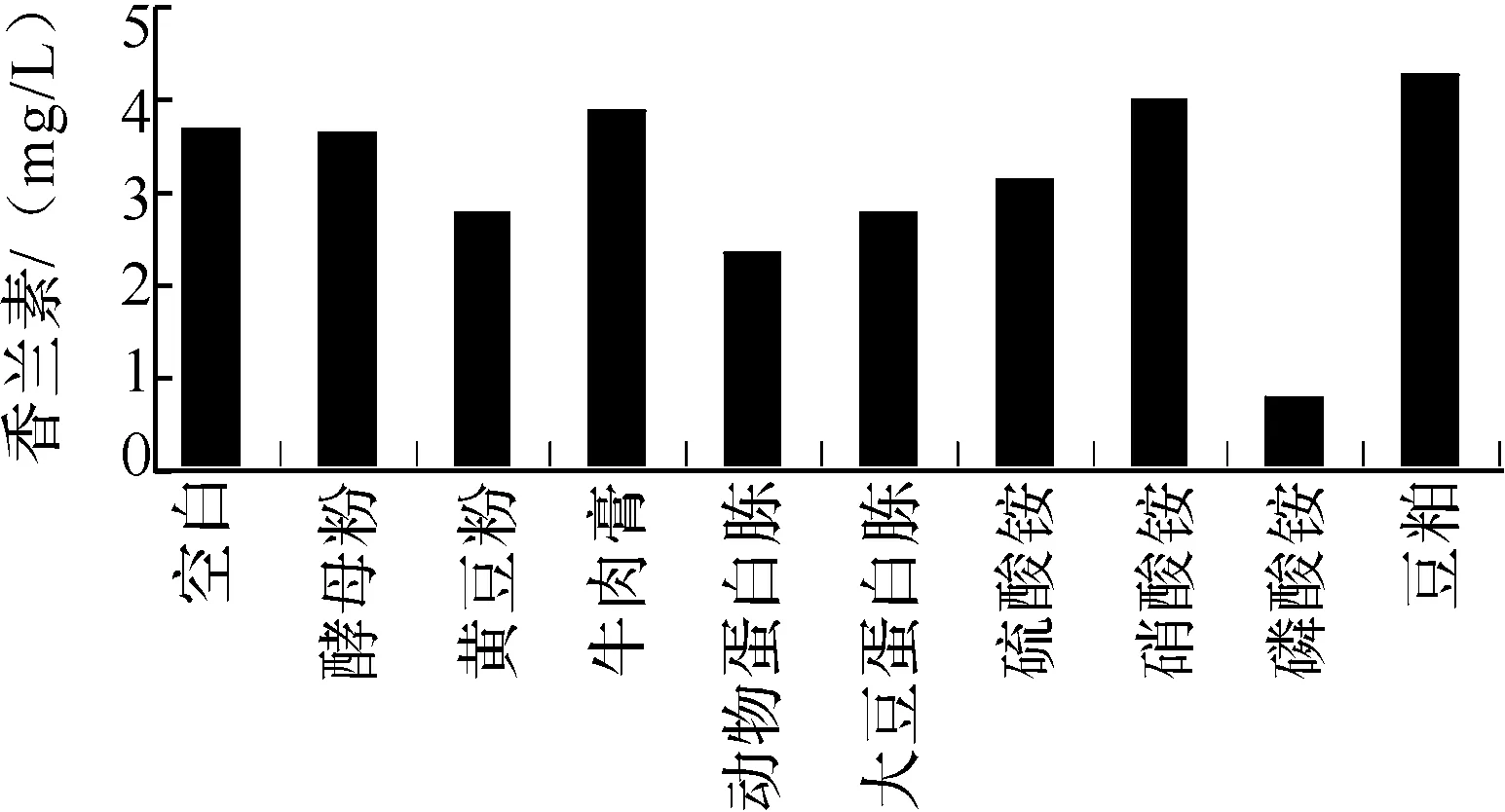
图2 不同氮源对香兰素产量的影响

图3 不同无机盐离子对香兰素产量的影响
2.1.3 无机盐离子对香兰素产量的影响 以高氏一号培养基为基础,固定碳源和氮源,分别以 Na2HPO4、MgSO4·7H2O、FeSO4·7H2O、K2HPO4、CaCl2作为无机盐,浓度均为0.5 g/L,考察不同无机盐对香兰素的影响.由图3可知,磷酸氢盐不利于菌种转化阿魏酸生成香兰素,而硫酸盐利于香兰素的产生,其中以FeSO4·7H2O为无机盐时香兰素的产量最高,故选择FeSO4·7H2O作为桑肠杆菌VL4-3转化阿魏酸生产香兰素的最佳无机盐.
2.1.4 最佳碳源氮源和无机盐相对含量的确定-正交试验 选取L9(34)正交表,对影响香兰素产量的碳源(麸皮)、氮源(豆粕)和无机盐(硫酸亚铁)的添加量进一步做正交试验,其因素和水平见表1,分析结果见表2.由表2的方差分析可见,3个因素对香兰素产量的影响顺序为硫酸亚铁>麸皮>豆粕,即硫酸亚铁的用量对香兰素产量影响最大,豆粕用量对香兰素产量影响最小.根据表2的结果可知最佳组合为麸皮10 g/L,豆粕1 g/L,硫酸亚铁0.5 g/L.

表1 正交设计因素和水平表

表2 正交设计实验表及结果
2.2 发酵培养条件对香兰素产量的影响
2.2.1 发酵培养基初始pH值对香兰素产量的影响 使用优化后的培养基,考察培养基的不同初始pH值对香兰素产量的影响.由图4可以看出,初始培养基pH在3~5时香兰素的产量较低,初始培养基pH在6~10时香兰素的产量相对较高,说明初始培养基在中性及偏碱性条件下更有利于桑肠杆菌VL4-3将阿魏酸转化为香兰素,且当pH值为8时香兰素的浓度最高,故选用pH 8作为发酵培养基的最佳pH值.

图4 发酵培养基初始pH值对香兰素产量的影响

图5 发酵温度对香兰素产量的影响
2.2.2 发酵温度对香兰素产量的影响 使用优化的培养基(pH=8.0),考察不同发酵温度对香兰素产量的影响.由图5可以看出,当温度在30~37 ℃之间时,香兰素的产量逐渐升高;当温度在37~40 ℃时,香兰素的产量显著降低.且当温度在37 ℃时,发酵液中的香兰素浓度最高,故以37 ℃作为菌种转化阿魏酸生产香兰素的最佳发酵温度.
2.2.3 接种量、阿魏酸添加量和阿魏酸添加时间对香兰素产量的影响 在上述优化的培养条件下,选取L9(34)正交表,考察菌种接种量、底物添加量和底物添加时间对香兰素产量的影响.试验因素和水平设计见表3,试验结果方差分析见表4.结果表明,3个因素对香兰素产量的影响顺序为阿魏酸加入量>阿魏酸加入时间>菌种接种量,三因素最佳组合为菌种接种量为10%,底物添加量为8.5 g/L,底物添加时间为24 h.

表3 正交设计因素和水平表

表4 正交设计实验表和结果分析
2.2.4 摇瓶装液量和转速对香兰素产量的影响 转速和摇瓶装液量是影响溶氧及氧化还原反应的两个重要因素.在上述优化的实验条件和固定转速(100 r/min)情况下,考察了装液量对香兰素产量的影响.由图6可以看出,当装液量大于容器容积10%时,发酵液中香兰素的浓度均明显降低,故实验选用10%的装液量(500 mL三角瓶中加入50 mL发酵培养基).在上述优化的实验条件下和固定装液量(容器容积的10%)情况下,考察摇床转速对香兰素产量的影响.由图7可以看出,随着转速的增加,香兰素的产量降低,当发酵转速为100 r/min时,发酵液中香兰素的浓度最高,故实验选用100 r/min为发酵转速.
2.2.5 发酵过程光照/避光对香兰素产量的影响 由于香兰素和阿魏酸在光照条件下易分解,因此我们考察光照发酵和避光发酵对香兰素产量的影响.由图8可以看出,在避光发酵条件下香兰素的产量更高,因此桑肠杆菌VL4-3转化阿魏酸生产香兰素更适合在避光条件下进行.
2.3 种子培养基和培养条件的优化
2.3.1 种子液的培养温度对香兰素产量的影响 以上述优化的发酵培养基与发酵培养条件下,考察种子培养温度对香兰素产量的影响,结果见图9.随着种子液的培养温度增加,香兰素产量逐渐降低,故实验选用25 ℃作为种子培养的最佳温度.

图6 摇瓶装液量对香兰素产量的影响
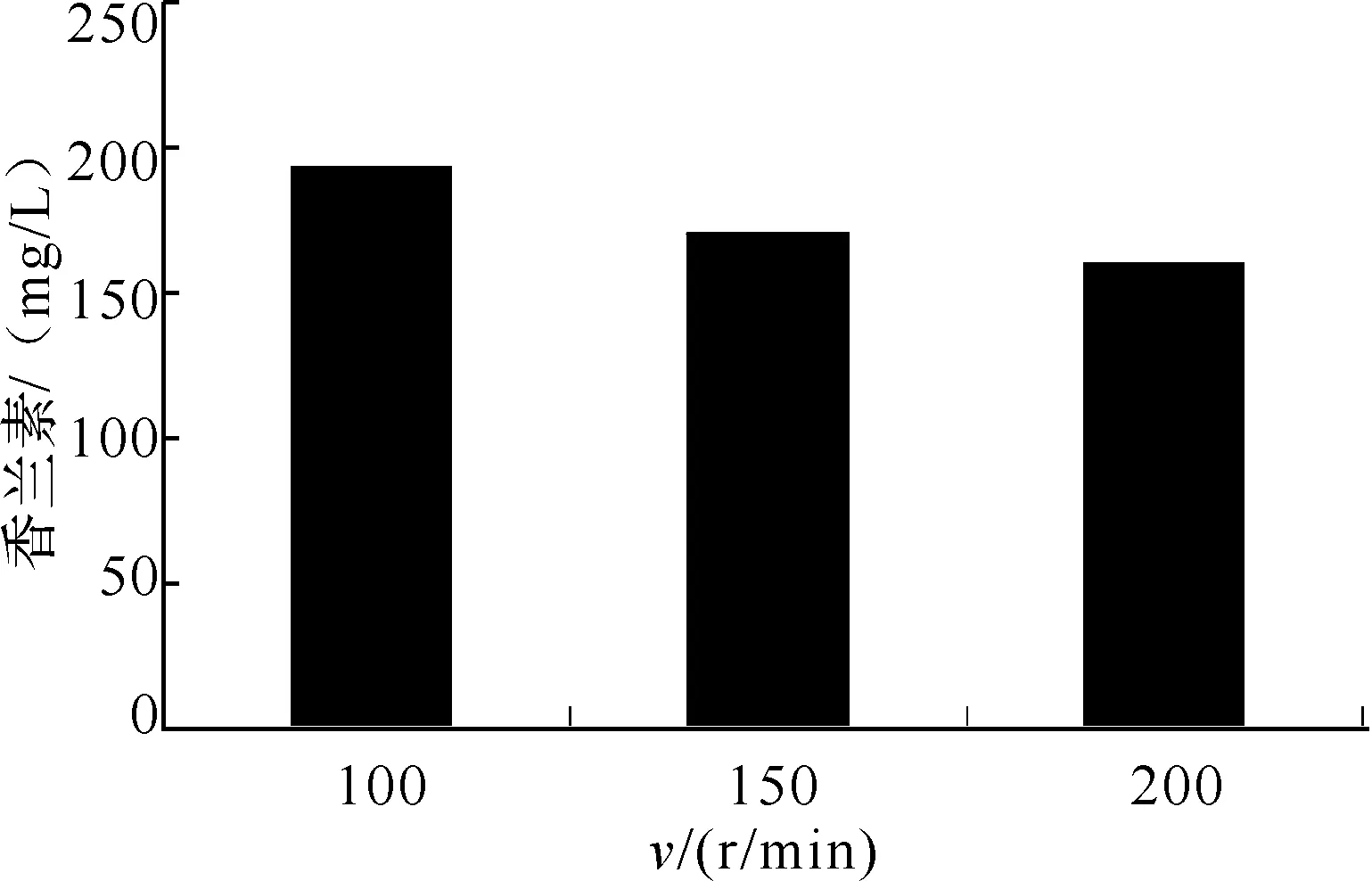
图7 发酵转速对香兰素产量的影响
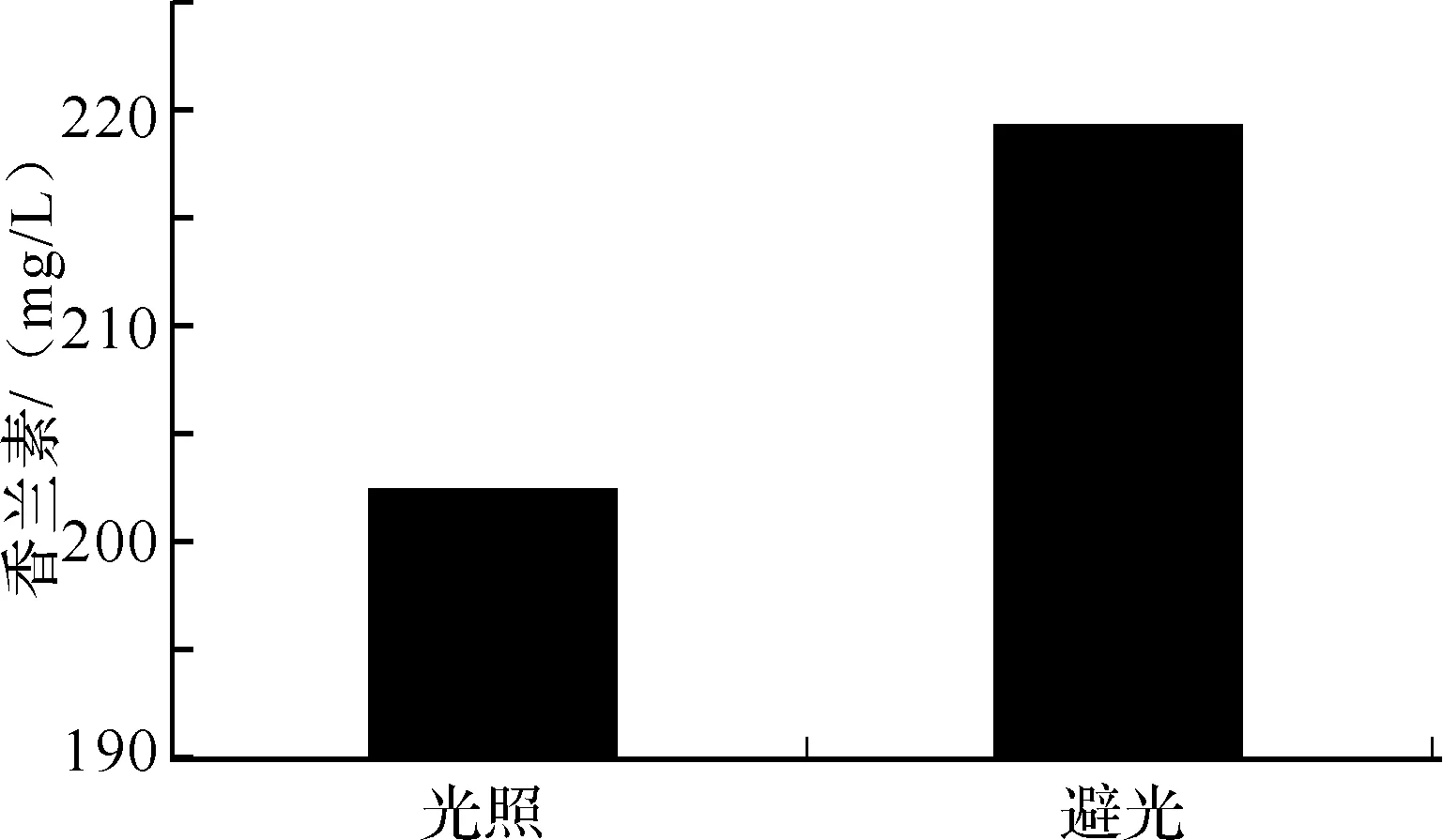
图8 光照条件对香兰素产量的影响
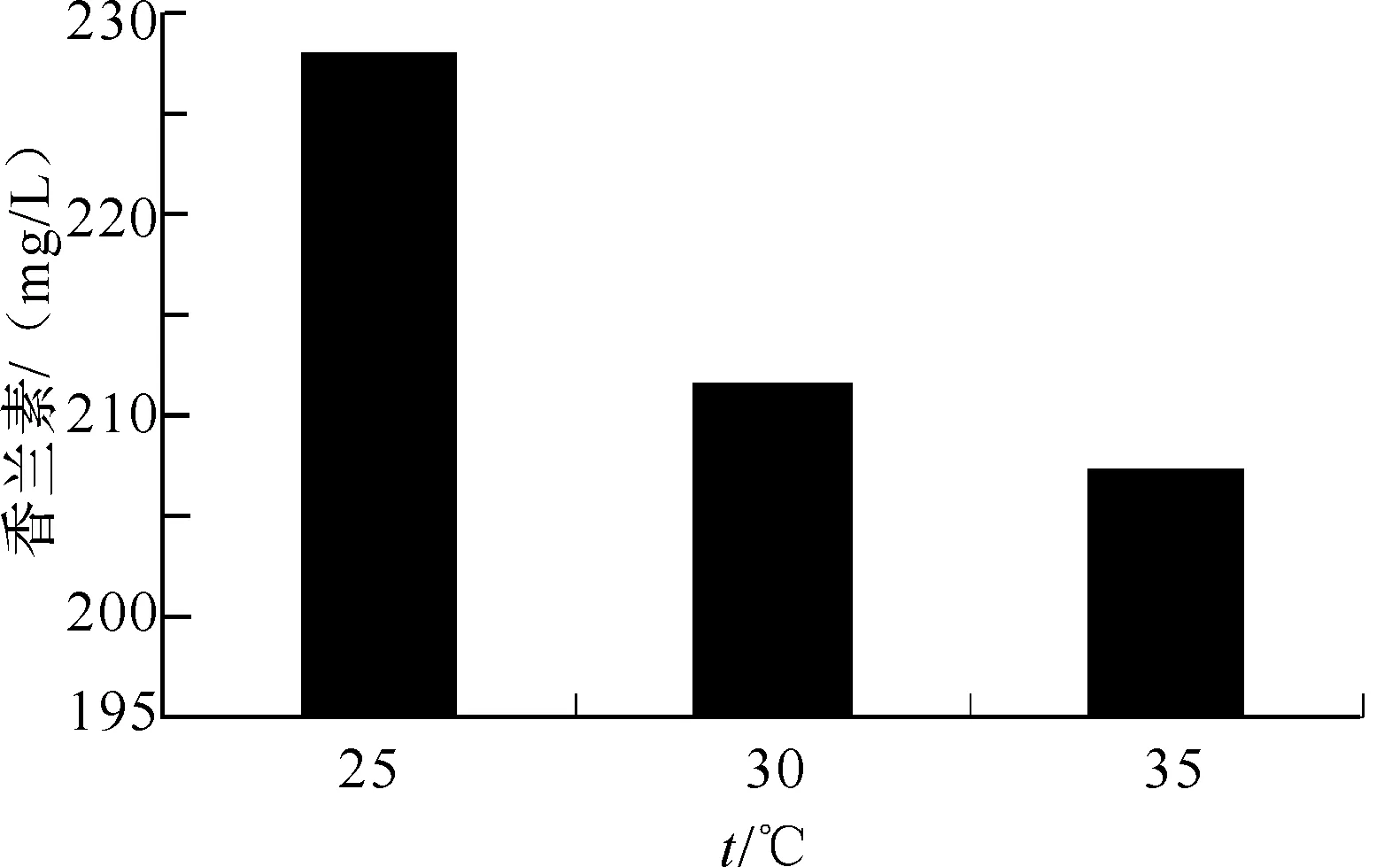
图9 种子培养温度对香兰素产量的影响
2.3.2 种子培养基对香兰素产量的影响 考察高氏一号培养基、牛肉膏蛋白胨培养基、麦芽糖蛋白胨培养基作为种子培养基对香兰素产量的影响,结果见图10.由于高氏一号培养基的营养贫乏,种子液中的菌种繁殖较慢,导致接种到发酵培养基中的菌种量少,因而得到的香兰素浓度较低.牛肉膏蛋白胨培养基和麦芽糖蛋白胨培养基中营养充足,但后者相对前者发酵液中香兰素浓度更高,因此选择麦芽糖蛋白胨培养基作为该菌种转化阿魏酸生产香兰素的种子培养基.
2.3.3 种子液的转速对香兰素产量的影响 种子液培养转速能影响菌种的数量,因此考察种子液培养转速分别为100、150、200 r/min时对香兰素产量的影响,结果见图11.在100 r/min时香兰素的产量最高,150 r/min时香兰素的产量最低,故选择100 r/min作为种子培养基的培养转速.

图10 种子培养基对香兰素产量的影响

图11 种子液培养转速对香兰素产量的影响

图12 底物加入量对香兰素产量的影响
2.4底物最大加入量由于阿魏酸对菌种有一定的毒性,因此菌种对阿魏酸的耐受程度直接影响发酵液中香兰素的浓度.在接种24 h后,我们分别考察底物加入量对香兰素产量的影响.图12是不同底物添加量培养12 d时香兰素的含量测定结果.当阿魏酸加入量在5.00 ~10.00 g/L之间,香兰素产量升高,当阿魏酸加入量在10.00~13.33 g/L之间时,香兰素的产量呈递减趋势.因此选用10 g/L的阿魏酸作为该菌种的最大耐受量.
2.5优化结果的验证经优化得到VL4-3转化阿魏酸生成香兰素的最佳发酵条件如下.
液体发酵的最佳培养基:麸皮10 g/L,豆粕1 g/L,氯化钠0.5 g/L,硫酸亚铁0.5 g/L,pH=8;最佳发酵培养条件:接种量10%,摇瓶装液量 10%,阿魏酸最大加入量 10 g/L,37 ℃,100 r/min,避光培养12 d;最佳种子培养基:牛肉膏蛋白胨培养基;最佳种子培养条件:25 ℃,100 r/min,24 h.
用以上的优化条件,进行了3次重复发酵实验,得到香兰素的浓度为2 262.43 mg/L,转化率达到28.87%.比优化前香兰素浓度(29.6 mg/L)提高了76.43倍,转化率提高了11.4倍.
3 结论
通过单因素实验和正交试验优化后,桑肠杆菌VL4-3将阿魏酸转化为香兰素的发酵培养基组成为麸皮10 g/L,豆粕1 g/L,氯化钠0.5 g/L,硫酸亚铁0.5 g/L,pH=8.0;种子液培养基组成为麦芽糖50 g/L,蛋白胨10 g/L,氯化钠5 g/L.种子液的培养条件为25 ℃、100 r/min转速培养24 h.在容器装液量为10%的发酵培养基中接种10%的VL4-3种子液,培养24 h,加入10 g/L的阿魏酸,37 ℃、100 r/min转速避光培养12 d,发酵液中香兰素的浓度达到2 262.43 mg/L,转化率达到28.87%.
[1] 汪多仁.香草醛的开发与应用[J].北京日化,2000, 60(3):13-18.
[2] 张健,张惟广.发酵合成香草醛研究进展[J].中国食品添加剂,2002(6):22-24.
[3] 春梅.我国制药用香兰素有待开发[J].中国化工信息,2004,(21):8.
[4] 汪多仁.香草醛的开发与应用[J].北京日化,2000, 60 (3):13-18.
[5] Lesage-Meessen L, Stentelaire C, Lomascolo A, et al. Fungal transformation of ferulic acid from sugar beet pulp to natural vanillin[J]. Journal of the Science of Food and Agriculture, 1999,79:487-490.
[6] 赵桂华,何文龙. 朱红秘孔菌培养性状的研究[J] . 林业科学研究, 1995,8(2):230-234.
[7] 江晖, 何珣. 小麦麸皮功能性成分的研究进展[J]. 安徽农业科学, 2011, 39(2):834-835.
[8] 李良果,张克,赵义云. 水稻谷壳的综合利用[J].环境保护, 1996, (9):46-47.

