葛根素磷脂复合物的制备及鉴别
孙燕 (山东畜牧兽医职业学院 山东 潍坊 261021)
葛根素磷脂复合物的制备及鉴别
孙燕 (山东畜牧兽医职业学院 山东 潍坊 261021)
采用正交设计优化复合物的制备工艺;用透射电镜、紫外分析(UV)和红外分析法(IR)对形成的复合物进行鉴别。结果表明:葛根素磷脂复合物的优化制备条件为:在40℃下以无水乙醇为反应溶剂,葛根素与大豆磷脂的比例为1:2(m/m),药物反应浓度为10mg·ml-1,反应时间为1.5h;透射电镜下观察显示:葛根素磷脂复合物的物理形态为类似脂质体的椭圆形多层囊;UV结果显示:大豆磷脂在400~200nm波长区无吸收峰,葛根素、葛根素磷脂复合物和葛根素磷脂混合物的紫外图谱形状相同,最大吸收峰均在250.2nm处,IR结果显示:葛根素磷脂复合物的IR图谱为葛根素与大豆磷脂不同光谱的加合。结论:葛根素磷脂复合物的形成受溶剂、反应物浓度和反应物投料比例的影响较大;磷脂复合物中葛根素和大豆磷脂的基本化学结构没有发生根本的改变,未形成新的化合物,也不是混合物,而是一个磷脂复合物。
葛根素 磷脂复合物 鉴别
葛根素(Puerarin Pue)是常用中药葛根(Pueraria Lobata Ohwi)的主要有效成分,是一种黄酮类化合物,具有扩张冠状动脉和脑血管、降低心肌氧耗、改善心肌收缩功能、降低血液粘度、增加脑血流量等药理作用[1-4],由于葛根素结构中的多苯环和多羟基的原因,其极性较大,水溶性较小(属微溶于水的药物)[5]脂溶性也小(难溶于氯仿),难以被胃肠道等生物膜吸收,口服生物利用度小于15%[6,7],从而限制了葛根素在临床上的应用。据报道,天然活性成分与磷脂在一定条件下进行复合,得到天然活性成分磷脂复合物(phospholipid complex),其理化性质和生物特性较原化合物均有不同程度的改变,具有较强的亲脂性,可有效地提高天然活性成分在体内的吸收,显著地改变其生物有效性[8,9]。本文制备葛根素磷脂复合物,并对其进行鉴别,有望提高葛根素口服的生物利用度。
1 材料与方法
1.1 材料
1.1.1 仪器 RH-D-KT/C磁力加热搅拌器(德国IKA公司),MA20型电子分析天平(上海第二天平仪器厂),ZFQ-85A旋转蒸发器(上海医械专机厂),SHB-B循环水式多用真空泵(郑州长城仪器厂),H.H.S 11.2电热恒温水浴锅(上海医疗器械三厂),ZK-82A型真空干燥箱(上海市实验仪器总厂),H-7500透射电子显微镜(日本日立公司),UV-2501PC紫外分光光度计(日本岛津株式会社生产),FT/IR-460型傅立叶变换红外光谱仪(JASCO 日本分光公司)。
1.1.2 药品与试剂 葛根素原料(山东医院科学院药物研究所提供),大豆磷脂(潍坊医学院药理教研室提供),甲醇、乙酸乙酯、无水乙醇、氯仿、丙酮、四氢呋喃等均为分析纯。
1.2 试验方法
1.2.1 葛根素磷脂复合物的制备 利用葛根素不溶于氯仿,而磷脂和葛根素磷脂复合物均易溶于氯仿的特性,将一定量的葛根素和磷脂在一定条件下反应后,减压除去反应溶剂,再加适量的氯仿,充分溶解其中的磷脂及复合物,除去上清液,再用少量氯仿洗涤,收集沉淀,干燥并称重,葛根素的初始投药量与沉淀量的差值即为与磷脂复合的葛根素的量,从而计算出葛根素与磷脂的结合百分率,计算公式如下:葛根素与磷脂的结合率(%)=(AI-AD)/AD×100%,其中,AI为葛根素的初始投药量;AD为沉淀量。
1.2.2 葛根素磷脂复合物的鉴别 取少量葛根素磷脂复合物粉末,加适量的蒸馏水分散后,用铜网沾取样品溶液,经1%磷钨酸染液染色后在透射电子显微镜下观察并拍照。可见葛根素磷脂复合物的物理形态为圆形或椭圆形,包膜完整。
2 结果
2.1 反应溶剂
设定葛根素与大豆磷脂的投料比为1:3(m/m),反应温度为40℃,反应时间为1.5h,葛根素浓度为20mg·ml-1,以葛根素与磷脂的结合百分率为评估标准,对甲醇、乙醇、四氢呋喃、乙酸乙酯、氯仿和丙酮进行考察,优选出最佳反应溶剂,结果见表1。

表1 反应溶剂对结合率的影响 (%)
由表1可以看到,以甲醇和乙醇为反应溶剂时,药物的结合率均超过50%,且两者相比,前者的结合率更高,反应更完全,理应为最佳溶剂,但甲醇毒性较大,综合考虑选乙醇为反应溶剂。
2.2 反应时间
反应溶剂为无水乙醇,分别考察反应时间为0.5、1.0、1.5、2.0、3.0h药物的结合百分率,结果见表2。

表2 反应时间对结合率的影响 (%)
由表2可以看出,药物与大豆磷脂的反应于1.5h后基本完全,受时间影响较小。
2.3 反应温度
考察不同温度下葛根素与磷脂的结合率,结果见表3。

表3 温度对药物复合率的影响 (%)
由表3可以看出,随着温度的升高,药物的结合率略呈上升趋势。
2.4 反应物浓度
反应物浓度(葛根素计)药物结合率的影响,结果见表4。

表4 反应物浓度对药物结合率的影响 (%)
由表4可以看出,反应物的浓度对复合率有较大影响,在其他条件相同的情况下,随药物浓度的增加,药物的结合率逐渐降低。
2.5 葛根素与磷脂的投料比例
考察葛根素与大豆磷脂的投料比不同时的药物反应百分率,结果见表5。

表5 葛根素与磷脂的投料比对药物结合率的影响 (%)
由表5可以看出,药物的结合率随葛根素在体系中所占比例的降低而增加,葛根素与磷脂的投料比对药物的结合率有较大影响。
2.6 葛根素大豆磷脂复合物反应条件的优化
以药物与磷脂的投料比例(A)、反应温度(B)及反应物的浓度(C)这3个影响因素的3个水平进行正交设计,采用L9(34)表,结果见表6。对测定结果进行方差分析,见表7。

表6 正交设计试验结果 (%)
注:n=3
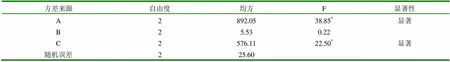
表7 正交设计数据统计分析结果
注:F0.01(2,2)=99,F0.05(2,2)=19
根据表7方差分析的结果,由A因素显著且PA1
2.7 葛根素磷脂复合物的紫外光谱(UV)分析
将大豆磷脂、葛根素、葛根素磷脂混合物、葛根素磷脂复合物分别溶于无水乙醇中,在200~400nm进行紫外扫描,结果显示大豆磷脂在200~400nm波长区无吸收峰,葛根素、葛根素磷脂混合物和葛根素磷脂复合物的UV图谱形状相同,最大吸收峰均在250.2nm处,UV光谱分析表明磷脂复合物中葛根素的发色团的结构未发生改变。
2.8 葛根素磷脂复合物的红外光谱(IR)分析
分别取葛根素、大豆磷脂、葛根素磷脂复合物及葛根素与磷脂的物理混合物少许,采用溴化钾压片法制样,于400~4000cm-1进行红外光谱测定。可以看出,大豆磷脂的IR光谱与葛根素的IR光谱是完全不同的。大豆磷脂与葛根素混合物的IR光谱基本上呈现葛根素的IR图谱特征,但是大豆磷脂IR图谱的几个吸收峰如1733cm-11456cm-1和吸收峰仍能找到,不过这些吸收峰与葛根素的吸收峰靠得很近,其峰体的大部分以相互重叠,故峰体变宽,但在近峰顶部分裂成各自的吸收峰,且峰波数均保持不变。大豆磷脂的另两个1229cm-1和1056cm-1的吸收峰则被葛根素较宽的1257cm-1吸收峰和1118、1081、1040及1000cm-1组吸收峰完全掩盖,葛根素与大豆磷脂混合物的IR图谱为葛根素和大豆磷脂两个成分IR加合。葛根素磷脂复合物的IR图谱与混合物的IR图谱完全不一样,不再保持葛根素IR图谱的基本特征。葛根素的1632cm-1和1257cm-1吸收峰形状和宽度发生了一定的变化,说明葛根素结构中的官能团与大豆磷脂分子的某些部分发生了相互作用。磷脂复合物的IR图谱中所保留的大豆磷脂的2923cm-1和1056cm-1吸收峰形状和宽度也发生了一定的变化,这说明大豆磷脂的结构受到葛根素的影响。IR光谱分析结果表明磷脂复合物中葛根素与大豆磷脂基本化学结构没有发生根本的改变,未形成新的化合物,也不是混合物,而是一个磷脂复合物。
3 讨论
(1)本研究以葛根素和磷脂复合的百分率作为评价指标,采用单因素影响实验和正交设计实验优化了葛根素磷脂复合物的制备工艺,按得到的优化条件制备的磷脂复合物的结合率为80%以上。经过工艺筛选,选择价格低、来源方便、低毒的乙醇为反应溶剂,得到了88%的结合率,这与文献[10]报道的以介电常数大的甲醇和乙醇为反应溶剂时,由于介电常数大所产生的反向电势也大,从而降低了反应物间的相互作用力,不利于异号离子间化合反应的结论不相一致。提示对葛根素磷脂复合物的相关剂型的有待进一步研究。(2)采用透射电镜观察到磷脂复合物的形态呈圆形或椭圆形,类似脂质体。但由于两者的生成机制截然不同,因而其内部结构必定存在差异。脂质体是将药物包裹在由磷脂形成的封闭的囊泡内,药物游离于囊泡内的溶液中,或分散在磷脂的多层膜之间;而磷脂复合物则是药物通过与磷脂的极性端之间的相互作用而与磷脂结合在一起,这并不影响磷脂的两性作用及其在水中分散的特性,当其携带药物分子在水中分散时,分子间有序排列形成外观类似脂质体的多层囊。(3)本研究采用UV光谱分析结果显示,葛根素、葛根素磷脂混合物、葛根素磷脂复合物的UV图谱形状相同,最大吸收峰均在250.2nm处,表明磷脂复合物种葛根素的发色团的结构未发生改变,即磷脂复合物中葛根素的化学结构没有发生根本的变化,没有新物质的生成。(4)IR光谱分析结果显示,葛根素磷脂复合物的图谱较葛根素及物理混合物的图谱发生了明显的变化,这种变化证明了葛根素磷脂复合物是葛根素分子与磷脂的极性端之间发生了相互作用而产生的结果,而不是简单的物理混合。
[1] 王磊一, 赵爱平, 王福文等. 葛根素对大鼠急性脑缺血的保护作用[J]. 中国中药杂志, 1997, 22(12): 752-754.
[2] 刘启功, 王琳, 陆再英等. 葛根素对心肌梗塞犬冠状侧枝循环的影响[J]. 中国中药杂志, 1999, 24(5): 304-6.
[3] Overstreet D.H,Ma Z.Z,Lee D.Y.W.The isoflavone puerarin reduces anxiety symptoms induced by acute 5-HT2cor inverse benzodiazepine agonists or alcohol with drawal[J]. European Neuropsychopharmacology, 2002, 12(3):361-5.
[4] 朱智彤, 李会强, 卢奕等. 葛根素对乳鼠心肌细胞缺氧-复氧时脂质过氧化损伤的保护作用[J]. 中国中药杂志, 2001, 26(12): 856-859.
[5] 王成, 刘玉玲. 葛根素的溶解性及其络合助溶的研究[J]. 中国药学杂志, 1993, 28(5): 294-296.
[6] 张志荣, 游学均, 魏振平等. 愈风宁心胶囊家兔口服药代动力学与生物利用度的测定[J]. 中国药学杂志, 1997, 32(4): 224-226.
[7] 杜立军, 於兰, 常琪等. 新工艺制备的葛根黄酮的药代动力学研究[J]. 中药药理与临床, 1997, 13(2): 19-24.
[8] Bialecha M. The effect of bioflavonoids and lecithin on the course of experimental atherosclerosis in rabbits[J]. Ann Acard Med Stein, 1997.43:41-44.
[9] Gatti G, Peruua E. Plasma concentrations of free and conjugated silybin after oral intake of a silybinphosphatidylcholine complex in healthy volunteers[J]. Clin Pharmacol Ther, 1994, 32(11):614 618.
[10] 吴建梅, 陈大为, 刘艳丽. 黄芩苷磷脂复合物制备工艺的研究[J]. 中国中药杂志, 2001, 26(3): 166-169.
(2012–06–14)
S853.72
A
1007-1733(2012)10-0005-03

